槲皮素通过Akt-mTOR途径上调高糖培养RSC96细胞的自噬
屈 岭,梁晓春,顾 蓓,张 宏,戴 威,石 玥
(中国医学科学院 北京协和医学院 1.北京协和医院 中医科, 北京 100730;2.基础医学研究所 细胞中心, 北京 100005; 3.基础医学研究所 电镜室, 北京 100005)
槲皮素通过Akt-mTOR途径上调高糖培养RSC96细胞的自噬
屈 岭1*,梁晓春1,顾 蓓2,张 宏2,戴 威3,石 玥1
(中国医学科学院 北京协和医学院 1.北京协和医院 中医科, 北京 100730;2.基础医学研究所 细胞中心, 北京 100005; 3.基础医学研究所 电镜室, 北京 100005)
目的探讨槲皮素对高糖离体培养的RSC96细胞自噬变化规律的影响。方法RSC96细胞培养于含有槲皮素的高糖培养基中,超微结构应用透射电子显微镜观察,用免疫荧光法、Western blot法检测Beclin1、LC3Ⅱ、磷酸化的Akt及磷酸化的mTOR蛋白表达,用实时荧光定量PCR法检测Beclin1 mRNA和LC3B mRNA的转录。结果高糖造成RSC96细胞Beclin1和LC3Ⅱ的表达下调,增加Akt和mTOR的磷酸化水平(P<0.05,P<0.01),造成病理形态改变,减少自噬体数量。槲皮素能够上调Beclin1和LC3Ⅱ的表达,下调Akt和mTOR的磷酸化水平(P<0.05,P<0.01),修复病理损伤,增加自噬体数量。结论槲皮素通过下调Akt-mTOR途径磷酸化水平而增加高糖培养RSC96细胞的自噬。
自噬;槲皮素;RSC96;高浓度葡萄糖
自噬是机体重要的生理过程。在机体受到损伤时,它可降解受损的细胞器,为细胞提供能量,维持细胞存活[1]。雷帕霉素受体(mTOR)、Ⅲ型磷酸磷脂酰肌醇激酶(ClassⅢ PI3K)等是自噬的主要调控因素[2],其中mTOR为负调控作用[3- 4],mTOR的活化与Akt/PKB活化密切相关[5- 6]。槲皮素广泛存在于菟丝子、丹皮等多种中药中,具有抗氧化、清除自由基等作用。其可增加被高糖抑制的神经细胞的增殖活性,减少氧化应激损伤,通过诱导自噬而减少凋亡[6- 8]。糖尿病周围神经病变发病机制尚未阐明,自噬在延缓糖尿病慢性并发症等方面具有重要的作用[1,4,9],然而有关自噬与糖尿病周围神经病变关系的研究较少。本研究通过离体实验观察槲皮素对高糖培养雪旺细胞中自噬的影响。
1 材料与方法
1.1 材料
DMEM培养基(Gibco公司);槲皮素、丙酮酸钠、3-MA和谷氨酰胺(Sigma公司);胎牛血清、0.05%胰蛋白酶(Hyclone公司);兔抗Beclin1多克隆抗体、兔抗LC3多克隆抗体、兔抗p-mTOR多克隆抗体和兔抗p-Akt多克隆抗体(Abcam公司);TRITC标记的山羊抗兔IgG(北京西雅金桥生物技术有限公司)。
1.2 细胞培养和实验分组
RSC96细胞(一种永生化的大鼠雪旺细胞,中国科学院上海生命科学研究院细胞资源中心)。复苏RSC96细胞,加入DMEM培养基、胎牛血清(10%)、丙酮酸钠(终浓度1 mmol/L)、谷氨酰胺(终浓度4 mmol/L)、HEPES(终浓度12.5 mmol/L),2~3 d换液1次。
实验分组:1)正常对照(Con)组:DMEM培养基;2)高糖损伤(Glu)组:DMEM高糖培养基(葡萄糖终浓度125 mmol/L);3)槲皮素治疗(Que)组:DMEM高糖培养基+槲皮素终浓度25 μmol/L;4)甘露醇对照(Man)组:DMEM培养基(加入甘露醇使其与Glu组渗透压一致);5)雷帕酶素阳性对照(Rap)组:DMEM高糖培养基+雷帕酶素终浓度10 nmol/L;6)3-甲基腺嘌呤阴性对照(3MA)组:DMEM培养基+3-甲基腺嘌呤2 mmol/L。作用24 h。
1.3 Western blot检测蛋白表达
各组细胞标本加入裂解液进行匀浆,离心取上清液,其蛋白浓度用BCA法测定,上清液用SDS-PAGE电泳分离,并转移到硝酸纤维素膜上,用TBS-T中和硝酸纤维素膜降低非特异性结合。一抗孵育,冲洗后再用二抗孵育,采用ECL试剂盒检测。条带用Gel-Pro图像分析系统进行分析,以目的蛋白/内参的吸光度比值的均数±标准差来表示。重复3次。
1.4 免疫荧光检测蛋白表达及定位
制备细胞爬片,4 ℃丙酮固定,0.1% Triton-X 100打孔,加入正常血清封闭液。加入一抗工作液(1∶50稀释,阴性对照组以PBS代替一抗),湿盒中4 ℃过夜,加入二抗工作液(1∶100稀释),37 ℃孵育20 min,加入DAPI工作液,避光室温下复染10 min。DAPI的蓝色荧光,激发波长364 nm,发射波长488 nm;TRITC的红色荧光,激发波长547 nm,发射波长620 nm。激光共聚焦显微镜下观察并用Leica Confocal图像分析软件照相。采用Image-Pro Plus 6.0软件测量IA。每组选择3个视野,重复3次。
1.5 实时定量PCR检测mRNA
细胞总数大于106个/mL,按Trizol试剂盒说明抽提总RNA。1.5%琼脂糖凝胶电泳检查RNA的完整性,合成cDNA。根据NCBI GenBank 中提供的Beclin1和LC3B的mRNA序列,根据目的基因的RNA序列应用Primer Express2.0设计引物(表1)。按以下反应体系进行:2×SYBR Green qPCR mix 25 μL;上游引物F 1 μL,下游引物R 1 μL;cDNA template 2 μL。PCR扩增反应条件:50 ℃ 2 min;95 ℃ 10 min;95 ℃ 15 s;60 ℃ 60 s(40个循环)。使用Sequence Detection Software 2.2对数据进行处理。计算出每份样品中NGF进行PCR扩增时达到阈值时的Ct值,并通过内参校正。实验中每份样品均做3个复孔,重复3次。
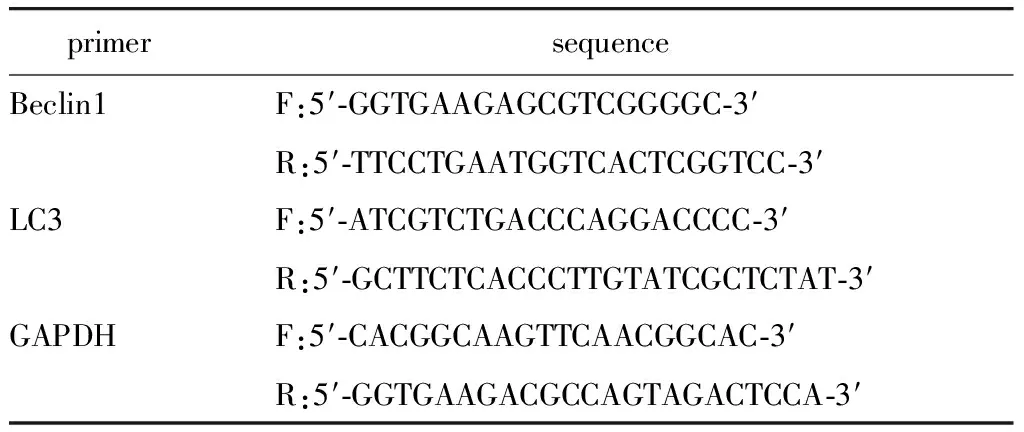
表1 引物序列Table 1 The sequences of primers
1.6 RSC96细胞超微结构的观察
2.5%戊二醛前固定,1%锇酸后固定,乙醇及纯丙酮脱水,丙酮/环氧树脂Epon812包埋,制成超薄切片,醋酸双氧铀及枸橼酸铅染色。各组在×3 000倍视野下,随机选取10个视野。应用IPP6.0软件计数自噬体数量、有核细胞数、含有自噬体的细胞数,计算有自噬体细胞数占有核细胞的百分比、每个细胞内平均自噬体数量等指标。重复2次。
1.7 统计学分析

2 结果
2.1高糖毒性造成RSC96细胞中的自噬相关蛋白表达水平下调
作用24 h,Glu组LC3Ⅱ蛋白与LC3Ⅰ蛋白比值(LC3Ⅱ/LC3Ⅰ)均较Con组降低(P<0.05)(图1A,B)。分别加入甘露醇、自噬促进剂雷帕霉素、自噬抑制剂3-甲基腺嘌呤后,Glu组和3MA组Beclin1蛋白表达较Con组和Rap组减少(P<0.05,P<0.01)(图1C,D)。
2.2槲皮素上调高糖培养RSC96细胞中的自噬相关蛋白表达
Que组Beclin1蛋白和LC3-Ⅱ/LC3-Ⅰ比值表达较Glu组升高(P<0.05,图2A~C)。RSC96细胞中细胞核被标记为蓝色荧光,Beclin1和LC3蛋白被标记为红色荧光(图2D,E)。Glu组Beclin1蛋白的IA值较Con组明显降低(P<0.01);Que组IA值较Glu组明显升高(P<0.01),较Con组明显降低(P<0.01)。Glu组LC3蛋白的IA值较Con组明显降低(P<0.01);Que组IA值较Glu组明显升高(P<0.01)(图2F,G)。
2.3槲皮素对高浓度葡萄糖培养RSC96细胞中自噬相关蛋白转录的影响
Glu组Beclin1和LC3 mRNA相对表达含量较Con组降低,Que组较Glu组升高,但各组间比较无统计学差异(图3A,B)。

A, C.expression of Beclin1 and LC3 in different time were determined by Western blot; B, D.semiquantitative analysis; Con.control group; Glu.high glucose group; Man.mannitol group; Rap.rapamycin group; 3MA.3-methyladenine group; *P<0.05, **P<0.01 compared with Con group; #P<0.01 compared with Rap group
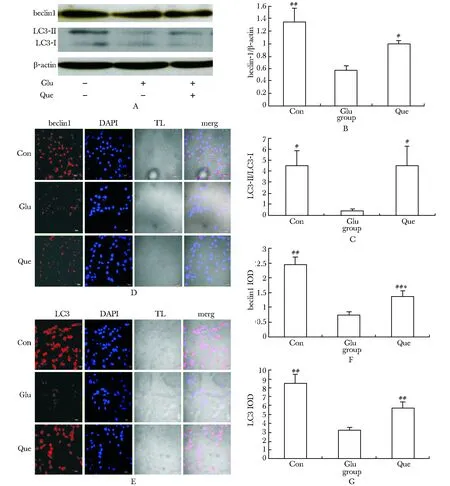
A.expression of Beclin1 and LC3 were determined by Western blot; B, C.semiquantitative analysis; D, E.Beclin1 and LC3 displaying red fluorescence visualized by confocal laser scanning microscope(×600); F, G.semiquantitative analysis; #P<0.05, ##P<0.01 compared with Glu group; *P<0.01 compared with Con group
2.4槲皮素增加高浓度葡萄糖培养RSC96细胞中的自噬
Con组RSC96细胞及细胞核呈卵圆形,核仁明显,染色质均匀;细胞质内可见线粒体等细胞器,可见双层膜结构的自噬体及自噬溶酶体(图4A,B)。Glu组部分RSC96细胞的细胞核形态不规则,染色质不均,细胞质中自噬体及自噬溶酶体少见,直径1 000 nm以上的空泡变性多见(图4C,D)。Que组RSC96细胞及胞核多呈卵圆形,染色质尚均匀,自噬体较Glu组增多(图4E,F)。
Glu组细胞中的自噬体数量、含有自噬体的细胞数、每个细胞内平均自噬体数量、含自噬体细胞占有核细胞百分比均较Con组和Que组减少(P<0.05,P<0.01)(图4G,H)。
2.5 槲皮素增加Akt-mTOR途径磷酸化水平
Glu组p-Akt表达较Con组升高(P<0.05);Que组p-Akt表达较Glu组升高(P<0.05)。Glu组p-mTOR表达较Con组升高(P<0.05);Que组表达较Glu组降低(P<0.05)(图5A,B)。

A.the relative levels of Beclin1 mRNA; B.the relative levels of LC3 mRNA图3 Beclin1和LC3 mRNA表达水平Fig 3 The relative levels of Beclin1 and LC3 mRNA transcripts
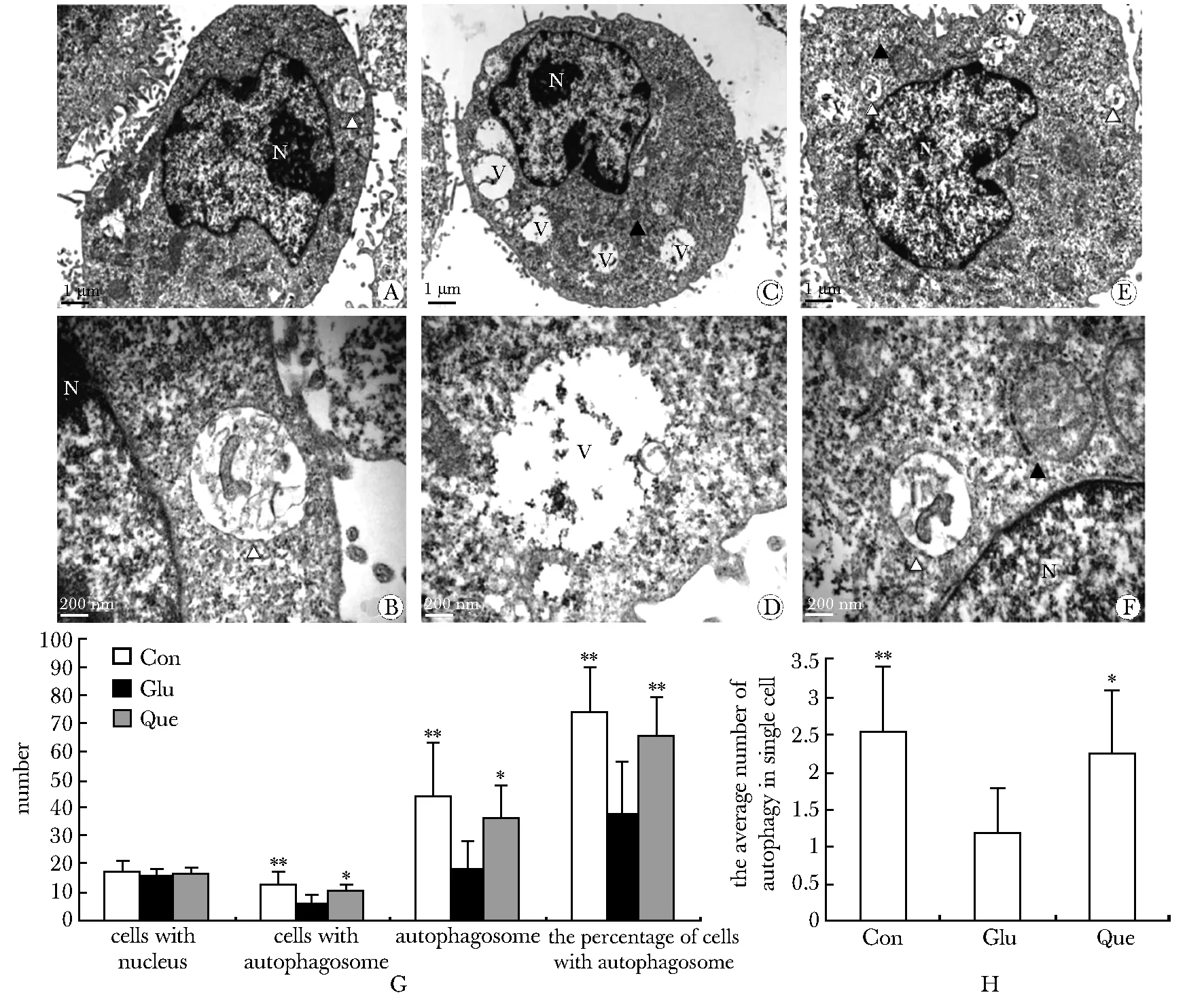
A, B.Con group; C, D.Glu group; E, F.Que group; G,H.semiquantitative analysis of autophagosome number; nucleus(N), mitochondria (▲), autophagosome (△), vacuole structures(V); *P<0.05, **P<0.01 compared with Glu group
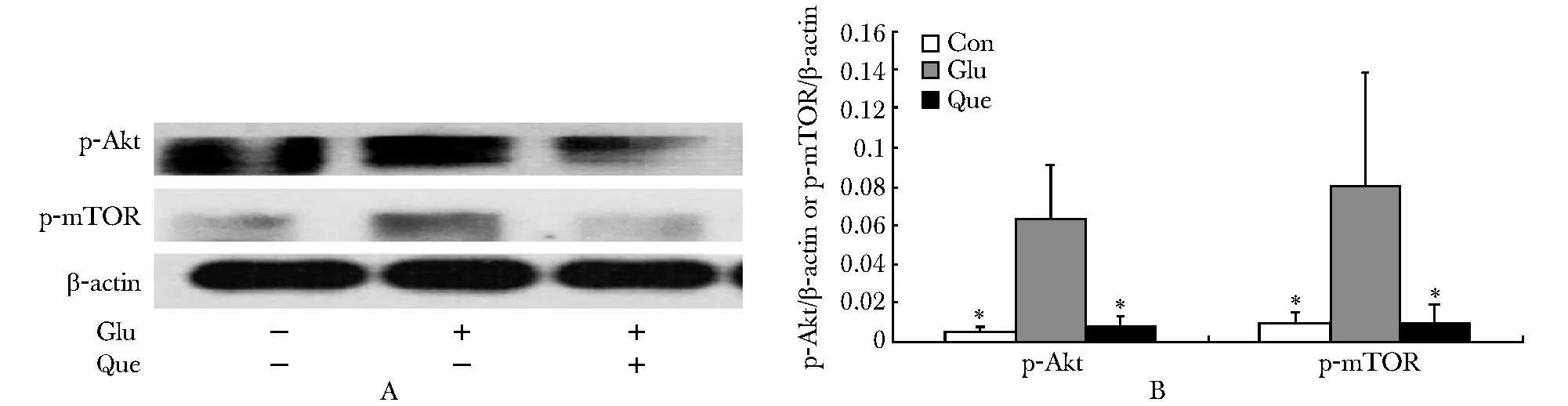
A.expression of p-Akt and p-mTOR were determined by Western blot; B.semiquantitative analysis; *P<0.05 compared with Glu group
3 讨论
LC3是自噬体的标志分子,其含量的多少与自噬泡数量的多少成正比[10]。Beclin1基因表达与自噬的发生正相关,可对细胞自噬活性进行动态监测和判断[11]。本研究发现高浓度葡萄糖可造成RSC96细胞中LC3-Ⅱ/ LC3-Ⅰ比值和Beclin1蛋白表达的下调,而甘露醇组则没有上述改变,提示下调自噬的作用与高糖毒性有关,而与渗透压无关。槲皮素则可以上调LC3-Ⅱ/ LC3-Ⅰ的比值和Beclin1蛋白的表达,且LC3和Beclin1 mRNA的转录水平与蛋白表达趋势一致,表明槲皮素可上调高糖环境中雪旺细胞自噬相关蛋白的表达。
经检索未见到有关高糖环境对体外培养雪旺细胞超微结构影响的文献报道。以其他细胞为模型的离体实验中发现高糖可造成细胞肿胀、细胞器减少及空泡变性等病理损伤[12- 14]。高糖对细胞超微结构的损伤可能与细胞代谢障碍有关[15]。细胞受到外界损伤因素作用时,可通过自噬途径降解自身受损的细胞器以维持合成代谢与能量供给。本研究通过透射电镜观察到正常条件下RSC96细胞中自噬体多呈直径300~900 nm(平均500 nm左右)的双层膜结构,与前人文献报道一致[10- 11]。高糖则可造成RSC96细胞形态不规则,线粒体等细胞器肿胀变形。细胞质中1 000 nm以上的空泡变性多见,且这些空泡没有双层膜样结构。自噬体及自噬溶酶体数量明显减少。槲皮素治疗后RSC96细胞形态较高糖组改善,自噬体数量增多。
自噬的发生受到mTOR途径的负调控。其中Akt/PKB活化后可抑制其下游的TSC1/2,促进mTOR的激酶活性,增加P70S6及4EBPs的活化,减少自噬形成[2- 6]。本实验进一步研究发现高糖可上调Akt和mTOR磷酸化的水平,而槲皮素则能抑制Akt和mTOR的激活。推测槲皮素上调高糖培养雪旺细胞自噬的作用可能与抑制Akt-mTOR的活化有关。
综合上述分子生物学及超微结构检测结果,推测槲皮素可增加高糖培养雪旺细胞的自噬,该作用可能与Akt-mTOR途径有关。但是现有研究尚未完全揭示自噬在高糖毒性中具体的作用机制。在今后的工作中可进一步通过在体研究印证自噬对糖尿病周围神经病变的影响及槲皮素的保护机制,为研发防治糖尿病周围神经病变的药物奠定基础。
[1] Gonzalez CD, Lee MS, Marchetti P,etal. The emerging role of autophagy in the pathophysiology of diabetes mellitus[J]. Autophagy,2011,7:2- 11.
[2] Lee J, Giordano S, Zhang J. Autophagy, mitochondria and oxidative stress: cross-talk and redox signalling[J]. Biochem J,2012,441:523- 540.
[3] Wang Q, Liang B, Shirwany NA,etal. 2-deoxy-D-glucose treatment of endothelial cells induces autophagy by reactive oxygen species-mediated activation of the AMP-activated protein kinase[J]. PLoS One,2011,6:e17234. doi: 10.1371/journal.pone.0017234.
[4] Xie Z, Lau K, Eby B,etal. Improvement of cardiac functions by chronic metformin treatment is associated with enhanced cardiac autophagy in diabetic OVE26 mice[J]. Diabetes,2011,60:1770- 1778.
[5] Hu P, Lai D, Lu P,etal. ERK and Akt signaling pathways are involved in advanced glycation end product-induced autophagy in rat vascular smooth muscle cells[J]. Int J Mol Med,2012,29:613- 618.
[6] Wang K, Liu R, Li J,etal. Quercetin induces protective autophagy in gastric cancer cells: involvement of Akt-mTOR-and hypoxia-induced factor 1α-mediated signaling[J]. Autophagy,2011,7:966- 978.
[7] Shi Y, Liang XC, Zhang H,etal. Quercetin protects rat dorsal root ganglion neurons against high glucose-induced injuryinvitrothrough Nrf- 2/HO- 1 activation and NF-κB inhibition[J]. Acta Pharmacol Sin,2013,34:1140- 1148.
[8] Harris CS, Asim M, Saleem A,etal. Characterizing the cytoprotective activity of Sarracenia purpurea L, a medicinal plant that inhibits glucotoxicity in PC12 cells[J]. BMC Complement Altern Med,2012,12:245. doi: 10.1186/1472- 6882- 12- 245.
[9] Miranda S, González-Rodríguez A, García-Ramírez M,etal. Beneficial effects of fenofibrate in retinal pigment epithelium by the modulation of stress and survival signaling under diabetic conditions[J]. J Cell Physiol,2012,227:2352- 2362.
[10] Klionsky DJ, Abdalla FC, Abeliovich H,etal. Guidelines for the use and interpretation of assays for monitoring autophagy[J]. Autophagy,2012,8:445- 544.
[11] Wu CY, Tang ZH, Jiang L,etal. CSK9 siRNA inhibits HUVEC apoptosis induced by ox-LDL via Bcl/Bax-caspase9-caspase3 pathway[J]. Mol Cell Biochem,2012,359:347- 358.
[12] Shen XP, Shu CD, He J. Effect of high glucose or high glucose and high insulin level on phagocytotic function and ultrastructure of activated rat alveolar macrophages[J]. Chin J Pathophysiol,2000,16:357- 361.
[13] Zhu Q, Zhu SR, Kan FY. Effect of high glucose concentration on cultured rabbit Lens’ epithelial cells[J]. J Tongji Univ (Med Sci),2002,14:14- 17.
[14] Xiao XC, Zhou QL, Wu XY,etal. Effect of PPARγ agonists on the morphologic change and the expressions of FSP1 and E2cad in human renal tubule cells cultured in high glucose medium[J].J Clin Res, 2008,25:2220- 2225.
[15] Ishibashi Y, Sugimoto T, Ichikawa Y,etal. Glucose dialysate induces mitochondrial DNA damage in peritoneal mesothelial cells[J]. Perit Dial Int,2002,22:11- 21.
新闻点击
含糖饮料伤害脑功能导致行为异常
据英国《BBC新闻》(BBC NEWS)2013-11-18报道,澳大利亚最近一项研究发现,经常摄入含糖碳酸饮料会导致“多动症”,长期饮用这类饮料还会导致大脑数百种蛋白质的改变,这种变化模式类似于老年痴呆症发生时的变化。
悉尼麦考瑞大学(Macquarie University in Sydney)的研究人员Jane Franklin女士表示,“我们的研究显示,长期食用这些含糖饮料来代替水,可能引起持久的行为变化和明显的大脑蛋白质化学成分的改变。”
含糖软饮料对身体的损害涉及到各个系统,会导致心脏病、糖尿病、超重、骨质变脆、胰腺癌、前列腺癌、肌肉无力和麻痹等诸多潜在的问题。这项新研究则着重于含糖软饮料对大脑的损伤及行为、意识方面的改变。
Franklin的研究小组比较了喝普通水及喝含糖水两组大鼠的情况。实验所用的含糖水中的糖含量与我们日常所饮用的含糖软饮料所含的糖量相当。仅仅1个月后,吃含糖水的大鼠变得过动、不安。取一部分这组大鼠的大脑组织检查发现,有近300种不同的蛋白质成分发生了变化。
Quercetin up-regulates autophagy in RSC96 cells cultured in high glucose via the pathway of Akt-mTOR
QU Ling1*, LIANG Xiao-chun1, GU Bei2, ZHANG Hong2, DAI Wei3, SHI Yue1
(1.Dept. of Traditional Chinese Medicine,PUMC Hospital,PUMC & CAMS,Beijing 100730; 2.Cell Center,Institute of Basic Medical Sciences,
PUMC & CAMS,Beijing 100005; 3.Dept. of Electron Microscope, Institute of Basic Medical Sciences, PUMC & CAMS,Beijing 100005,China)
ObjectiveTo observe the effect of the quercetin on autophagy of RSC96 cultured in high glucose.MethodsRSC96 cells were cultured with high glucose or quercetin.Ultrastructure was performed using transmission electron microscopy. The expression of beclin1, LC3Ⅱ, phosphorylation of Akt (p-Akt), and phosphorylation of mTOR (p-mTOR) were detected by immunofluorescence and Western blot.Real-time fluorescent PCR analysis showed that the level of Beclin1 mRNA and LC3 mRNA.ResultsQuercetin significantly alleviated the pathological morphology of RSC96 cells and up-regulated the Beclin1 and LC3-Ⅱexpressions(P<0.05,P<0.01), increased autophagosome, but down-regulated the p-Akt and p-mTOR expressions(P<0.05,P<0.01).ConclusionsQuercetin up-regulates autophagy in RSC96 cells cultured in high glucose by the pathway of Akt-mTOR.
autophagy; quercetin; RSC96; high glucose
2015- 01- 28
:2015- 03- 13
国家自然科学基金(81403224);北京市自然科学基金(7132189);北京协和医院科研基金(2013-098)
*通信作者(correspondingauthor):quling@pumch.cn
1001-6325(2015)05-0596-07
研究论文
R587. 2
:A

