衰老相关miRNAs的筛选及鉴定
刘 伟,刘 畅,阴 彬,彭小忠,2*
(1.中国医学科学院 基础医学研究所 北京协和医学院 基础学院 医学分子生物学国家重点实验室; 2.中国医学科学院 神经科学中心; 3.中国医学科学院 基础医学研究所 北京协和医学院 基础学院人体解剖与组织胚胎学系, 北京 100005)
衰老相关miRNAs的筛选及鉴定
刘 伟1,3,刘 畅1,阴 彬1,彭小忠1,2*
(1.中国医学科学院 基础医学研究所 北京协和医学院 基础学院 医学分子生物学国家重点实验室; 2.中国医学科学院 神经科学中心; 3.中国医学科学院 基础医学研究所 北京协和医学院 基础学院人体解剖与组织胚胎学系, 北京 100005)
目的以快速老化模型SAM小鼠的海马组织作为研究对象,通过miRNA芯片大规模筛选与衰老相关的miRNAs,为探讨衰老的机制提供线索。方法随机各选取3只4、8和12月龄SAMP8及SAMR1小鼠,提取海马组织RNA进行芯片检测;以snRNA U6作为内参, SYBR Green作为染料 ,用real-time PCR方法进行验证,对miRNA的表达进行相对定量分析。结果对比miRNA芯片和real-time PCR验证结果,证实芯片结果具有相对较好的重复性和真实度。对3张miRNA芯片结果进行综合分析,在4和8月龄均表现出表达差异的miRNA共7个,在8和12月龄均表现出表达差异的miRNA共8个,4和12月龄均表现出表达差异的miRNA共3个,在3个月龄间均表现出明显表达差异的1个(miR-9*)。结论miRNAs在SAMP8及SAMR1的差异表达提示其在SAMP8衰老进程中发挥重要作用。
衰老; miRNAs; SAM小鼠; 海马
衰老(aging,senescence)又称老化,通常是指在正常状况下生物发育成熟后,随年龄增加,自身机能减退,内环境稳定能力与应激能力下降,结构、组分逐步退行性变,趋向死亡的不可逆转的现象。对衰老的研究一直是生命科学领域最为基本和重要的问题之一,在2013年Cell杂志上列出了衰老的9个标志物,作为其中之一的表观改变发挥着重要作用,尤其是非编码RNA参与的转录调控[1]。MicroRNA(miRNA)是一类长约20~25nt的非编码RNAs,主要通过作用于靶基因的3′UTR,降解靶mRNA或抑制靶mRNA的翻译,发挥调控作用。目前的研究表明,miRNA在生命活动的各项过程中发挥着重要作用。抑制miRNA lin- 4的活性可加速组织衰老,而过表达lin- 4可延长线虫的寿命[2]。miRNA lin- 4作用其靶基因lin- 14,通过胰岛素生长因子1通路调节线虫的寿命。上述研究虽在一定程度上揭示了miRNA在衰老和一些老年疾病中的作用,但在衰老过程中参与的miRNA有哪些,目前还缺乏一个整体的认识。为了研究在老化过程中的miRNAs,本研究选择了快速老化SAM小鼠的海马组织作为研究对象,通过miRNA芯片大规模筛选与衰老相关的miRNAs,为探讨衰老的机制提供线索。
1 材料与方法
1.1 实验动物
快速老化模型小鼠,简称老化鼠(senescence accelerated mouse, SAM), SPF级SAMP8和SAMR1小鼠,雄性,25 g左右(天津中医药大学第一附属医院老化鼠研究中心动物房)。4、8和12月龄SAMP8及SAMR1小鼠饲养于中国医学科学院基础医学研究所动物房,室温22~24 ℃,自由饮食,昼夜各12 h。
1.2 主要试剂
Trizol® Reagent(Invitrogen公司),TIAN Script M-MLV反转录试剂盒(北京天根公司),SYBR Premix Ex Taq试剂盒(TaKaRa公司)。
1.3 miRNA芯片
各月龄小鼠均随机选取3只,提取海马组织RNA用LC Science公司芯片检测。4月龄SAMP8及SAMR1小鼠海马组织RNA被置于同一张芯片上进行检测;8月龄、12月龄样品处理同4月龄。
1.4 Real-time PCR
用改良的“Stem-loop RT+real-time PCR”的方法结合本实验室的实际情况,采用以snRNA U6作为内参、用SYBR Green作为染料的real-time PCR方法进行实验,对miRNA的表达进行相对定量分析及数据处理。
1.5 统计学分析
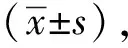
2 结果
2.14月龄SAMP8及SAMR1小鼠miRNA芯片结果及real-timePCR验证
将芯片中具有表达差异的部分miRNAs的信号数值用条形图显示(图1A)。其中,以4月龄SAMR1小鼠作为参照,在同月龄SAMP8小鼠中表达升高的miRNAs有miR-143、 miR-99b、miR-138、 miR-320、 miR-124,降低的有let-7f、 miR-9*、miR-126- 3p、 miR-125b- 5p、miR-125a- 5p、 miR-7a、miR-1937b,miR-218和miR-9。miR-138和miR-320的real-time PCR验证结果(图1B)与4月龄SAMR1相比,SAMP8小鼠中表达降低,此与芯片结果趋势相反,其余各差异miRNA real-time PCR结果均与芯片结果的变化趋势一致。
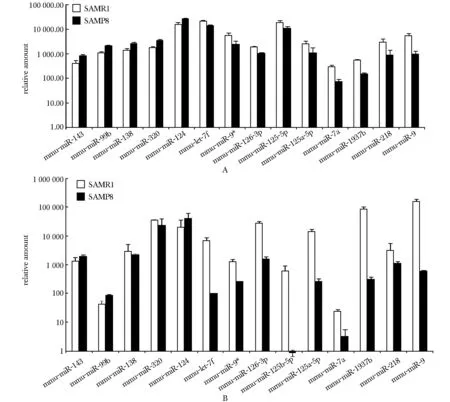
2.28月龄SAMP8及SAMR1小鼠miRNA芯片结果及real-timePCR验证
8月龄SAMP8及SAMR1小鼠的miRNA芯片信号数值(图2A)与同月龄SAMR1小鼠相比,在SAMP8小鼠中表达升高的miRNAs有 miR-2145、 miR-2142、 miR-122、 miR-690、 miR-138、 miR-382、 miR-720、 miR-709、 let-7a、 let-7c和miR-124, 降低的有miR-9、miR-140*、miR-7a、miR-30b、miR-222、let-7g、miR-495、miR-137 miR-532- 5p、miR-451、miR-29b、miR-191、miR-434- 3p、miR-29c、miR-218、miR-221、 miR-30c、 miR-29a、 miR-125b- 5p和 miR-9*。同前,用real-time PCR验证了8月龄SAMP8及SAMR1小鼠中表达差异的miRNA(图2B)。与芯片结果相比,其中miR-222、miR-122和miR-495的real-time PCR结果趋势相反,其余差异miRNAs验证结果均与芯片的变化趋势一致。
A.miRNA microarray signal values of 4- month-old SAMP8 and SAMR1 mice; B.miRNA real-time PCR results of 4- month-old SAMP8 and SAMR1 mice
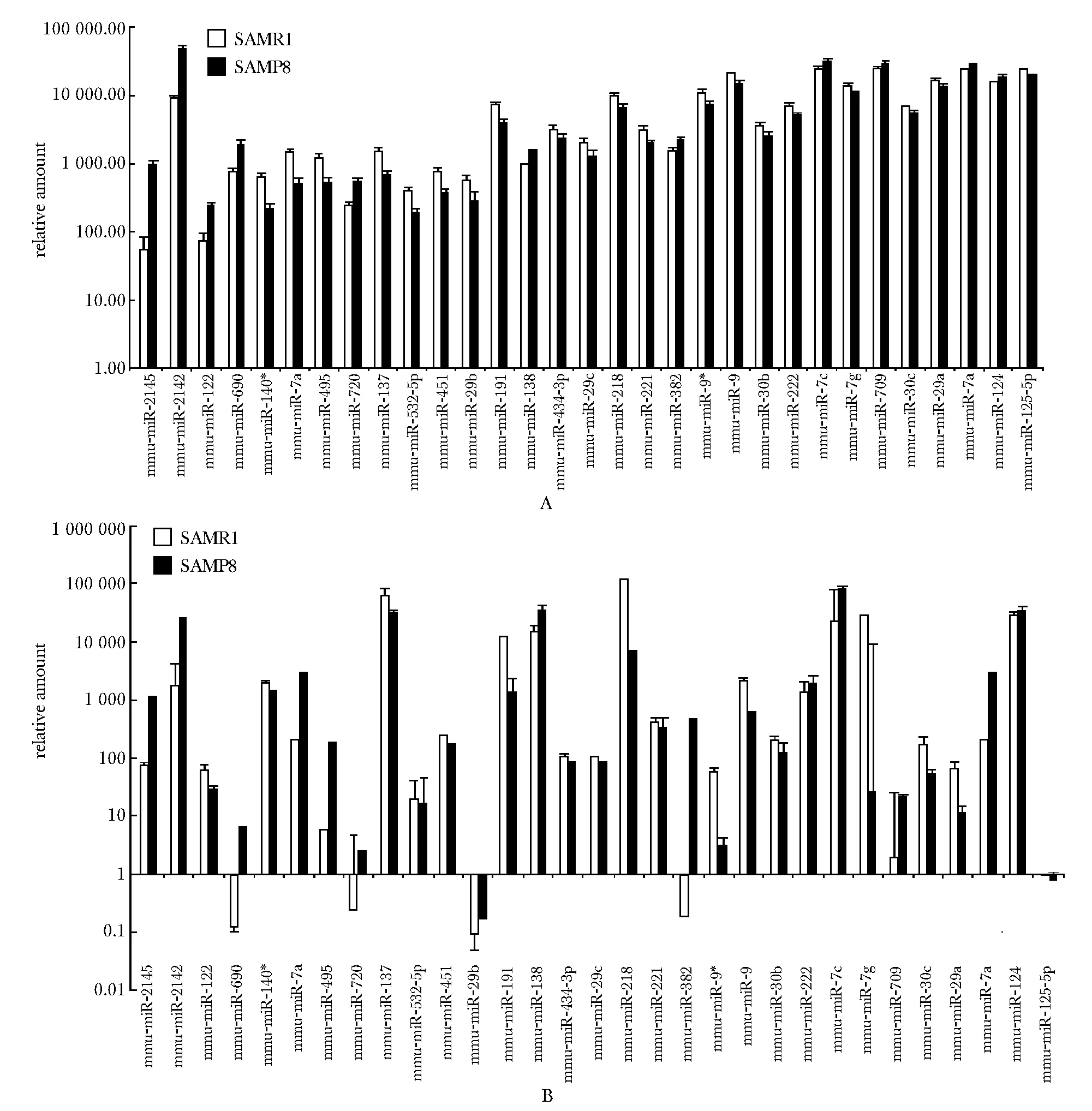
2.312月龄SAMP8及SAMR1小鼠miRNA芯片结果及real-timePCR验证
12月龄SAMP8及SAMR1小鼠miRNAs的芯片信号数值(图3A)与同月龄SAMR1小鼠相比,在SAMP8小鼠中表达升高的miRNAs有miR-204、 miR-122、 miR-690、 miR-143、miR-709、 let-7i、 miR-2142, miR-24和 miR-23b,降低的有miR-9*、 miR-129- 3p、 miR-221、 miR-29c、 miR-125a- 5p、 miR-191、miR-137和 miR-495。同前,用real-time PCR验证了12月龄SAMP8及SAMR1小鼠中表达差异的miRNAs(图3B)。与芯片结果相比,其中miR-122、 miR-191和miR-221的结果趋势相反,其余各差异miRNAs验证结果均与芯片的变化趋势一致。
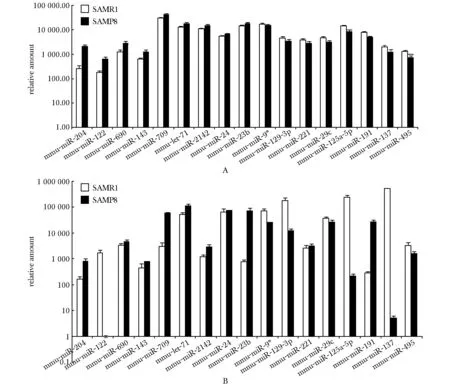
2.44、8和12月龄SAMP8和SAMR1miRNA芯片结果的整体分析
经过比对,表达差异的miRNAs在4和8月龄共有的7个,分别是miR-124、 miR-125b- 5p、 miR-138、 miR-218、miR-7a、 miR-9和 miR-9*;在8和12
A.miRNA microarray signal values of 8- month-old SAMP8 and SAMR1 mice; B.miRNA real-time PCR results of 8- month-old SAMP8 and SAMR1 mice
月龄共有的8个,分别是miR-137、 miR-191、 miR-221、 miR-29c、miR-495,miR-709、 miR-690和 miR-9*;在4和12月龄共有的3个,分别是miR-143、 miR-125b- 5p和 miR-9*;在3个月龄均有表达差异的只有1个,为miR-9*(图4)。
3 讨论
本研究选用的SMAP8小鼠是通过自然筛选出的具有典型的学习记忆能力下降、认知功能存在障碍的老化模型。SAMR1表现为正常衰老,一般作为SAMP8的正常对照[3]。
A.miRNA microarray signal values of 12- month-old SAMP8 and SAMR1 mice; B.miRNA real-time PCR results of 12- month-old SAMP8 and SAMR1 mice
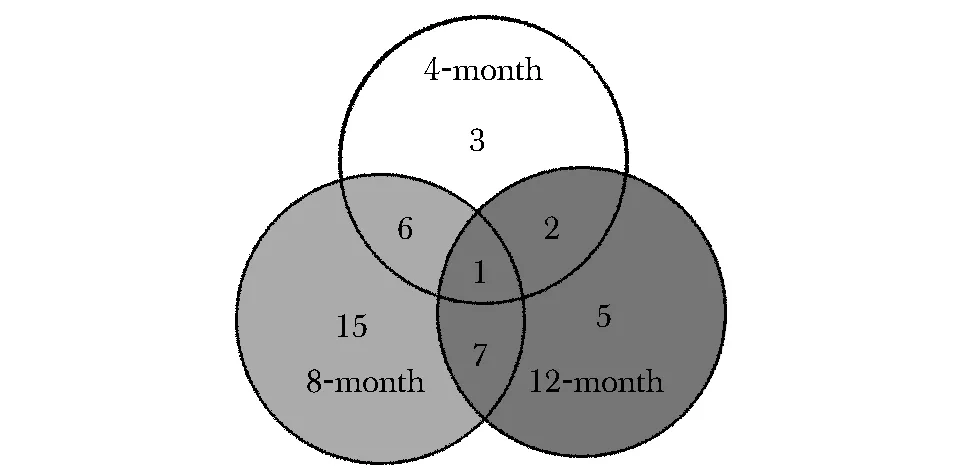
The pie chart shows different expressions of miRNAs in 4, 8 and 12 months SAMP8/SAMR1 mice图4 4、8和12月龄SAMP8/SAMR1小鼠miRNA芯片结果的整体分析Fig 4 Analysis miRNAs microarray results of 4, 8 and 12 months SAMP8/SAMR1 mice
细胞衰老因素的积累和干细胞活性的降低这两大因素被认为在组织器官乃至个体的老化中发挥着决定性的作用[4],本研究通过芯片和real-time PCR验证显示miRNAs在衰老过程中也扮演了关键的角色。
miRNA通过其转录后调控作用参与到组织器官再生、细胞的衰老、神经系统发育和神经退行性疾病中[5- 7]。miR-146a/b在衰老的成纤维细胞中显著增高,进而抑制IL- 6和IL- 8分泌,同时下调IL- 1受体信号传导通路的关键组成因子IRAK1,最终证实miR-146参与分泌途径的衰老进程[8]。老化是动脉粥样硬化与冠状动脉疾病发展的重要危险因素。通过miRNA芯片在成纤维细胞衰老过程中筛选出miR-143,过表达miR-143可以引起对照年轻的成纤维细胞生长停滞[9]。在芯片结果中也发现,miR-143在SAMP8小鼠中表达升高,可能是其加速衰老的原因之一。
miR-124是神经系统特异表达并且丰度高的miRNA,在中枢神经系统神经发育诱导中发挥重要作用[10],而本结果提示其在衰老过程中可能也扮演重要角色。miR-134通过调节Sirt1与记忆功能相关[11], miR-204参与视网膜的发育过程[12],miR-137抑制胶质母细胞瘤和神经干细胞的增殖[13],下调miR-125b可以明显抑制PC- 3细胞生长[14]。这些miRNAs在芯片结果中表达有差异,因其本身就在诸多生理过程中发挥重要作用,不难理解它们的改变也会是衰老进程中重要的一个环节。
[1] López-Otín C, Blasco MA, Partridge L,etal.The hall marks of aging [J]. Cell, 2013,153:1194- 217.
[2] Boehm M, Slack F. A developmental timing microRNA and its target regulate life span in C. elegans [J]. Science, 2005, 310:1954- 1957.
[3] Takeda T, Matsushita T, Kurozumi M,etal. Pathobiology of the senescence-accelerated mouse (SAM)[J]. Exp Gerontol, 1997, 32:117- 127.
[4] Collado M, Blasco MA,etal. Cellular senescence in cancer and aging [J]. Cell, 2007, 130:223- 234.
[5] Farazi TA, Spitzer JI, Morozov P,etal. miRNAs in human cancer [J]. J Pathol, 2011, 223:102- 115.
[6] Siomi H, Siomi MC. On the road to reading the RNA-interference code [J]. Nature, 2009, 457:396- 404.
[7] Mudhasani R, Zhu Z, Hutvagner G,etal. Loss of miRNA biogenesis induces p19Arf-p53 signaling and senescence in primary cells [J]. J Cell Biol, 2008, 181:1055- 1063.
[8] Hou J, Wang P, Lin L,etal. MicroRNA- 146a feedback inhibits RIG-I-dependent Type I IFN production in macrophages by targeting TRAF6, IRAK1, and IRAK2[J]. J Immunol, 2009, 183:2150- 2158.
[9] Bonifacio LN, Jarstfer MB. MiRNA profile associated with replicative senescence, extended cell culture, and ectopic telomerase expression in human foreskin fibroblasts [J]. PLoS One, 2010, 5: e12519. doi: 10.1371/journal.pone.0012519.
[10] Schratt GM, Tuebing F, Nigh EA,etal. A brain-specific microRNA regulates dendritic spine development [J]. Nature, 2006, 439:283- 289.
[11] Gao J, Wang WY, Mao YW,etal. A novel pathway regulates memory and plasticity via SIRT1 and miR-134[J]. Nature, 2010, 466:1105- 1109.
[12] Conte I, Carrella S, Avellino R,etal. miR-204 is required for lens and retinal development via Meis2 targeting [J]. Proc Natl Acad Sci U S A, 2010, 107:15491- 15496.
[13] Silber J, Lim DA, Petritsch C,etal. miR-124 and miR-137 inhibit proliferation of glioblastoma multiforme cells and induce differentiation of brain tumor stem cells [J]. BMC Med, 2008, 6:14. doi: 10.1186/1741- 7015- 6- 14
[14] Klusmann JH, Li Z, Böhmer K,etal. miR-125b- 2 is a potential oncomiR on human chromosome 21 in megakaryoblastic leukemia [J]. Genes Dev, 2010, 24: 478- 490.
Screening and identification of ageing associated miRNAs
LIU Wei1,3, LIU Chang1, YIN Bin1, PENG Xiao-zhong1,2*
(1.State Key Laboratory of Medical Molecular Biology, Dept. of Molecular Biology and Biochemistry, Institute of Basic Medical Sciences, CAMS;2.Neuroscience Center, CAMS; 3.Dept. of Human Anatomy, Histology and Embryology,Institute of Basic Medical Sciences, CAMS, Beijing 100005,China)
ObjectiveTo explore the mechanisms of aging,hippocampal tissue of senescence accelerated mouse(SAM)were used to screen aging related miRNAs.MethodsSAMP8 and SAMR1 mice(4-, 8-, 12- month old) were randomly selected 3 in each group, extracting RNA from hippocampal tissue for miRNA microarray. To verify the relative quantitative expression of miRNAs, SYBR Green was used as a dye for the real-time PCR and snRNA U6 was used as control.ResultsBased on the validation of real-time PCR, here we present the microarray results which have better repeatability and authenticity. Comprehensive analysis of three repeat miRNA array data showed that 7 miRNAs, 8 miRNAs and 3 miRNAs were dynamically expressed in the 4- month/8- month, 8- month/12- month and 4- month/12- month hippocampal tissues, respectively. Only miR-9*showed an obviously differential expression pattern in both the three stages.ConclusionsThe differentially expressed miRNAs in SAMP8 and
aging; miRNAs; senescence accelerated mouse; hippocampus
2015- 01- 30
:2015- 03- 15
重大科学研究计划 (2011CBA01104)
*通信作者(correspondingauthor):peng_xiaozhong@163.com
1001-6325(2015)05-0674-06
研究论文
R34
:A
SAMR1 mice could play an important role in the aging process.

