miR-34b在男性不育患者精浆中的表达及其临床意义*
娄江涛 魏任雄余亮亮 张晓霞 崔 云
浙江中医药大学附属宁波中医院男科实验室(宁波 315012)
miR-34b在男性不育患者精浆中的表达及其临床意义*
娄江涛 魏任雄**余亮亮 张晓霞 崔 云
浙江中医药大学附属宁波中医院男科实验室(宁波 315012)
目的 研究精浆游离miR-34b在体外不同条件下的稳定性及其与男性不育症患者精液参数的关系。方法 选取男性不育症患者80例和同期因女方因素不孕前来检查的生育力评估正常的健康男性20例为正常对照组,将8例正常的精液标本分别在室温和-80℃下放置,以不同时间点检测精浆miR-34b的稳定性。采用实时荧光定量PCR检测精浆游离miR-34b的相对含量,精子浓度及精子活力用计算机辅助精子分析系统,精子存活率采用低盐膨胀实验检测,正常精子形态百分率采用Diff-Quick染色法。分析男性不育症组和正常对照组精液参数及miR-34b表达量的差异,对精浆游离miR-34b在男性不育组精浆中的诊断价值进行ROC曲线分析,并采用Pearson直线相关分析miR-34b与男性不育组精液各参数的相关性。结果 精浆游离miR-34b在室温和低温下不同时间点表达量无明显变化(F=0.13, P=0.97; F=0.35,P=0.84)。与正常组比较发现,男性不育组精浆游离miR-34b表达下调(P<0.01)。两组的精子浓度、精子存活率、前向运动精子百分率(PR)和正常形态精子百分率均有差异(P<0.01)。ROC曲线显示miR-34b能够较好的区分不育组与健康对照组,曲线下面积分比(AUC)为0.85(0.79-0.95,95%)。Pearson直线相关分析发现男性不育患者精浆miR-34b表达量与精子密度(r =0.28,P<0.05)、精子活率(r =0.56,P<0.01)、前向运动精子百分率(r =0.41,P<0.01)正相关,与精子形态无相关性(r =0.15,P>0.05)。结论精浆miR-34b在室温下稳定,并能在-80℃条件下长期保存,在男性不育患者精浆中表达下调,并与精子浓度、精子存活率、前向运动精子百分率呈正相关,与精子形态无相关性。
不育, 男性; 微RNAs; ROC曲线
男性不育症诊治困难,相关致病机制尚不清楚。microRNA(miRNA)作为新的切入点,为疾病的认识开辟了一条新的途径。研究表明miRNA分子在精子形成过程中发挥重要作用[1], Bouhallier 和Rokavec等认为miR-34基因家族参与细胞周期、凋亡的调控,与精子的发生、凋亡关系密切[2,3]。本研究通过观察miR-34b在男性不育症中的表达特征,旨在阐明男性不育发生的一种可能机制,为临床诊治提供一种新的分子标志物。
资料与方法
一、对象
选取2012年8月至2014年11月来我院男科就诊的男性不育症患者80例。年龄24~41岁,平均(31.06±4.66)岁。病程2~10年,平均(3.5±4.1)年。婚龄2.4~11年,平均(4.8±4.7)年。身体健康,夫妻性生活正常,未采取任何避孕措施1年以上未使女方怀孕。查体及彩色多普勒超声检查未发现明显睾丸、附睾、输精管异常以及精索静脉曲张。女方均经妇科检查,输卵管通畅实验以及B超、内分泌测定等排除女方不孕因素,同时排除内分泌、遗传、恶性肿瘤、血液系统疾病、自身免疫性疾病、慢性阻塞性肺疾病,肝肾功能异常以及感染等。另外选择同期因女方因素不孕前来检查的生育力评估正常的健康男性20例为正常对照组,年龄25~39岁,平均(29.35±3.36)岁。两组在年龄结构、婚龄等基线资料方面经检验齐同性良好,差异无统计学意义(P>0.05),具有可比性。所有对象均签署知情同意书并经医院伦理委员会同意。
二、主要试剂和仪器
WLJY-9000伟力彩色精子检测系统(北京伟力公司),Diff-Quick染液购自珠海贝索生物技术有限公司,miR-34b TaqMan miRNA逆转录试剂盒,TaqMan miRNA qPCR试剂盒,TaqMan small RNA引物(5×),Taq Man small RNA引物(20×)均购自美国ABI有限公司。Trizol购自美国Invirtrogen 公司,高速冷冻离心机采用美国Beckman Coulter公司Allegra 64R,普通PCR仪为美国BIO-RAD公司S1000 Thermal Cycler,实时荧光定量PCR仪为美国BIO-RAD公司CFX96。
三、试验方法
(一)标本采集
依WHO要求,采集精液前禁欲3~7d,排小便,洗净双手,用手淫法收集全部精液于干燥消毒的精液采集器内,置37℃多维混匀恒温箱,观察精液液化时间,待充分液化后行精液常规检查,3 000×g,离心15min,取精浆即时测定精浆miR-34b,或置-80℃冰箱保存待用,用以批量测定miR-34b。
(二)精液分析
依照WHO《人类精液检查与处理实验室手册》(第5版)要求进行精液分析[4],液化时间通过肉眼观察和显微镜进行识别判读,待精液液化后借用北京伟力计算机辅助精子分析系统,在带有加热37℃载物台的显微镜下分析精子活力和精子浓度,精子存活率采用低渗膨胀实验(HOS)。精子形态采用Diff-Quick染色法。
(三)精液总RNA 的提取
1. 预处理:取200μL精浆加入2μL浓度为100μg/mL蛋白酶K于37℃水浴箱1h后,再加入140μL醋酸钠、60μLβ-巯基乙醇、50μL PBS和0.024 PVP充分混匀于室温下放置15min,然后4℃1 2000×g,离心10min,取上清液用于TRIzol 法提取RNA。
2. TRIzol法提取RNA:取200μL预处理的精浆加入1mL TRIzol中充分均匀,将匀浆液倒入1.5mL离心管中, 再依次加入氯仿、异丙醇及95%乙醇,获得总RNA。
3. 提取效率评估:用20μL DEPC 水溶解RNA 沉淀,取2μL总RNA加入 98μL DEPC 水稀释后用分光光度计测定A260 /A280,比值在1.8~2.0用于后续实验。
(四)逆转录和Q-PCR
按照TapMan miRNA逆转录试剂说明书将提取的RNA逆转录合成cDNA,按比例配制RT混合液,分别加入TaqManhsa-miR-34b引物(5×)或内参TaqMan U6 sn RNA引物(5×),使用RT-PCR仪进行逆转录。合成cDNA后,按照TaqManmiRNA qPCR试剂说明书进行实时荧光定量PCR检测,混合加入TaqMan Universal PCR混合试剂Ⅱ(不含UNG),分别加入Taq Manhsa-miR-34b引物(20×)或内参TaqManU6snRNA引物(20×)。以U6的量为内参照,计算miR-34b的相对表达量△Ct为2Ct(U6)-Ct(miR-34b)。
(五)精液中miR-34b稳定性检测
选取精液参数正常的男性精液8份,离心后留取精浆2000μL,分成2份,各1 000μL,检测在以下2种环境中的稳定性:(1)室温孵育,将精浆分别放置室温下0、2、4、8和24h后,各取出200μL检测精浆miR-34b的表达情况。(2)放置-80℃μ冰箱内,分别在1、3、7、15和30d 5个时间点各取出200μL,检测精浆miR-34b的表达情况。。
四、统计学处理
采用SPSS17.0软件进行数据分析。经正态性检验,精液质量参数和精浆miR-34b相对表达量符合正态分布,采用均数±标准差(±s)表示;两组间比较采用均数比较的 t 检验,多组间比较采用方差分析,用Pearson 进行miR-34b与精液其他参数的相关性分析,检验水准α=0.05。
结 果
一、精浆miR-34b稳定性检测
在室温分别放置0、2、4、8和24h以及在-80℃冰箱内放置1、3、7、15和30d后精浆miR-34b相对表达量均无统计学意义(P>0.05),结果见表1。
二、男性不育症组及正常对照组精液常规主要参数和精浆miR-34b表达的比较
男性不育症组miR-34b表达量明显下调,两组比较精子浓度、前向运动精子百分率、精子存活率、正常精子形态百分率以及miR-34b表达均有非常显著性差异(P <0.01),见表2。
表 1 不同条件下精浆miR-34b相对表达量比较(n=8)

表 1 不同条件下精浆miR-34b相对表达量比较(n=8)
室温放置(h) -80℃冰箱内放置(d)时间点 0 2 4 8 24 1 3 7 15 30 miR-34b(×10-2) 9.43±5.57 9.84±4.79 9.14±5.62 10.06±3.81 9.64±5.02 8.68±4.62 9.09±4.05 8.23±3.36 9.81±5.13 9.14±4.71 F 013 0.35 P 0.97 0.84
表2 男性不育症组及正常组精液常规主要参数和精浆miR-34b表达的比较()

表2 男性不育症组及正常组精液常规主要参数和精浆miR-34b表达的比较()
分组 n 精子浓度 精子存活率 前向运动精子 正常精子形态 miR-34b含量(×106/mL) (%) (%) (%) (×10-2)正常组 20 107.40±48.68 69.50±5.92 43.50±5.91 8.01±1.45 9.19±3.11男性不育症组 80 71.76±54.21 43.40±17.96 20.11±13.25 3.53±1.51 4.83±2.24 t 2.68 10.85 11.77 11.99 5.89 P <0.01 <0.01 <0.01 <0.01 <0.01
三、ROC曲线
绘制ROC曲线评估精浆miR-34b对男性不育症的诊断价值,其曲线下面积为0.85(0.79~0.95,95%),当选择最佳诊断截断值4.66×10-2时,其敏感度为95.00%,特异度为70.00%,见图1。
四、男性不育症组精液常规参数与精浆miR-34b的相关性分析
miR-34b与精子浓度、精子存活率、前向运动精子百分率呈非常显著正相关(P<0.05或P<0.01),与正常精子形态百分率无相关性,结果见表3。

表3 男性不育症组精液常规参数与精浆miR-34b的相关性分析
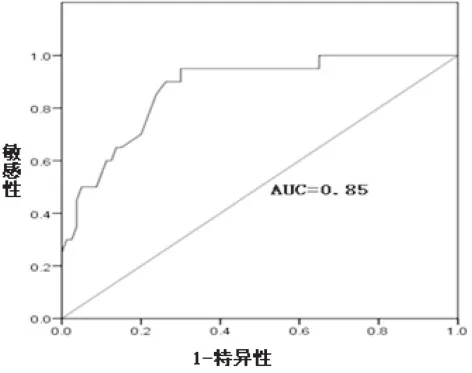
图1 miR-34b诊断男性不育症的ROC曲线
讨 论
在我国,15%生育年龄的夫妇不能生育,其中20%完全是男性的原因, 30%与夫妇双方有关,即大约50%的不育因素涉及到男性[5]。由于其致病因素复杂,往往仅表现为精子常规质量异常甚至正常,临床诊治手段还很有限,评估男性生殖能力主要应用精液常规质量分析,但精液质量常规参数受睾丸内部及外部多种因素的影响,反映的仅是表象数据,因此无任何一项常规质量参数可作为不育症的决定性诊断,寻找不育症的生物学标志一直以来都是一个重要的研究方向,由于体液的易于获得,人们更倾向于在体液中寻找生物学标志。miRNA作为新的切入点是近年来各学科关注的焦点, miRNA是一种非编码的、大小为22nt左右的单链小分子RNA,由于可游离于体液中,被认为是一种潜在的很有前途的具有组织特异性的无创生物标记物[6]。已有相当多的研究报道了在产前[7]以及各种肿瘤[8-10]、心血管病[11]等多种疾病的诊断和预后中利用血清、唾液、尿液、胸腹水等体液miRNA。同样,精浆游离miRNA 有望成为男性生殖疾病的非侵入性诊断标记分子和生殖遗传的表观遗传筛查的指标。
Weber等[12]通过比较12种体液的游离miRNA发现,精浆中游离miRNA种类数高居第二位。Huang等[13]发现精浆中游离RNA含量丰富,明显高于血浆和唾液。精浆是由前列腺、精囊、尿道球腺和旁腺等附属腺分泌的物质,成分复杂,内含丰富的蛋白质、多糖及降解酶,因此本研究通过先将精浆蛋白质、多糖进行去除预处理后再进行TRIzol法提取RNA,发现其提取效率明显高于直接TRIzol法,经紫外分光光度计测定A260/A280比值均在1.8~2.0之间,而直接TRIzol法仅在1.1左右。为验证其在体外不同条件下保存的稳定性,本研究通过建立的荧光定量PCR技术检测了精浆在室温和-80℃条件下放置不同时间后miR-34b的表达情况,结果发现各时间点比较,差异均无统计学意义(P<0.05),提示精浆中游离miRNA可能存在某种保护机制而不被机体内、外环境中RNase 降解,在室温和冰冻条件下均可稳定存在,Ikeda等[14]认为miRNA能够在体外稳定存在的原因之一可能是由于miRNA与蛋白共结合存在。
miR-34是一个保守的miRNA家族,在脊椎动物中,由3个同源miRNA分子组成miR-34a,miR-34b和miR-34c。成熟miR-34a序列位于其主基因原初转录本的外显子2内,而成熟miR-34b和miR-34c序列分别位于同一主基因原初转录本的内含子1 和外显子2 内[15,16]。目前对miR-34基因家族的研究发现,miR-34a在肿瘤方面具有独特作用,而miR-34c与雄性生殖关系密切,如miR-34c能通过Nanos2提高小鼠精原干细胞的分化[17];在分离粗线期的精母细胞和圆形精子细胞时期miR-34c呈高度表达状态[18];从出生到性成熟期在小鼠的睾丸组织中含量明显增高[1]。另外miR-34家族成员受p53 直接调控,同时其还能够通过对某些p53活性调节基因的调控,进而参与p53 通路的反馈调节[19-21],而p53在睾丸组织高度表达,并与精母细胞的分裂和生精细胞的凋亡关系密切,参与精子质量的控制[2],提示miR-34可能通过对p53的调节而影响精子的生成、发育。Bouhallier等[2]通过研究证实了miR-34c 可调节TGIF2 和NOTCH2 基因表达,进而改变TGFb和NOTCH通路,从而影响精子的发生和分化。miR-34b和miR-34c的初始转录本位于同一主基因内,而有关miR-34b与男性生殖系统的研究却鲜有报道。本研究结果表明,男性不育组精浆miR-34b表达量明显下调,与正常对照组相比有非常显著性差异(P<0.01), 通过相关性分析发现,男性不育患者精浆miR-34b表达量与精子密度、精子存活率、前向运动精子百分率均呈正相关(P<0.05或P<0.01)。提示miR-34b可通过某种途径影响精子质量,但miR-34b是否与p53、TGIF2 和NOTCH2等基因存在联系尚需进一步研究。通过绘制ROC曲线评估miR-34b对男性不育症的诊断价值,发现其曲线下面积为0.85(0.79~0.95,95%),当选择最佳诊断截断值4.66×10-2时,其敏感度为95.00%,特异度为70.00%,尽管目前的研究结果在实际的临床应用中价值有限,但可提示精浆游离miR-34b有望成为男性生殖能力评估的生物学分子,为进一步研究其在不同原因引起的男性不育症的诊断、疗效观察以及预后评估中提供实验基础。
miRNA作为一个关键因素可以决定生殖细胞的功能及命运,通过细胞间的信号转导既可以维持未分化生殖细胞的数量,又可以促进精子形成过程中的细胞分化[22]。本实验研究证实精浆miR-34b在常温及-80℃冰箱保存条件下能够稳定存在,并且精浆miR-34b差别表达于男性不育症患者与正常人,并与精子浓度、前向运动精子百分率和精子存活率在显著相关性,同时在诊断男性不育症方面亦显示出较好的临床诊断价值,为精浆miR-34b能够成为临床诊断指标提供了可能。但本研究仅进行了精浆miR-34b与男性不育的表达关系,关于其如何影响男性不育症的发生以及疾病发展过程中相关作用机制和网络还有待进一步研究。
参 考 论 文
1 Wang L, Xu C. Role of microRNAs in mammalian spermatogenesis and testicular germ cell tumors. Reproduction 2015; 149(3): R127-R137
2 Bouhallier F, Allioli N, Lavial F, et al. Role of miR-34c microRNA in the late steps of spermatogenesis. RNA 2010; 16(4): 720-731
3 Rokavec M, Li H, Jiang L, Hermeking H. The p53/miR-34 axis in development and disease. Mol Cell Biol 2014;6(3): 214-230
4 世界卫生组织编, 谷翊群, 陈振文, 等译. 世界卫生组织人类精液检查与处理实验室检验手册. 第5版. 北京: 人民卫生出版社, 2011: 10-98
5 Hu Z, Xia Y, Guo X, et al. A genome-wide association study in Chinese men identifi es three risk loci for nonobstructive azoospermia. Nat Genet 2011; 44(2): 183-186
6 Cortez MA, Bueso-Ramos C, Ferdin J, et al. MicroRNAs in body fi uids-the mix of hormones and biomarkers. Nat Rev Clin Oncol 2011; 8(8) 467-477
7 Tijsen AJ, Creemers EE, Moerland PD, et al. MiR423-5p as a circulating biomarker for heart failure. Circ Res 2010; 106(6): 1035-1039
8 Wittmann J, Jäck HM. Serum microRNAs as powerful cancer biomarkers. Biochimica Biophysica Acta 2010;1806(2): 200-207
9 Park NJ, Zhou H, Elashoff D, et al. Salivary microRNA: discovery, characterization, and clinical utility for oral cancer detection. Clin Cancer Res 2009; 15(17): 5473-5477
10 Hanke M, Hoefi g K, Merz H, et al. A robust methodology to study urine microRNA as tumor marker: microRNA-126 and microRNA-182 are related to urinary bladder cancer. Urol Oncol 2010; 28(6): 655-661
11 Gilad S, Meiri E, Yogev Y, et al. Serum microRNAs are promising novel biomarkers. PLoS ONE 2008; 3(9): e3148
12 Weber JA, Baxter DH, Zhang S, et a1. The microRNA spectrum in 12 body fluids. Clin Chem 2010; 56(11): 1733-1741
13 Huang S, Li H, Xiong C, et a1. Presence and characterization of cell-free seminal RNA in healthy individuals: Implications for non-invasive disease diagnosis and gene expression studies of the male reproductive system. Clin Chem 2009; 55(11): 1967-1976
14 Ikeda K, Satoh M, Pauley KM, et al. Detection of the Argonaute Protein Ago2 and microRNAs in the RNA Induced Silencing Complex(RISC) Using a Monoclonal Antibody. J Immunol Methods 2006; 317(1-2): 38-44
15 Tarasov V, Jung P, Verdoodt B, et al. Differential regulation of microRNAs by p53 revealed by massively parallel sequencing: miR-34a is a p53 target that induces apoptosis and G1-arrest. Cell Cycle 2007; 6(13): 1586-1593
16 He L, He X, Lim LP, et al. A microRNA component of the p53 tumour suppressor network. Nature 2007;447(7148): 1130-1134
17 Yu M, Mu H, Niu Z, et al. miR-34c enhances mouse spermatogonial stem cells differentiation by targeting Nanos2. J Cell Biochem 2014; 115(2): 232-24218 Yi R, Poy MN, Stoffel M, et al. A skin microRNA promotes differentiation by repressing 'stemness'. Nature 2008; 452(7184): 225-229
19 Tazawa H, Tsuchiya N, Izumiya M, et al. Tumorsuppressive miR-34a induces senescence-like growth arrest through modulation of the E2F pathway in col human on cancer cells. Proc Natl Acad Sci USA 2007;104 (39): 15472-15477
20 Corney DC, Flesken-Nikitin A, Godwin AK, et al. MicroRNA-34b and MicroRNA-34c are targets of p53 and cooperate in control of cell proliferation and adhesion-independent growth. Cancer Res 2007; 67(18): 8433-8438
21 Yamakuchi M, Ferlito M, Lowenstein CJ, et al. MiR-34a repression of SIRT1 regulates apoptosis. Proc Natl Acad Sci USA 2008; 105(36): 13421-13426
22 Ran M, Chen B, Yin J, et al. Advances in miRNA research related to testis development and spermatogenesis. Yi Chuan 2014; 36(7): 646-654
(2015-04-15收稿)
The expression of free miR-34b in seminal plasma of male infertility and its signifi cance*
Lou Jiangtao, Wei Renxiaong**, Yu Liangliang, Zhang Xiaoxia, Cui Yun
Laboratory of Andrology, Ningbo TCM hospital affi liated to Zhejiang Chinese medicine university, Ningbo 315012,China
Wei Renxiaong, E-mail: nbxiaowei @163.com
Objective To study the stability of seminal plasma free miR-34b under different conditions in vitro and explore the relationship between miR-34b and semen parameters of male infertility. Methods Eight semen samples with normal parameters were collected, and the stability of the miR-34b at room temperature and -800C was analyzed respectively by time-course. Total of 80 semen samples of male infertility and 20 semen samples of healthy male were collected in the study. The relative expression of seminal plasma free miR-34b was detected by real-time PCR. Routine semen parameter analysis was performed by computer-assisted sperm analysis system. Sperm survival rate and sperm morphology were assayed by hypo-osmotic swelling test and Diff-Quick staining respectively. Analysis differences of semen parameters and miR-34b expression was done between male infertility group and normal control group, and the diagnostic value of seminal plasma free miR-34b in diseases of male infertility was evaluated by ROC curve, the correlation betweenmiR-34b and semen parameters was analyzed by Pearson linear correlation. Results There was no obvious change in the relative expression of seminal plasma free miR-34b between room temperature and -800C (F=0.13, P=0.97; F=0.35, P=0.84). Compared with that of the normal group, seminal plasma miR-34b expression significantly decreased in male infertility group (t=3.77, P<0.01), In addition, there were signifi cant differences in sperm density, sperm living rate, progressive and sperm morphology between two groups (P< 0.01). ROC curve indicated that miR-34b can better distinguish male infertility from healthy controls, and the area under the curve were 0.85 (0.79-0.95,95%). Pearson correlation analysis showed that seminal plasma miR-34b expression was positively correlated to sperm density(r=0.28, P<0.05), sperm living rate (r =0.41,P<0.01), progressive (r =0.41, P<0.01), respectively. but no correlation to sperm morphology(r =0.15, P>0.05). Conclusion Seminal plasma miR-34b is stabilitly at room temperature and can be long-term preservated at low temperature, its' expression decreased in male infertility group, and positively correlated to sperm density, living rate, progressive, but no correlation to sperm morphology.
infertility, Male; MicroRNAs; ROC curve
10.3969/j.issn.1008-0848.2015.09.005
R 698.2
资助: 浙江省中医药基金项目(2014ZA100)
**通讯作者, E-mail: nbxiaowei @163.com

