大鼠骨髓间充质干细胞体外定向诱导分化成平滑肌细胞*
肖恒军转 黎陈 俊臧光辉杨 竣张 岩闫卫鑫高 新
1. 中山大学附属第三医院泌尿外科(广州 510630); 2. 云南省第一人民医院生殖遗传一科;
3. 华中科技大学同济医学院附属同济医院泌尿外科; 4. 中山大学附属第三医院不育与性医学科
·论 著·
大鼠骨髓间充质干细胞体外定向诱导分化成平滑肌细胞*
肖恒军1**△转 黎2,3△陈 俊4臧光辉3杨 竣3张 岩3闫卫鑫1高 新1
1. 中山大学附属第三医院泌尿外科(广州 510630); 2. 云南省第一人民医院生殖遗传一科;
3. 华中科技大学同济医学院附属同济医院泌尿外科; 4. 中山大学附属第三医院不育与性医学科
目的 分离培养大鼠骨髓间充质干细胞(BMSCs)并体外定向诱导分化成平滑肌细胞,为BMSCs移植治疗勃起功能障碍(ED)大鼠模型提供种子细胞。方法 分离培养大鼠BMSCs,取第3~4代细胞,流式细胞术检测BMSCs表面分子CD49d、CD73、CD90、CD105和CD106、造血干细胞表面分子CD34和CD45、血管内皮细胞特异性表面分子CD31表达情况,采用平滑肌细胞诱导培养基诱导分化,通过免疫荧光检测α-平滑肌肌动蛋白(α-SMA)和结蛋白(Desmin)进行鉴定细胞分化。结果 培养细胞阳性表达BMSCs表面分子CD49d、CD73、CD90、CD105和CD106,同时造血干细胞表面分子CD34和CD45及血管内皮细胞表面分子CD31阴性表达,且经过平滑肌细胞诱导培养基诱导分化后α-SMA和Desmin免疫荧光检测均阳性反应。结论 成功从大鼠骨髓中分离培养BMSCs,为BMSCs和基因修饰BMSCs移植治疗ED提供种子细胞。
间质干细胞; 勃起功能障碍; 大鼠
干细胞是一种具有多向分化潜能的细胞,随着细胞生物学和组织工程技术的发展,人们已利用干细胞移植技术治疗一些退行性疾病。老年性勃起功能障碍(erectile dysfunction, ED)发生的最直接原因为阴茎海绵体平滑肌变性纤维化而出现退行性变[1]。有实验研究表明干细胞移植可改善ED大鼠模型的阴茎勃起功能[2]。研究发现,将骨髓间充质干细胞(bone mesenchymal stem cells, BMSCs)注射于大鼠阴茎海绵体内可分化成阴茎海绵体平滑肌细胞和内皮细胞,且BMSCs具有取材容易、无免疫原性、易于外源基因的导入和稳定表达等特点,因此BMSCs可成为干细胞移植治疗ED的理想种子细胞[3,4]。本研究分离培养大鼠骨髓间充质干细胞(BMSCs)并体外定向诱导分化成平滑肌细胞,为BMSCs移植治疗勃起功能障碍(ED)大鼠模型提供种子细胞。
材料与方法
一、实验动物
12周龄SPF级雄性SD大鼠,由华中科技大学同济医学院实验动物中心提供。
二、主要试剂和仪器
DMEM低糖培养基和胎牛血清(FBS)(美国HyClone公司);红细胞裂解液、吲哚美辛、3-异丁基-1-甲基黄嘌呤(IBMX)、胰蛋白酶、胰岛素、地塞米松干粉、β-甘油磷酸钠、抗坏血酸、二甲基亚砜(DMSO)、青霉素和链霉素(美国Sigma公司);PBS(0.1mol/L,pH7.2);α-SMA和Desmin抗体(英国Abcam公司);BB型血小板源性生长因子(PDGF-BB)和转化生长因子β1(TGF-β1)(美国PeproTech公司); CD34-FITC(美国Santa Cruz公司);CD45-FITC(英国AbD Serotec公司);CD49d-FITC,CD31-PE、CD90-PE和CD106-PE(美国BD公司);CD73-FITC和CD105-FITC(北京博奥森科技公司);FITC标记山羊抗小鼠和Cy3标记山羊抗兔IgG二抗(美国R&D公司);4',6-二脒基-2-苯基吲哚(DAPI)(武汉博士德科技公司)。AirTech SW-CJ-1F洁净工作台(江苏苏净集团安泰公司);CO2培养箱(美国Thermo公司);微量加样器、高速离心机(德国Eppendorf公司);倒置生物显微镜BDS200(重庆奥特公司);奥林巴斯IX71荧光倒置显微镜(日本Olympus公司)。
三、大鼠骨髓间充质干细胞的分离和培养
将12周龄SPF级雄性SD大鼠断颈处死,置于75%乙醇中浸泡20~30 min。无菌洁净工作台内切取双侧股骨和胫骨,灭菌PBS(含100 U/mL青霉素和链霉素)漂洗2~3遍,剔除骨上附着组织。PBS重复漂洗2遍后,眼科剪去除骨骺端,注射器抽吸5 mL PBS将骨髓冲出,并于200目不锈钢筛网过滤,加入2倍体积DMEM低糖培养基(含10% FBS)并混匀,170 ×g,离心10 min。弃上清,加入1~2 mL红细胞裂解液重悬,4℃静置1~2 min后加入10 mL PBS中和,170 ×g,离心10 min。弃上清,再加入10~15 mL PBS重悬,170 ×g,离心10 min。弃上清,将沉淀细胞重悬于10~15 mL培养基中,细胞计数后接种至2~3个25 cm2培养瓶内,并置于37℃、5% CO2培养箱中培养。2~3 d后,观察细胞生长情况并更换培养基,以后每3~4 d更换培养基一次,当细胞融合至80%~90%时按1:2~3传代培养。
四、大鼠骨髓间充质干细胞免疫表型鉴定
取第3~4代细胞,经0.25%胰蛋白酶消化,在细胞计数后每个流式细胞管内加入1.0×106/mL细胞,170 ×g,离心10 min,弃上清,各管中加入50 μL PBS重悬细胞,分别依次避光加入CD31、CD34、CD45、CD49d、CD73、CD90、CD105和CD106 流式抗体,混匀,室温避光孵育30 min后各管分别加入1 mL PBS,170 ×g,离心10 min漂洗2遍,弃上清,200~300 μL PBS悬浮细胞,流式细胞仪上机检测。
五、大鼠骨髓间充质干细胞诱导分化鉴定
取第3~4代细胞,0.25%胰蛋白酶消化细胞后制成细胞悬液,以每孔1.0×105个细胞接种至含盖玻片的6孔细胞培养板,并设置未诱导组和诱导分化组,每组设2复孔。在37℃、5% CO2条件下培养24 h,待细胞融合至40%~50%,诱导组培养基为平滑肌细胞诱导培养基。
平滑肌细胞诱导及分化鉴定:每孔加入1 mL平滑肌细胞诱导培养基(含低糖DMEM、10% FBS、5 ng/ mL TGF-β1和50 ng/mL PBGF-BB),每3~4 d更换培养基一次,诱导培养14 d后通过免疫荧光技术检测细胞内α-SMA和Desmin表达水平鉴定细胞分化情况。
六、统计分析
流式细胞术数据采用FlowJo 7.6.1软件分析,所得数据采用±s 表示并采用SPSS 13.0软件进行统计分析,P<0.05表示有统计学差异。
结 果
一、大鼠骨髓间充质干细胞的分离和培养
接种培养48 h后,倒置显微镜下观察可见小圆形、短梭形、多角形或扁平形细胞贴壁生长,偶可见长梭形细胞(见图1A)。培养7 d后,细胞大量增殖并融合,呈梭形、多角形或扁平形。细胞传代培养至第3~4代后,细胞形态呈梭形或纺锤形,细胞体积较大且核浆比例较小(见图1B,图1C)。
二、大鼠骨髓间充质干细胞免疫表型鉴定
流式细胞术结果显示,培养细胞阳性表达间充质干细胞表面分子CD49d、CD73、CD90、CD105和CD106,同时造血干细胞表面分子CD34和CD45以及血管内皮细胞表面分子CD31阴性表达(见图2)。结果初步表明,该研究所培养的细胞为间充质干细胞。

图1 大鼠骨髓间充质干细胞A: 原代培养48 h大鼠骨髓间充质干细胞; B: 第3代大鼠骨髓间间充质干细胞; C: 第4代大鼠骨髓间充质干细胞; (倒置显微镜,×200)
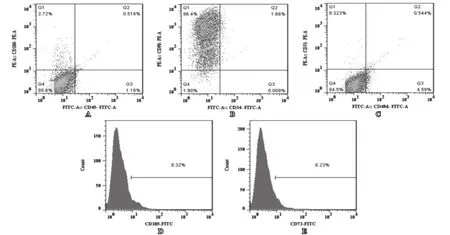
图2 大鼠骨髓间充质干细胞免疫表型鉴定(流式细胞术)A: CD106表达阳性(+)和CD45表达阴性(-); B: CD90表达阳性(+)和CD34表达阴性(-); C: CD49d表达阳性(+)和CD31表达阴性(-); D: CD105表达阳性(+); E: CD73表达阳性(+)
三、大鼠骨髓间充质干细胞体外诱导分化及鉴定
平滑肌细胞诱导分化:细胞诱导培养14d后,细胞形态出现类似于平滑肌细胞长梭形改变,免疫荧光检测胞浆内α-SMA和Desmin蛋白表达强阳性,而未诱导组几近阴性(见图3A和图3B)。
讨 论
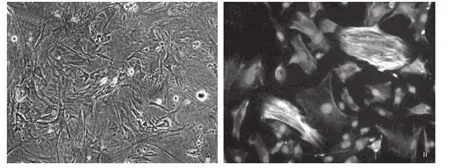
图3 大鼠骨髓间充质干细胞体外诱导分化鉴定A: 平滑肌细胞诱导分化14 d细胞形态; B: 平滑肌细胞诱导分化免疫荧光鉴定(绿色、红色和蓝色分别表示α-SMA、Desmin和DAPI); (倒置荧光显微镜,×200)
干细胞具有自我更新和分化为多种细胞类型的能力,其主要包括胚胎干细胞、间充质干细胞和肌源性干细胞等。间充质干细胞属于专能成体干细胞,正常处于休眠状态的成体干细胞可被疾病或外因诱导而具有不同的再生和更新能力。BMSCs是一种从骨髓中分离获得的具有多向分化潜能的间充质干细胞,其可分化为成骨细胞、软骨细胞、脂肪细胞、肌细胞及其他细胞,是基于成体干细胞治疗用于组织修复和重建的理想细胞[5,6]。Song等[3]将人类BMSCs(hBMSCs)移植至大鼠阴茎海绵体内,结果发现,hBMSCs具有分化为内皮细胞和平滑肌细胞的潜能。
Qiu等[7]在糖尿病性ED大鼠海绵体内注射BMSCs后发现,海绵体内内皮细胞和平滑肌细胞数量明显增多,神经元标志物神经源性一氧化氮合酶(nNOS)和阴茎神经神经丝表达增加,以及电刺激海绵体神经后的海绵体内压力升高。目前已有研究证实,将内皮源性一氧化氮合酶(eNOS)和血管内皮生长因子(VEGF)等目的基因高效导入BMSCs后,可更显著改善ED模型大鼠阴茎勃起功能,且BMSCs注射于阴茎海绵体内可分化成阴茎海绵体内皮细胞和平滑肌细胞[4,8],因此本系列研究选择BMSCs作为细胞载体。
BMSCs属间充质干细胞,其培养技术已成熟,由于BMSCs细胞表面缺乏特异性分子标记,因此BMSCs的鉴定仍存一定困难且较为复杂。目前BMSCs的鉴定尚采用国际细胞治疗协会间充质及组织干细胞委员会的通用鉴定标准[9,10]:(1)在标准培养条件下,须具备贴附塑料底物生长能力;(2)在体外诱导条件下,至少须具备成骨细胞、脂肪细胞或软骨细胞分化能力;(3)CD73、CD90和CD105三种细胞表面分子须阳性表达,而CD34、CD45、c-kit、CD14、CD11b、CD19、CD79α和HLA-DR等造血干细胞表面分子须表达阴性。该研究中,一方面选取间充质干细胞阳性表达细胞表面分子CD49d、CD73、CD90、CD105及CD106以及阴性表达细胞表面分子CD31、CD34和CD45作为BMSCs流式细胞术检测指标,结果显示,培养细胞表达间充质干细胞阳性表面分子CD49d、CD73、CD90、CD105和CD106,而缺少造血干细胞表面分子CD34、CD45以及内皮细胞表面分子CD31,证实培养细胞为间充质干细胞;另一方面,通过体外诱导分化实验和免疫荧光技术鉴定,结果表明BMSCs可定向诱导分化成平滑肌细胞。由此表明,本研究成功从大鼠骨髓中分离培养BMSCs,并可定向诱导分化成平滑肌细胞,这可为BMSCs和基因修饰BMSCs移植治疗ED提供理想的种子细胞。
1 Montorsi F, Briganti A, Salonia A, et al. The ageing male and erectile dysfunction. BJU Int 2003; 92(5): 516-520
2 Lin CS, Xin ZC, Wang Z, et al. Stem cell therapy for erectile dysfunction: a critical review. Stem Cells Dev 2012; 21(3): 343-351
3 Song YS, Lee HJ, Park IH, et al. Potential differentiation of human mesenchymal stem cell transplanted in rat corpus cavernosum toward endothelial or smooth muscle cells. Int J Impot Res 2007; 19(4): 378-385
4 Bivalacqua TJ, Deng W, Kendirci M, et al. Mesenchymal stem cells alone or ex vivo gene modifi ed with endothelialnitric oxide synthase reverse age-associated erectile dysfunction. Am J Physiol Heart Circ Physiol 2007;292(3): H1278-1290
5 Becker C, Jakse G. Stem cells for regeneration of urological structures. Eur Urol 2007; 51(5): 1217-1228
6 Kassem M. Mesenchymal stem cells: biological characteristics and potential clinical applications. Cloning Stem Cells 2004; 6(4): 369-374
7 Qiu X, Lin H, Wang Y, et al. Intracavernous transplantation of bone marrow-derived mesenchymal stem cells restores erectile function of streptozocin-induced diabetic rats. J Sex Med 2011; 8(2): 427-436
8 Gou X, He WY, Xiao MZ, et al. Transplantation of endothelial progenitor cells transfected with VEGF165 to restore erectile function in diabetic rats. Asian J Androl 2011; 13(2): 332-338
9 Dominici M, Le Blanc K, Mueller I, et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy 2006; 8(4): 315-317
10 Schäffi er A, Büchler C. Concise review: adipose tissuederived stromal cells--basic and clinical implications for novel cell-based therapies. Stem Cells 2007; 25(4): 818-827
(2015-05-21收稿)
Myogenic differentiation of rat bone mesenchymal stem cells in vitro*
Xiao Hengjun1**△, Zhuan Li2,3△, Chen Jun4, Zang Guanghui3, Yang Jun3, Zhang Yan3, Yan Weixin1, Gao Xin1
1. Department of Urology, the Third Affi liated Hospital of SUN Yat-sen University, Guangzhou 510630, China;
2. Center of Reproductive Medicine, the First People’s Hospital of Yunnan Province; 3. Department of Urology, Tongji Hospital, Huazhong University of Science and Technology; 4. Department of Infertility & Sexual Medicine, the Third Affi liated Hospital of SUN Yat-sen University
Xiao Hengjun, E-mail: hjxiao555@126.com
Objective To study myogenic differentiation of rat bone mesenchymal stem cells (BMSCs) in vitro for obtaining the available seed cells to treat erectile dysfunction (ED). Methods Rat BMSCs were isolated and cultured from the femur and tibia of Sprague Dawley (SD) rat. The expressions of CD49d, CD73, CD90, CD105, CD106 and CD31, CD34 and CD45 in the isolated BMSCs were analyzed by fi ow cytometry. The fourth passage of BMSCs were further induced and differentiated into myogenic cells by conditioned medium. Results Mesenchymal stem cell surface markers CD49d, CD73,CD90, CD105 and CD106, were detectable in the isolated cells but no detectable for the expression of CD31, CD34 and CD45. Myogenic differentiation cells were identifi ed by the expression of alpha-smooth muscle actin (α-SMA) and Desmin. Conclusion Rat BMSCs were successfully isolated and direct differetiated into myogenic cells in vitro. They could be used as autogenous BMSCs and gene modifi ed BMSCs for ED therapy.
mesenchymal stem cells; erectile dysfunction; tats
10.3969/j.issn.1008-0848.2015.09.001
R 698.1
资助: 国家自然科学基金项目(81050026, 81370702, 81460234);广东省科技计划项目(2011B060300003,2013B022000045); 广东省自然科学基金博士启动项目(07301205)
△共同第一作者
**通讯作者, E-mail: hjxiao555@126.com

