不同系统进化群鸡源大肠杆菌耐药性调查分析
刘焕奇,黄海涵,肖继友,胡学远,王龙光
(1. 青岛农业大学动物科技学院,山东青岛 266109;2. 山东省青岛第二中学,山东青岛 266032;3. 烟台市芝罘区动物卫生监督所,山东烟台 264000)
不同系统进化群鸡源大肠杆菌耐药性调查分析
刘焕奇1,黄海涵2,肖继友3,胡学远1,王龙光1
(1. 青岛农业大学动物科技学院,山东青岛266109;2. 山东省青岛第二中学,山东青岛266032;3. 烟台市芝罘区动物卫生监督所,山东烟台264000)
[目的]通过系统进化群和耐药性分析,了解鸡源大肠杆菌致病菌株的分布情况及耐药特征,为有效控制鸡大肠杆菌病提供依据。[方法]采用微量肉汤稀释法测定菌株耐药表型(MІC),采用PCR法检测耐药基因和系统进化群分群试验,采用SPSS17.0软件进行差异显著性分析。[结果]低致病群B1(38.1%)和非致病群A(34.0%)菌株分布相对较多,其次是高致病群D(21.2%)和B2(6.2%);分离菌株对氨苄西林(87.2%)、四环素(87.0%)、复方新诺明(87.0%)和磺胺异噁唑(80.0%)耐药严重,多重耐药率高达98.86%,但对多粘菌素E敏感;耐药基因sull(71.0%)、sul2(44.8%)、sul3(18.7%)、tetA(42.2%)、tetB(15.8%)、tetM(7.3%)均有检出,tetC、tetO、tetK、tetL、tetW均未检出,9.13%菌株同时携带3种sul基因,仅有一株菌同时携带3种tet基因。表型耐药菌株携带耐药基因的能力明显高于非耐药菌株(P<0.05)。高致病群B2、D群耐药程度较B1和A群严重,对氧氟沙星、庆大霉素、大观霉素、头孢噻呋、磺胺异噁唑、复方新诺明、奥格门丁等7种药物差异显著(P<0.05)。[结论]我国鸡源大肠杆菌高致病菌株检出率高,且耐药程度相对严重,在适宜条件下更易导致鸡群发病且难以控制。
鸡大肠杆菌;系统进化群;致病性;耐药性
禽致病性大肠杆菌(Escherichia .coli,E.coli)能引发禽大肠杆菌病,可引起胚胎死亡、脐炎、败血症、肉芽肿、卵黄性腹膜炎、全眼球炎、气囊病、禽蜂窝织炎、肿头综合症、腹膜炎、输卵管炎、滑膜炎等一系列病症,不仅给养禽业造成严重的经济损失,而且也与人类肠外致病性大肠杆菌密切相关。它是毒力基因和耐药基因的贮存宿主,可引发人类食源性疾病,且耐药性和致病性的结合可造成该类疾病更加难以预防与治疗。系统进化群分析是利用PCR技术对大肠杆菌分离菌株进行分群检测,主要依靠出现chuA、yjaA基因和TspE4.C2非编码区区分,可快速获得具有不同致病能力的菌株群,对研究其生态分布和遗传进化具有重要参考价值[1]。本研究采用PCR法对鸡源大肠杆菌进行系统进化群分析,了解不同系统进化群鸡源大肠杆菌致病菌株的分布情况,结合耐药性检测结果,分析致病菌群与低/非致病菌群之间的耐药差异,对临床合理用药和细菌性疾病的防治具有重要的实际意义。
1 材料
1.1实验菌株
438株鸡源大肠杆菌(从表观健康鸡泄殖腔拭子分离获得)以及O2标准菌株,均由中国动物卫生与流行病学中心动物产品安全监测室提供。大肠杆菌ATCC25922,购自中国兽医药品监察所。
1.2主要试剂和仪器
胰蛋白胨大豆肉汤、LB肉汤、Mueller-Hinton肉汤、琼脂粉,购自北京陆桥生物技术有限公司;GoTaqGreen Master Mix、DNA Marker DL2000和琼脂糖,购自TaKaRa公司;96孔药敏板、含氨苄西林/AM、奥格门丁/AC、头孢噻呋/CEF、庆大霉素/GM、大观霉素/SPT、四环素/TE、多西环素/DOX、氟苯尼考/FFC、磺胺异噁唑/SF、复方新诺明/SXT、氧氟沙星/OFL、恩诺沙星/ENR、多粘菌素E/CLE等13种药物,购自天津市金章科技发展有限公司;
电热恒温培养箱(上海爱朗SLІ-700型)、快速涡匀器(深圳天南海北SK-1)、PCR仪(BІORAD)、电泳仪(北京六一仪器厂)和Gel Doc XR凝胶成像分系统(BІO-RAD)。
2 方法
2.1系统进化群分群试验
chuA和yjaA基因以及DNA片段TspE4.C2等3对引物序列由上海生物工程有限公司合成,具体见表1。根据分群标准进行系统进化群分群[2]。

表1 chuA基因、yjaA基因和DNA片段 TspE4.C2的引物序列
PCR扩增体系25 μL,包括上下游引物各0.5 μL、模板2 μL。
PCR反应条件:94℃ 5 min,94℃ 45 s,60℃45 s,72℃ 50 s,共35个循环,72℃ 5 min。
2.2耐药表型检测
按CLSІ推荐的微量肉汤稀释法进行测定和判读,具体实验步骤根据药敏板说明书进行。
2.3耐药基因型检测
根据相关文献及GenBank中发表的基因序列,使用Primer5.0软件分别设计出磺胺和四环素类抗药基因共11对特异性引物,引物序列(表2)由上海生物工程有限公司合成。
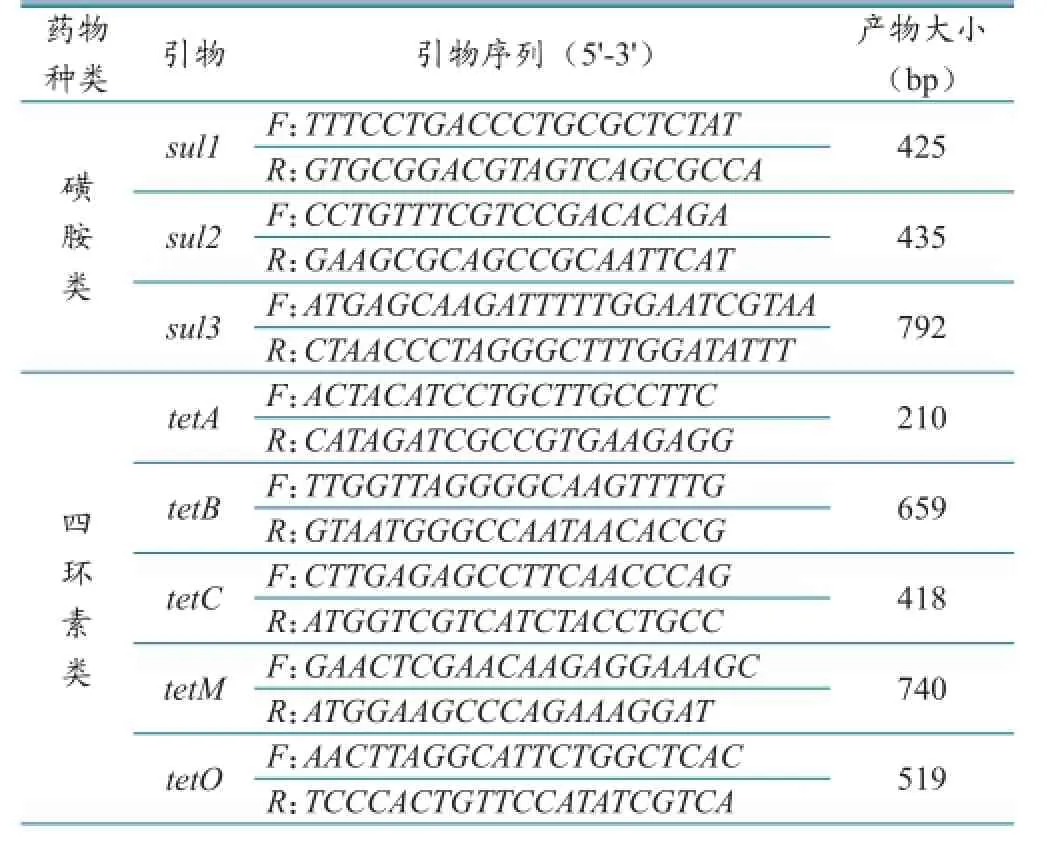
表2 磺胺和四环素类药物耐药基因引物序列
PCR扩增体系25μL,包括上下游引物各0.5μL、模板2μL。
PCR反应条件:sull、sul2、sul3,94℃5min,94℃45s,60℃45s,72℃50s,35个循环,72℃5min。tetA、tetB、tetC、tetM、tetO、tetL、tetK、tetW,94℃5min,94℃45s,60℃45s,72℃45s,30个循环,72℃5min。
2.4统计学分析
用SPSS17.0软件对两组样本率X2检验或两尾Fisher精确检验进行数据分析。当P<0.05时差异显著,具有统计学意义。
3 结果
3.1系统进化群分群结果
438株鸡源大肠杆菌中,B1群和A群菌相对较多,分别占38.1%(167/438)和34.0%(149/438),D群占21.2%(93/438),而B2群菌株最少为6.2%(27/438)。不同基因片段PCR产物的电泳结果见图1。
3.2耐药表型检测结果
438株鸡源大肠杆菌对13种药物的药敏试验结果见表3。耐药严重的是氨苄西林、四环素和磺胺类(耐药率≥80%),多粘菌素E最为敏感;多重耐药问题突出,433株为多重耐药菌株,多重耐药率高达98.9%,耐7种药以上的菌株占77.2%。结果见表3。
3.3耐药基因检测结果
菌株PCR产物电泳结果显示sul2基因检出率最高,检出率为71.0%,其次是sull(44.8%)和sul3(18.7%)。同时携带3种磺胺类耐药基因的检出率为9.1%(40株);tetA检出率为42.2%,tetB为15.8%,tetM为7.3%,其中有1株菌同时携带3种tet基因,tetC、tetO、tetL、tetK、tetW未检出。耐药基因检出情况见表4;PCR产物电泳结果分别见图2和图3。
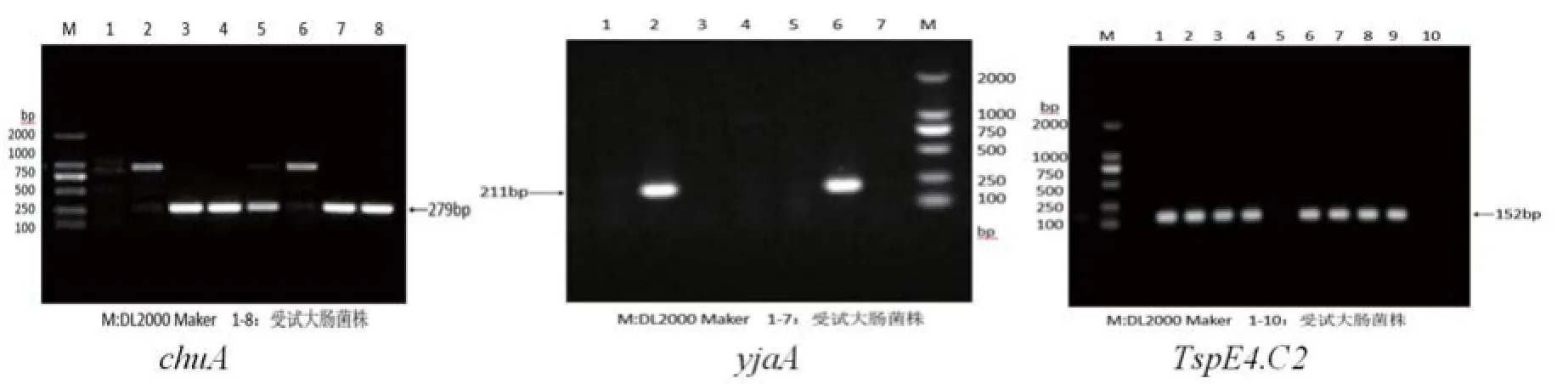
图1 不同基因片段PCR产物电泳图
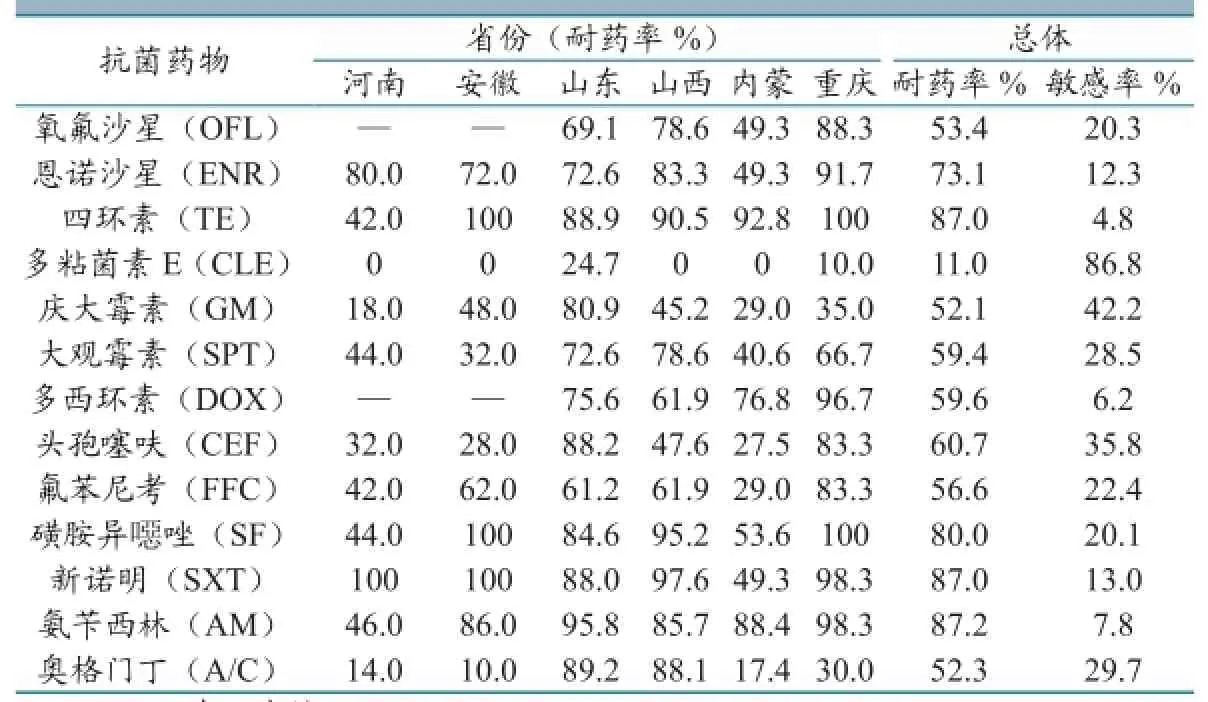
表3 438株鸡源大肠杆菌药敏试验结果
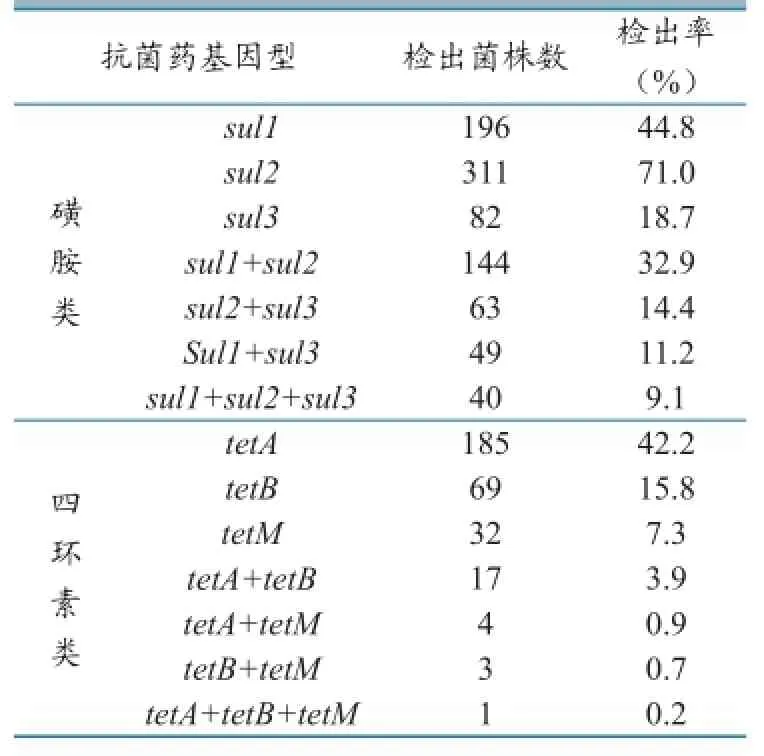
表4 鸡E.coli耐药基因检测情况

药物种类 引物 引物序列(5 ' -3 ') 产物大小(b p)四环素类t e t K F:T A T T T T G G C T T T G T A T T C T T T C A T 1 1 5 9 R:G C T A T A C C T G T T C C C T C T G A T A A t e t L F:A T A A A T T G T T T C G G G T C G G T A A T 1 0 7 7 R:A A C C A G C C A A C T A A T G A C A A T G A T t e t W F:G A G A G C C T G C T A T A T G C C A G C 1 6 8 R:G G G C G T A T C C A C A A T G T T A A C
3.4耐药表型与耐药基因型相关性分析
差异比较分析显示,表型耐药菌株携带耐药基因的能力显著高于非耐药菌株(p<0.05),说明耐药性与耐药基因携带有关,即耐药表型与基因型呈一定相关性。但耐药基因检出率低于其相应抗菌药耐药率,可能是含有其它耐药基因或耐药机制,见表5。

图2 sull,sul2 和sul3 PCR电泳产物结果
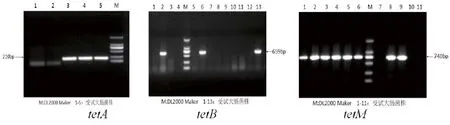
图3 tetA,tetB 和tetM PCR电泳产物结果
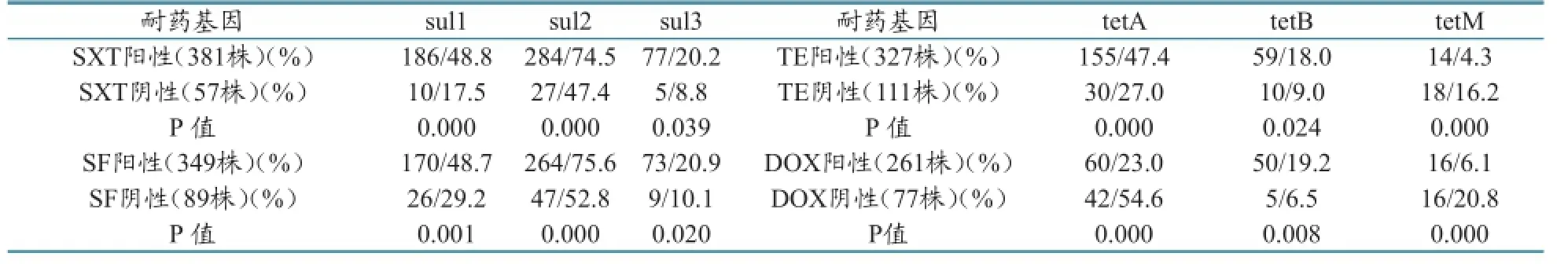
表5 耐药表型与耐药基因型相关性分析
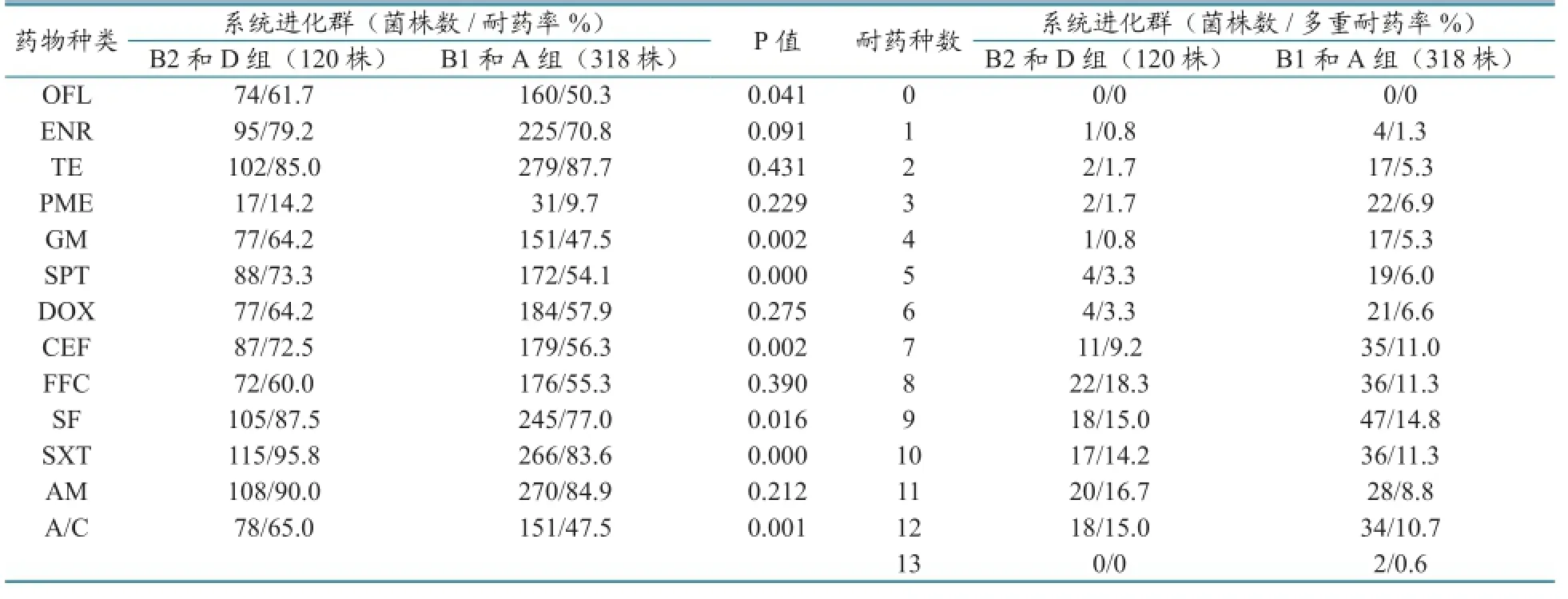
表6 不同系统进化群大肠杆菌菌株耐药情况比较
3.5 不同系统进化群大肠杆菌菌株耐药结果比较
高致病群B2和D群菌株的耐药程度相对严重,其中OFL、GM、SPT、EFT、SF、SXT、A/C等7种药物差异显著(P<0.05);多重耐药问题相对突出,高耐菌株比例高于B1和A群菌株,79.2%的菌株耐8~12种药物,具体见表6。
3.6不同系统进化群大肠杆菌菌株耐药基因比较
通过系统进化群与耐药基因型差异显著性分析,可见sull、sul2、tetA、tetB、tetM基因多见于高致病群B2和D群(P<0.05),但sul3在不同系统进化群中的分布无明显差(P=0.486)。说明部分耐药基因与大肠杆菌致病性存在一定相关性,见表7。
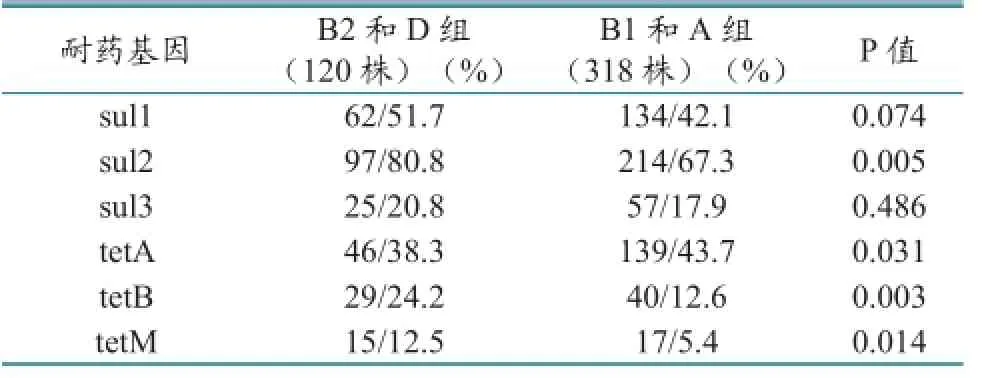
表7 耐药基因型与系统进化群相关性
4 讨论
大肠杆菌系统进化群可以分为4个群:A、B1、B2和D,依靠chuA、yjaA基因和TspE4.C2非编码区区分。A和B1群常存在于共生株,而B2和D群属于携带毒力相关基因的条件肠外病原体[1]。系统进化群的分布不仅是由动物种类,而且是由其健康状态和地理位置决定的。Pilar Corte’s等[3]研究发现系统进化群在猪和鸡分布显著不同,猪中A群菌株更加流行,而D群和禽源分离株相关。Tetsuo Asai等[4]研究发现不同病死动物大肠杆菌系统进化群分布不同,A(49.4%)和D(44.9%)主要分布于鸡源大肠杆菌,且B2群仅分离自患病鸡。Obeng AS等[5]研究了南澳大利亚251株禽大肠杆菌,结果发现32.3%~39.4%的分离株属于共生群(A和B1),11.2%~17.1%属于毒力群(B2和D),17株多重耐药菌株属于B2和D群。巴西和日本的研究也显示,B2群很少出现在健康牛、鸡和猪大肠杆菌中[6]。Rodriguez等[7]研究美国患病家禽大肠杆菌发现,A群(38%)和D群(28%)分布较多,B2群检出率为19%。本实验显示,共生群A和B1检出率与其他国家相似,但高致病群存在差异,D群菌株检出率比多数国家高出10%,并从健康鸡中分离到B2群菌株,其它国家未见报道。说明我国鸡大肠杆菌毒力较强,在适宜条件下更易导致家禽发病。
近年来禽源大肠杆菌的耐药谱不断扩大,耐药程度日趋严重,多重耐药问题突出。只帅等[8]对陕西省304份鸡大肠杆菌进行了耐药性分析,结果发现多数抗菌药的耐药率超过了50%。李昆明等[9]检测了河南17株禽大肠杆菌对24种抗菌药的耐药情况,对21种药物耐药率大于70%,其中10种药物的耐药率高达90%~100%。杨泽晓等[10]对四川87株大肠杆菌进行26种抗菌药的耐药性检测,受试菌株均有不同程度多重耐药,对青霄素G(100%)、强力霉素(89.66%)、复方阿莫西林(85.20%)、四环素(82.76%)、头孢氨苄(63.22%)、头孢噻吩(52.87%)和复方新诺明(51.72%)的耐药性较强。本实验显示,438株鸡源大肠杆菌耐药情况与以往报道相似,对氨苄西林(87.2%)、四环素(87.0%)、复方新诺明(87.0%)和磺胺异噁唑(80.0%)耐药严重,且耐药谱较广,77.2%菌株对7种以上药物耐药。
耐药表型与携带的耐药基因呈一定相关性,但不同的国家和地区sul和tetA优势基因并不一样,很多研究报道发现sul1是磺胺类药物分布最广的基因[11-12],而肠道杆菌所携带的四环素类抗药基因主要是tetA、tetB和tetC[13-14]。本实验也显示,分离菌株对磺胺类和四环素类药物耐药与其携带的sul1(71.00%)、sul2(44.75%)、sul3(18.72%)以及tetA(42.2%)、tetB(15.8%)、tetM(7.3%)有关。
已有报道系统进化群可能与耐药性的散播有关联[15]。本研究也发现,除了四环素外,B2和D群菌株对其余12种抗菌药的耐药率均高于B1和A群菌株,其中OFL、GM、SPT、EFT、SF、SXT、A/C等 7种药物差异显著(P<0.05);79.17%的B2和D群菌株耐8~12种药物,而B1和A群耐8~12种药物的菌株则有56.92%。说明高致病群B2和D群菌株的耐药程度相对严重,但与Johnson J.R.和Picard B等[9-10]报道临床B2大肠杆菌分离株的抗菌药耐药性低于非B2分离株的结果不一致。
[1] Clermont O,Bonacorsi S,Bingen E. Rapid and simple determination of the Escherichia coli phylogenetic group[J] .Appl Environ Microbiol,2000,66:4555-4558.
[2]苏志新. 鸡源禽致病性大肠杆菌分离鉴定及其毒力相关基因分布特征分析[D].江苏:南京农业大学,2011.
[3]Corte’s P,Blanc V,Mora A,et al. Іsolation and Characterization of Potentially Pathogenic Antimicrobial-Resistant Escherichia coli Strains from Chicken and Pig Farms in Spain[J]. Applied And Environmental Microbioloyg,2010,76(9):2799-2805.
[4]Asai T,Masani K,Sato C,et al. Phylogenetic groups and cephalosporin resistance genes of Escherichia coli from diseased food-producing animals in Japan[J]. Acta Veterinaria Scandinavica,2011,53:52.
[5] Obeng A S,Rickard H,Ndi O,et al. Antibiotic resistance phylogenetic grouping and virulence potential of Escherichia coli isolated from the faeces of intensively farmed and free range poultry[J].Vet Microbiol,2012,154(3-4):305-315.
[6] Carlos C,Pires M M,Stoppe N C,et al. Escherichia coli phylogenetic group determination and its application in the identification of the major animal source of fecal contamination[J].BMC Microbiol,2010,10:161.
[7]Rodriguez-Siek K E,Giddings C W,Doetkott C,et al. Comparison of Escherichia coli isolates implicated in human urinary tract infection and avian coli bacillosis[J]. Microbiology,2005, 151:2097-2110.
[8]只帅,席美丽,申进玲,等.食源性大肠杆菌耐药性检测[J].西北农业学报,2009,18(6):377-381.
[9]李昆明,姚惠霞,刘晓琳,等. 河南部分地区17株禽源大肠杆菌的耐药性分析[J].安徽农业科学,2010,38(31):17733-17735.
[10]杨泽晓,庞歌,王印,等.四川省部分地区大肠杆菌的耐药性监测[J].畜牧与兽医,2011,43(2):84-87.
[11]Kerm M B,Klemmensen T,Frimodt-Moller N,et al. Susceptibility of Danish Escherichia coli strains isolated from urinary tract infections and bacteraemia,and distribution of sul genes eonfering sulphonamide resistance[J]. Antimierob Chemother,2002,50:513-516.
[12]周万蓉,王红宁,张安云,等. 猪和野生动物源大肠杆菌及沙门菌中磺胺类药物耐药基因的检测[J]. 中国兽医科学,2007(4):287-290.
[13]Bryan A,Shapir N,Sadowsky M J. Frequency and distribution of tetracycline resistance genes in genetically diverse,nonselected,and nonclinical Escherichia coli strains isolated from diverse human and animal sources[J]. Applied and Environmental Microbiology,2004,70(4):2503-2507.
[14]张纯萍,宁宜宝,宋立. 健康鸡猪体内大肠杆菌对四环素的耐药性及耐药基因分布[J]. 中国农业科学,2010,12:2578-2583.
[15]Skurnik D,Menac’h A L,Zurakowski D,et al. Іntegron-Associated Antibiotic Resistance and Phylogenetic Grouping of Escherichia coli Іsolates from Healthy Subjects Free of Recent Antibiotic Exposure[J].Antimicrolial Agents And Chemotherapy,2005,49(7):3062-3065.
(责任编辑:朱迪国)
Antibiotical Resistance Investigation and Analysis of Chicken Originated E.coli Strains of Different Phylogenetic Groups
Liu Huanqi1,Huang Haihan2,Xiao jiyou3,Hu Xueyuan1,Wang Longguang1
(1. Department of Animal Science,Qingdao Agricultural University,Qingdao,Shandong 266109;2. Qingdao No.2 Middle School of Shandong Province,Qingdao,Shandong 266061;3. Zifu District Animal Health Supervision Іnstitute,Yantai,Shandong264000)
[Objective]The aim of the study is to know the distribution and drug-resistance of pathogenic poultry-originated E.coli strains through phylogenetic group and drug resistance analysis,and provide
for prevention and control of chicken colibacillosis.[Method]The antimicrobial susceptibility (MІC) was detected by mini broth dilution susceptibility test,the resistance gene and phylogenetic groups were detected by PCR and the significance of difference was analyzed by SPSS17.0 software. [Result]The low pathogenic group B1(38.13%) and the nonpathogenic group A(34.02%)were more distributed than the highly pathogenic group D (21.23%) and B2(6.16%). The resistance of 438 E.coli isolates to ampicillin (87.2%),tetracycline (87.0%),sulfamethoxazole/trimethoprim (87.0%) and sulfisoxazole(80.0%) was serious,multiple resistance rate was up to 98.86%,but the isolates were sensitive to colistin E. The resistance gene sull (71.0%),sul2 (44.8%),sul3 (18.7%),tetA (42.2%),tetB (15.8%) and tetM (7.3%) existed in E.coli isolates,but tetC,tetO,tetK,tetL and tetW were not found.9.13% isolates carried 3 sul genes,and only 1 isolate carried 3 tet genes. The ability of resistant isolates to carry resistance genes was significantly higher than the non-resistant ones(P<0.05). The resistance of the strains from highly pathogenic group B2and D was higher than the strains from group B1and A,and there was significant difference to the seven drugs such as ofloxacin,gentamicin,spectinomycin,ceftiofur,sulfisoxazole,sulfamethoxazole/trimethoprim,amoxicillin/clavulanic acid (P<0.05).[Conclusion]The ratio of highly pathogenic strains of chicken-originated E.coli in China was high,and the drug-resistance was relatively serious,likely result in poultry diseases under the suitable conditions and difficulty to control .
chicken originated E.coli;phylogenetic groups;pathogenicity;drug-resistance.
S852.61
B
1005-944X(2015)11-0016-06
“十二五”科技基础性工作专项(项目编号:2012FY111000)

