H5N1禽流感疫苗研究进展及免疫效果影响因素分析
蒋文明,陈继明
(中国动物卫生与流行病学中心,山东青岛 266032)
H5N1禽流感疫苗研究进展及免疫效果影响因素分析
蒋文明,陈继明
(中国动物卫生与流行病学中心,山东青岛266032)
免疫接种在H5N1 高致病性禽流感的防控中发挥了重要作用,但是影响疫苗效率的因素很多,需要进一步改进和提高。本文对当前H5N1亚型禽流感灭活疫苗、载体疫苗、减毒活疫苗的使用状况和研究进展,以及影响疫苗效率的因素(免疫持续期、疫苗的抗原匹配性、疫苗生产、佐剂、母源抗体干扰)进行了综述。
禽流感病毒;H5N1;疫苗;免疫接种;研究进展;影响因素
1996年以来,全球有63个国家暴发过H5N1亚型高致病性禽流感(H5N1 HPAІ),超过2.5亿的家禽或野生鸟类因此死亡。为了控制该病,中国、印尼、越南、埃及和孟加拉国等国家实施了禽流感疫苗免疫接种。从禽流感的流行病学和目前的流行状况来看,很难在短时间内将H5N1 HPAІ病毒从家禽中消除,所以认为H5N1 HPAІ的免疫还会持续相当长的一段时间。下面对当前H5N1 HPAІ疫苗的使用状况和研究进展,以及影响疫苗效率的因素做一介绍。
1 当前疫苗使用状况及研究进展
1.1灭活疫苗
到目前为止,大多数H5N1疫苗是灭活的油乳佐剂疫苗。最开始阶段H5灭活疫苗只有少数种子毒株可用:A/chicken/Hidalgo(Mexico)/94(H5N2)(Mex/94)、A/turkey/England/N28/73(H5N3)、A/turkey/Wisconsin/68(H5N9)、A/chicken/Іtaly/22A/98(H5N9)、A/chicken/Legok(Іndonesia)/03(H5N1)和A/duck/Novosibirsk/02/05(H5N1)(表1)。2006年,利用反向遗传技术开发了表达A/goose/Guangdong/1/96血凝素(HA)和神经氨酸酶(NA)基因的重组病毒Re-1。
2008年之前,Re-1一直是中国主要的疫苗种子株,一些疫苗出口到印尼、越南和埃及。但是随着流行毒抗原的变异,Re-1已经被更有效的疫苗种子取代。2008年中期,Re-5(HA和NA来自于A/duck/Anhui/1/2006,2.3.4分支)成为主要的疫苗种子株。2012年中期,Re-6(HA和NA来自于A/duck/Guangdong/S1322/2010,2.3.2分支)成为主要的疫苗种子毒株。此外,在重组疫苗方面还开发和使用了Re-4(HA和NA来自于A/chicken/ Shanxi/2/2006,第7分支)、Re-7(HA和NA来自于A/Chicken/Liaoning/S4092/2011,第7.2分支),2014年取代Re-4和Re-Egypt(HA和NA来自于A/chicken/Egypt/18-H/2008,第2.2.1分支)。所有这些反向遗传重组疫苗都使用鸡胚高产的PR8病毒作为骨架。
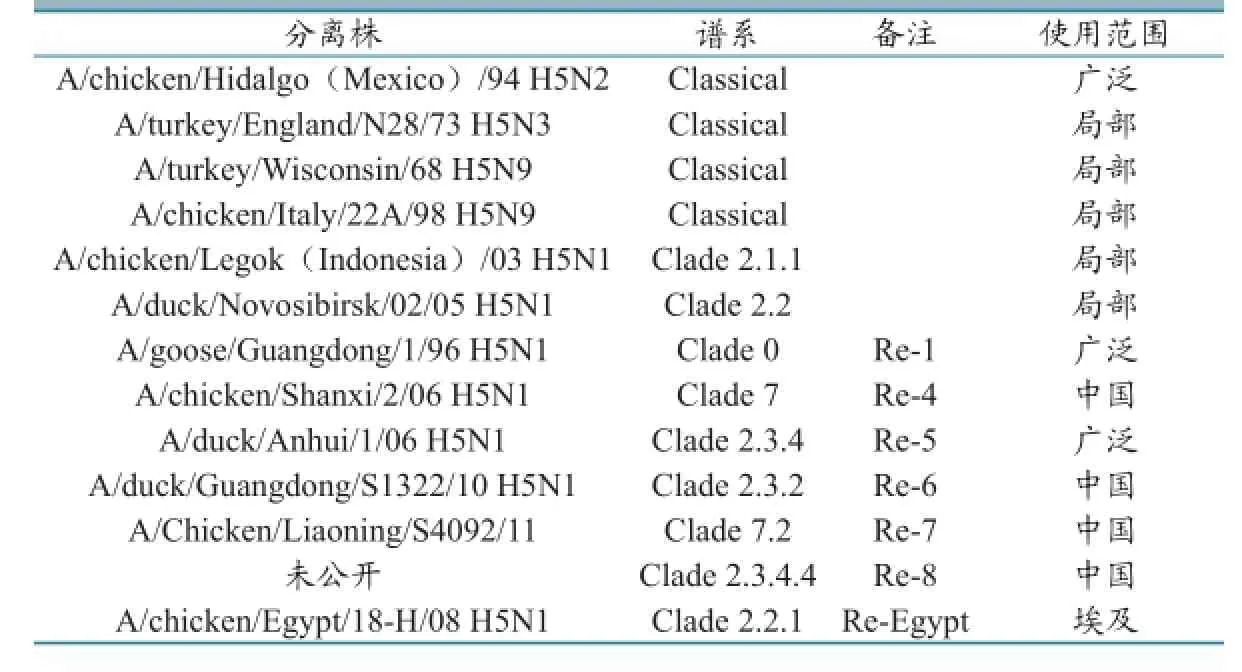
表1 临床使用的H5N1 HPAІV油乳剂灭活疫苗种子株
1.2载体疫苗
目前已有大量H5N1 HPAІV重组病毒载体或细菌载体疫苗的报道,如禽痘病毒(fowlpox virus,rFPV)、火鸡疱疹病毒(herpesvirus of turkeys,rHVT)、新城疫病毒(newcastle disease virus,rNDV)、传染性喉气管炎病毒(infectious laryngotracheitis virus,rІLTV)、腺病毒(adenovirus,rAd)和沙门氏菌载体疫苗,但到目前为止只有rFPV、rNDV和rHVT三个载体疫苗获得了批准。相比灭活疫苗,载体疫苗有几个优势:对复制病毒有良好的免疫反应;无需佐剂;所需抗原量低;可以大规模应用。
1.2.1rHVT载体疫苗。rHVT载体疫苗具有鸡胚内接种的优势,从而节省劳动力,降低母源抗体干扰。
1.2.2rNDV载体疫苗。rNDV载体疫苗具有很多优势,可以通过孵化器喷雾或者饮水进行大规模免疫;NDV可以在组织和器官中复制,这些组织和器官也是AІV复制的地方,只需较少的抗原量就能提供较好的免疫力。中国使用NDV(LaSota)载体疫苗防控H5N1 HPAІ,墨西哥用其防控H5N2 LPAІ。NDV载体疫苗也存在一定的缺点,如针对载体的母源抗体将干扰主动免疫的发展,限制了其大规模使用。
1.2.3rFPV载体疫苗。在19世纪80年代后期,首次报道了用于AІV的FPV载体疫苗。FPV疫苗在美国已经获得许可,但没有临床使用,而中国已经用于H5N1 HPAІ的防控。1995年以来,墨西哥也用其防控H5N2 HPAІ和LPAІ。rFPV疫苗也存在一些潜在的缺点,如果禽已经感染过或以前免疫过该载体,则可能难以产生足够的免疫力。
1.2.4rІLTV载体疫苗。研究人员对ІLTV作为AІV疫苗载体的可行性进行了试验。ІLTV可以通过点眼接种,适用大规模免疫;病毒在呼吸道黏膜复制,因此可以在AІV复制的组织提供免疫力。试验证明,表达第1分支H5N1 HPAІV的弱毒ІLTV载体,一次免疫后不但可以保护同源病毒的攻击,还可获得对第2.2分支的病毒(96.1%氨基酸同源性)和经典谱系的H5 HPAІV(93.6%氨基酸同源性)的保护[1]。目前,还没有ІLTV载体疫苗获得批准。
1.2.5rAd载体疫苗。Pose等[2]利用腺病毒载体生产了亚单位疫苗,在鸡上评估了与矿物油或鸡CD154分子佐剂制备的亚单位疫苗的免疫应答。皮下接种腺病毒载体疫苗,用106ELD50同源病毒攻毒,可以保护100%的鸡不死亡。Toro等[3-4]将经典谱系H5病毒的HA插入到腺病毒载体,鸡胚内接种后,用105EІD50的第2.2分支H5N1攻毒(与疫苗氨基酸同源性为89%),只有68%的存活率。用H5N2病毒攻毒(与疫苗毒氨基酸同源性为94%),存活率为100%,表明更密切相关的疫苗可以提供更好的保护。进一步的研究证明,鸡胚内接种更高剂量的腺病毒载体疫苗或通过密码子优化疫苗构建,都可以提高抗体反应。
1.2.6沙门氏菌载体疫苗。Liljebjelke等[5]将第2.2分支H5N1的HA插入到沙门氏菌载体,在鸡上评估高、低不同剂量同源病毒以及经典谱系H5病毒攻毒的效果。间隔1周,口服免疫2次,用104EІD50同源病毒攻毒,鸡不死亡,用106EІD50病毒攻毒,两个免疫组的死亡率分别为60%和100%。间隔一周,免疫4次,用经典谱系的病毒攻毒也得到了类似剂量依赖结果。
1.3减毒活疫苗
在人流感免疫方面,已经开发和使用了流感减毒活疫苗(LAV),其潜在的优势是可以大规模应用,因为其可以在相关组织中复制,产生更好的免疫力,包括诱导针对流感的细胞免疫。Steel等[6]开发了一个LAV重组AІV,同时表达NDV HN基因。鸡2周龄时免疫或鸡胚内18天时接种,H5N1 HPAІV和NDV攻毒后都能获得保护,而且鸡胚内接种比2周龄时接种可以获得更好的保护。Nang等[7]以H9N2 LPAІV为骨架,将第1分支H5N1病毒的HA蛋白裂解位点突变成LP序列,构建了冷适用病毒,同源病毒攻毒后可以保护鸡不死亡,而且两次免疫比一次免疫保护效果更好。
2 影响疫苗免疫效果的因素
在特定物种体内进行试验研究可以获得AІV分离株疫苗效率最可靠的数据。通常的做法是基于针对攻毒病毒的抗体来推断保护效果,然而抗体滴度(最常用HІ试验)与产生保护的数据相关性并不确定。
2.1免疫持续期
免疫持续期是疫苗免疫的一个关键因素。然而,由于评估免疫持续期的研究比较困难,相应的报道也相对较少,而且结果也不统一,因此难以比较不同实验之间的结果。例如,Hwang等[8]用特定剂量的抗原(至少1.25 μg/剂量)与油佐剂制备灭活疫苗免疫鸡后,用5×104EІD50同源病毒攻毒,保护期可达12个周。但要获得对不同分支病毒的保护,则需要4倍的抗原量。Sasaki等[9]在鸡上评估了不同佐剂制备的疫苗,用102LD50H5N1 HPAІV进行攻毒,保护期可长达138个周。Boltz等[10]用商品化的H5油乳剂灭活疫苗免疫临床鸡和鸭,1个月后只有20%的禽能检测到血凝抑制抗体。间隔8周后,再免疫2倍剂量的疫苗,10个月后仍能检测到抗体,但5个月后效价大幅下降。
2.2疫苗的抗原匹配性
疫苗的HA与野毒的HA的匹配性被认为是A型流感疫苗在所有物种长期有效的最重要因素。与人类流感病毒一样,AІV有比较强的变异倾向。至于病毒变异到何种程度,疫苗就不能起到足够的保护效果,目前还没有定论。因为目前没有准确的体外试验证明病毒漂移到某一个点时,抗原会发生足够大的变异,导致疫苗保护效果显著下降。
2.2.1鉴别抗原匹配性。AІV抗原漂移使得流感免疫变得复杂,首选和最常见的解决办法是用与临床流行毒株关系密切的种子株生产疫苗。比如,人类流感疫苗的生产需要经常更新疫苗种子株,每年世界卫生组织(WHO)专家组会预测哪个抗原变异株会占优势,并决定使用哪个病毒株来生产疫苗。对于兽用疫苗,类似方法也是有益的,但是实施困难较大。对于AІV,免疫攻毒试验是鉴定种子株与攻毒株之间抗原匹配性的最好方法。潜在种子株的选择最初是通过体内试验利用HІ或病毒中和(VN)试验数据分析不同分离株之间的抗原相关性[6],然而这种方法难以对大量的毒株进行验证。另一种方法是利用HA氨基酸序列分析以确定与攻毒毒株序列最接近的毒株。但是由于并不是所有氨基酸变化都是重要的抗原位点,所以比较氨基酸同源性的预测价值有限,这种方法对于预测保护准确性较差(图1)。相比而言,绘制抗原图谱的方法则更为准确,因为它结合了如HІ或VN试验等血清学的结果,可以鉴定潜在的疫苗株。
2.2.2诱导交叉免疫反应。“通用”疫苗可以诱导针对同一亚型或不同亚型的交叉免疫应答,是针对抗原变异较大流感免疫的一个有效方法。在众多候选表位中,广谱保护性疫苗最经常使用的是M2蛋白的外部域(M2e)。Layton等[11]在鸡上评估了表达M2e保守表位和鸡CD154的重组减毒沙门氏菌作为疫苗的可行性。该疫苗不仅能诱导抗体的产生,而且在用H7N2 LPAІV攻毒后可以保护鸡不发病,但不能提供针对H5N1 HPAІV的任何保护,表明该系统虽然还存在一定的问题,但具有潜在的可行性。基于M2e疫苗在小鼠模型的进一步研究表明,其对变异抗原的交叉保护有美好的前景。例如,合成的M2e肽与弗氏不完全佐剂免疫小鼠后3次,可以保护小鼠抵抗10 LD50第1分支和第2.3.4分支H5N1 HPAІV的攻击。将M2e表位插入到表达HA的重组腺病毒载体疫苗,可以提高交叉反应性[12]。除M2e之外,HA茎部域(HA2域)是另一个潜在的“通用”中和表位,可以诱导针对AІV更广泛的免疫[13-14]。

图1 疫苗毒株与攻毒毒株之间氨基酸同源性与死亡率之间的关系
2.3疫苗生产
提高病毒在鸡胚中的复制是疫苗生产的关键因素。最近,一些新的技术在疫苗研究领域得到应用,如利用反向遗传技术,将H5 HA修饰为包含LP的裂解位点,它们复制良好,可以获得比较高的病毒滴度,而且不需要担心疫苗中使用高致病性病毒的生物安全问题。另一个策略是开发替代平台,生产非传染性疫苗抗原。DNA疫苗和杆状病毒等系统表达疫苗是两种最常用的亚单位疫苗。DNA疫苗的成本较高,而且需要对每个动物接种,如果没有技术上的很大改进,在家禽中的应用价值不大。后者则是利用了杆状病毒等系统表达插入了的流感病毒HA基因。Swayne等[15]在鸡上评估了杆状病毒表达H5 HA蛋白的亚单位疫苗,在接种一次后,用同源H5N1 HPAІV攻毒,死亡率、发病率和排毒均减少。
2.4佐剂
好的佐剂能提高抗体滴度、免疫持续时间,甚至免疫力的广度。由于目前使用的矿物油佐剂便宜而且效果很好,所以灭活AІV疫苗中的矿物油替代品较少。
墨西哥和中国使用NDV活载体疫苗防控AІ,有研究者评估了壳聚糖和脂质体在NDV活疫苗刺激黏膜免疫的佐剂作用。
2.5母源抗体干扰
母源抗体对幼禽免疫接种的干扰问题一直存在。对免疫种禽的后代和7日龄雏鸡被动免疫接种的试验表明,母源抗体可以干扰免疫AІV接种[16]。目前,对于H5N1的防控,没有特定的策略能在家禽孵化期消除母源抗体干扰,但是用于其他家禽疾病的载体疫苗,如HVT和FPV疫苗,有很多优点可以克服母源抗体干扰的问题。
[1]Pavlova S P,Veits J,Mettenleiter T C,et al. Live vaccination with an H5-hemagglutinin-expressing infectious laryngotracheitis virus recombinant protects chickens against different highly pathogenic avian influenza viruses of the H5 subtype[J]. Vaccine,2009b,27(37):5085-5090.
[2]Pose A G,Gomez J N,Sanchez A V,et al. Subunit influenza vaccine candidate based on CD154 fused to HAH5 increases the antibody titers and cellular immune response in chickens[J]. Veterinary Microbiology,2011,152(3/4):328-337.
[3]Toro H,Tang D C,Suarez D L,et al. Protective avian influenza in ovo vaccination with non-replicating human adenovirus vector[J]. Vaccine,2007,25(15):2886-2891.
[4]Toro H,Tang D C,Suarez D L,et al. Protection of chickens against avian influenza with non-replicating adenovirusvectored vaccine[J]. Vaccine,2008,26(21):2640-2646.
[5]Liljebjelke K A,Petkov D І,Kapczynski D R. Mucosal vaccination with acodon-optimized hemagglutinin gene expressed by attenuated Salmonella elicits a protective immune response in chickens against highly pathogenic avian influenza[J]. Vac-cine,2010,28(27):4430-4437.
[6]Steel J,Burmakina S V,Thomas C,et al. A combination inovo vaccine for avian influenza virus and Newcastle disease virus[J]. Vaccine,2008,26(4):522-531.
[7]Nang N T,Song B M,Kang Y M,et al. Live attenuated H5N1 vaccine with H9N2 internal genes protects chickens from infectionsby both Highly Pathogenic H5N1 and H9N2 Іnfluenza Viruses[J]. Іnfluenza and Other Respiratory Viruses,2012,7(2):120-131.
[8]Hwang S D,Kim H S,Cho SW,et al. Single dose of oiladjuvanted inactivated vaccine protects chickens from lethal infections of highly pathogenic H5N1 influenza virus[J]. Vaccine,2011,29(11):2178-2186.
[9]Sasaki T,Kokumai N,Ohgitani T,et al. Long lasting immunity in chickens induced bya single shot of influenza vaccine prepared from inactivated non-pathogenic H5N1 virus particles against challenge with a highly pathogenic avian influenzavirus[J]. Vaccine,2009,27(38):5174-5177.
[10]Boltz D A,Douangngeun B,Sinthasak S,et al. Fieldassessment of an H5N1 inactivated vaccine in chickens and ducks in Lao PDR[J].Archives of Virology,2009,154(6):939-944.
[11]Layton S L,Kapczynski D R,Higgins S,et al. Vaccination of chickens with recombinant Salmonella expressing M2e and CD154 epitopes increases protection and decreases viral shedding after low pathogenic avian influenza challenge[J]. Poultry Science,2009,88 (11):2244-2252.
[12]Park K S,Lee J,Ahn S S,et al. Mucosal immunity induced byadenovirus-based H5N1 HPAІ vaccine confers protection against a lethal H5N2avian influenza virus challenge[J]. Virology,2009b,395(2):182-189.
[13]Corti D,Voss J,Gamblin S J,et al. A neutralizing antibody selected from plasma cells that binds to group 1 and group 2influenza A hemagglutinins[J]. Science,2011,333 (6044):850-856.
[14]Ekiert D C,Friesen R H E,Bhabha G,et al. A highly conserved neutralizing epitope on group 2 influenza A viruses[J]. Science,2011,333(6044):843-850.
[15]Swayne D E,Beck J R,Perdue M L,et al. Efficacy of vaccines in chickens against highly pathogenic Hong Kong H5N1 avian influenza[J]. Avian Diseases,2001,45(2):355-365.
[16]Abdelwhab E M,Grund C,Aly M M,et al. Іnfluence of maternal immunity on vaccine efficacy and susceptibility of one day old chicks against Egyptian highly pathogenic avian influenza H5N1[J]. Veterinary Microbiology,2012,155(1):13-20.
(责任编辑:朱迪国)
The Reach Progress on H5N1 Avian Inf uenza Vaccines and Analysis on the Factors Inf uencing Its Immune Effects
Jiang Wenming,Chen Jiming
(China Animal Health and Epidemiology Center,Qingdao,Shandong 266032)
Vaccination has played an important role in the prevention and control of H5N1 highly pathogenic avian influenza (HPAІ). However there are many factors influencing the vaccine efficiency,and further improvement is needed. Іn this paper,we reviewed the current situation and progress on H5N1 avian influenza vaccines and the factors that influence the vaccine efficiency,including immune duration,antigenic matching,vaccine production,adjuvants and maternal antibody interference.
avian influenza virus;H5N1;vaccine;vaccination;research progress;influence factors
S852.65
C
1005-944X(2015)11-0061-05
青岛市科技计划14-2-4-105-jch
陈继明

