食源性单增李斯特氏菌Lm319的毒力基因在四种肉汤培养基中表达分析
亢春雨,于宏伟,郭润芳,贾英民,姚振宇
(1.河北农业大学食品科技学院河北保定071001;2.河北科技大学生物科学与工程学院河北石家庄050018)
食源性单增李斯特氏菌Lm319的毒力基因在四种肉汤培养基中表达分析
亢春雨1,于宏伟1,郭润芳1,贾英民2,*,姚振宇1
(1.河北农业大学食品科技学院河北保定071001;2.河北科技大学生物科学与工程学院河北石家庄050018)
为了探明食源性单增李斯特菌的毒力基因在四种不同天然肉汤中的表达情况,了解食源性单增李斯特菌在不同肉类食品中的毒力水平。对单增李斯特菌Lm319中27个毒力基因进行PCR检测,并对Lm319在猪、鸡、牛和羊四种肉汤培养条件下27个毒力基因的表达情况进行RT-PCR检测。结果显示:单增李斯特菌Lm319中含有23个毒力基因;猪肉汤培养基中能表达的毒力基因种类以及基因表达量都是最高的,其次是羊肉肉汤培养基和牛肉肉汤培养基,而鸡肉肉汤培养基中表达的基因最少;同时发现iap、fbp、hpt和bsh这4个毒力基因的表达与prfA基因存在相关性。本研究表明,单增李斯特菌在不同生长环境下其毒力基因表达存在较大差异。
食源性单核增生性李斯特氏菌,毒力基因,肉汤培养基,基因表达
单核细胞增生性李斯特氏菌(Listeria moncytogenes,Lm)是一种重要的食源性病原菌,主要会引起成人败血症和新生儿脑膜炎等疾病,死亡率可达20%~30%[1-2]。该菌分布范围极广,环境耐受性较强[3]。国外因食源性单增李斯特菌造成的疾病和死亡人数在食源性疾病中占有非常突出的地位[4-5]。
国内有关单增李斯特菌对食品污染调查的报道较多,彭俊(2014)发现昆明市西山区生肉中单增李斯特菌的检出率均为5.00%,居各类食品之首[6];刘翔[7]、乌日娜[8]、靳晓燕等[9]也有类似报道,表明生肉对单增李斯特菌是易感的优良宿主。而随着我国居民物资生活水平的提高,肉类食品占日常食品的比重日益加大,因此对人们身体健康的潜在危险性也越来越大。
Lm是典型的胞内寄生菌,其对寄主感染过程的每个阶段都需特定的毒力因子参与[10]。白帆通过对单增李斯特菌弱毒株和强毒株主要毒力因子的表达水平检测,发现弱毒株可能与LLO、PC-PLC等膜裂解因子的高表达从而导致毒力下降[11]。魏丽通过构建单增李斯特菌inlB基因缺失株,发现inlB基因的表达对单增李斯特菌的毒力具有一定的调控作用[12]。但是关于单增李斯特菌的毒力基因在不同宿主中的表达情况的研究尚不多见。
本研究以食源性单核增生李斯特氏菌野生菌株(Lm319)为材料。采用PCR方法对四大类27个毒力基因进行检测,采用RT-PCR方法对27个毒力基因在猪、鸡、牛、羊四种肉汤中的表达情况进行研究,旨在掌握该菌在不同肉汤培养基中的毒力基因表达情况,为该病原菌的食品安全监控提供理论支持。
1 材料与方法
1.1材料与仪器
单核细胞增生性李斯特氏菌标准菌株EGD和ScottA由美国康奈尔大学Martin教授惠赠;单核细胞增生性李斯特氏菌标准菌株10403s 由浙江大学方维焕教授惠赠;以上标准菌株用于实验菌株的鉴定以及毒力基因PCR检测引物的设计参考;食源性单核增生李斯特氏菌野生菌株(Lm319) 本实验室鉴定、保存;TSA-YE及TSB-YE培养基北京陆桥技术有限责任公司;溶菌酶(50000U/mg)和蛋白酶K(大于30U/mg,20mg/mL)德国Sigma公司;SYBR qPCR Mix日本TOYOBO公司;2×Es Taq Master Mix、Super RT cDNA Kit、Ultrapure RNA Kit和DNA Marker DL2000康为世纪有限公司;PCR引物由北京六合华大基因科技股份有限公司合成;生猪肉、生鸡肉、生牛肉、生羊肉购自保定市惠友超市。
T-Gradient Thermocycler 96型PCR仪德国Biometra公司;CFX96型荧光定量PCR仪美国BIORAD公司;BINTA 2020D型凝胶成像系统英国UVIT EC公司。
1.2实验方法
1.2.1单增李斯特菌的活化挑取单增李斯特菌菌株(Lm319)一环接种于TSB-YE液体培养基,200r/min,37℃培养12h。
1.2.2四种肉汤培养基制作分别取四种生鲜肉,尽量剔除其中的脂肪和结缔组织,按固液比4∶10的比例与蒸馏水混合,经高速组织捣碎机(4000r/min,5min)匀浆处理,用纱布过滤,滤液100mL装入三角瓶,121℃15min灭菌。
1.2.3四种肉汤培养基中单增李斯特菌的培养无菌操作下取活化的单增李斯特菌(Lm319)接种于各肉汤培养基中,接种量为0.2%,200r/min,37℃培养12h。以备DNA、RAN提取操作。
1.2.4单增李斯特菌基因组DNA的提取取1mL菌悬液于1.5mL离心管中,10000r/min离心2min;收集菌体沉淀用1000μL水洗两次,吹打混匀,8000r/min离心5min;再加入250μL溶菌酶(20mg/mL),37℃水浴2h,然后加入2μL蛋白酶K,50℃水浴1h;加入200μL Tris-EDTA和20μL 10%的SDS,37℃放置10min,再加入66μL 5mol/L的NaCl溶液,12000r/min离心10min,取上清加入等体积V(酚)∶V(氯仿)∶V(异戊醇)=25∶24∶1的混合液抽提,12000r/min离心10min;重复苯酚/氯仿/异戊醇抽提1次;取上清,加入1∶10体积NaAc和2倍体积冰无水乙醇,12000r/min离心5min,风干,适量TE溶解备用。
1.2.5单增李斯特菌基因组RNA的提取参照RNA提取试剂盒(康为世纪有限公司)说明书进行。
1.2.6毒力基因的引物设计与合成根据GenBank上已公布的27个毒力基因序列,利用DNAMAN和Primer Premier 5.0软件,设计出各自的引物序列,由北京六合华大基因科技股份有限公司合成。所有引物都在标准菌株中进行PCR验证,具体引物见表1。
1.2.7cDNA第一条链合成反应体系(总体积20μL):dNTP Mix 4μL,Primer Mix 2μL,RNA Template 3μL;5×RT Buffer 4μL,Super RT 1μL,Rnase free water 6μL;振荡混匀,42℃孵育40min,85℃孵育5min,反应结束,短暂离心,置于-20℃冰箱备用。
1.2.8PCR反应条件PCR反应体系(总体积20μL):灭菌水7μL,2×Es Taq Master Mix 10μL,上游引物(10μmol/L)1μL,下游引物(10μmol/L)1μL,模板DNA 1μL。
扩增各基因片段的PCR反应程序分别为:预变性94℃5min;94℃30s,53℃30s,72℃30s(30个循环);72℃5min。每组实验设3个重复。
1.2.9RT-qPCR反应反应体系(总体积20μL):SYBR qPCR Mix(2×)10μL,正、反向引物(10μmol·L-1)各1μL,cDNA模板2μL,RNase free water 6μL。
反应程序:95℃,3min;95℃,15s;50℃,20s;72℃,30s;共40个循环;72℃实时检测荧光信号;55~95℃每隔0.05s升温0.5℃并实时检测融解曲线,50℃,20s;72℃,30s;50℃,30s反应结束。每组实验内参基因和目的基因均设3个重复。
1.2.10数据处理对单增李斯特菌Lm319在TSBYE培养基中培养12h后取菌液提取总RNA并反转录合成cDNA,并对主要毒力基因进行RT-qPCR检测。数据采用2-△△Ct法进行相对定量分析,以羊肉汤培养基处理样品为对照,以gyrB基因为内参基因。计算公式如下:
△Ct(第1批处理样品)=目的基因Ct均值-内参基因Ct均值;
△△Ct=△Ct(第n批处理样品)-△Ct(羊肉汤培养基处理样品);
2-△△Ct代表第n批样品中毒力基因的对羊肉汤培养基处理样品相应毒力基因的表达量的倍数。
2 结果与分析
2.1单增李斯特菌Lm319毒力基因的PCR检测
提取单增李斯特菌Lm319的总基因组并采用特异引物对其27个毒力基因进行PCR检测,27个毒力基因的PCR产物电泳图见图1。
图1显示,单增李斯特菌Lm319中除了inlD、inlE、inlF和plcA这4个毒力基因没有显示出明显的目的条带外,其余的23个毒力基因都有明显的电泳条带,表明单增李斯特菌Lm319中明确含有iap、inlB、inlA、inlC、inlG、prfA、plcB、mpl、actA、ami、fbp、hpt、bsh、gadA、hfq、inlC2、virR、mprF、dltA、dltB、dltC、dltD和hlyA这23个毒力基因。
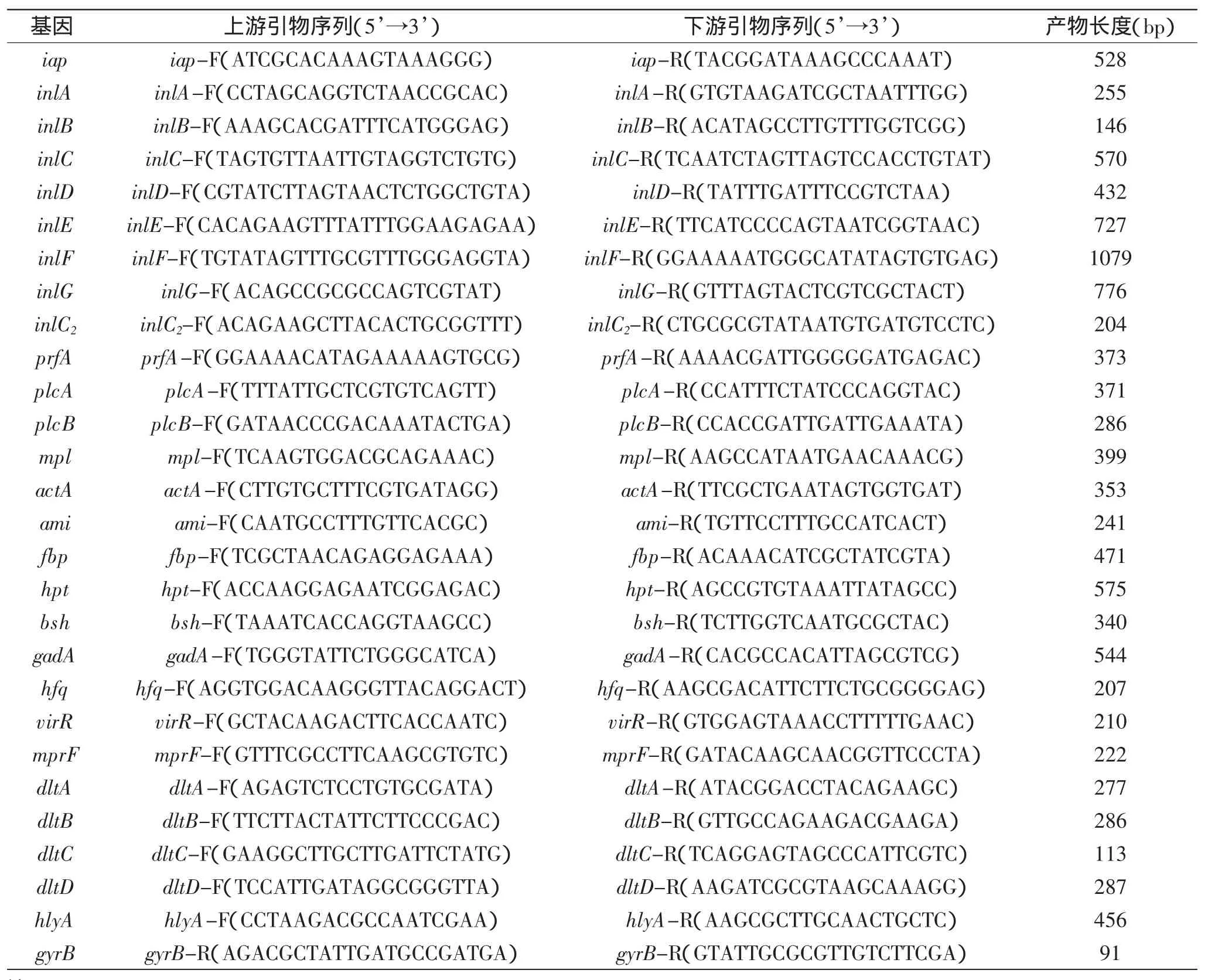
表1 毒力基因的引物序列与目的扩增产物大小Table 1 Oligonucleotide primer sequences for amplification of virulence-associated genes of L.monocytogenes isolates
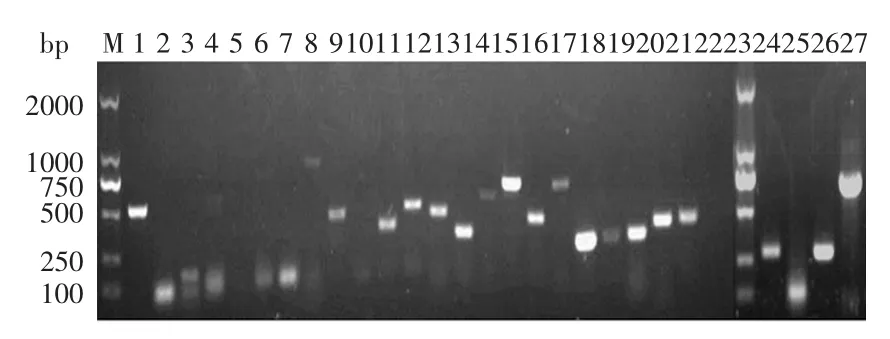
图1 菌株Lm319中27个毒力基因PCR检测电泳图Fig.1 Agarose(1.0%)gel electrophoresis of PCR products of twenty-seven virulence genes of Lm 319
Lm的致病性与其毒力基因密切相关,其感染过程包括内化、逃避液泡、吞噬、肌动纤维聚集和细胞传播等阶段,且每个阶段都需特定的毒力因子参与[10]。内化素基因(inl)为最早鉴定毒力基因,与单增李斯特菌对宿主细胞的侵袭力和致病性相关,为Lm穿越动物肠道上皮和胎盘屏障所必需[13]。fbp编码的纤连蛋白结合蛋白A(FbpA)以及actA编码的肌动蛋白聚集因子(ActA)也协同参与了细菌的侵袭[14-15];hlyA基因编码的溶血素(LLO)[16-17]以及plcA和plcB基因编码的磷脂酰肌醇特异性磷脂酶(PI-PLC)和卵磷脂酶(PC-PLC)具有细胞裂解作用,有助于Lm逃离吞噬小体[18-19];hpt编码的己糖磷酸盐转运蛋白(Hpt)有助于菌体利用细胞质中的营养成分进行增殖[20]。iap基因编码细胞壁水解酶(p60)是介导Lm侵袭入宿主细胞时,为该菌进行细胞分裂所必需,有助于Lm黏附于宿主细胞表面[21]。ami基因编码的酰胺酶(Ami)除裂解Lm细胞壁外,还可以通过其细胞壁锚定区使细菌黏附至靶细胞表面[22]。此外,prfA、virR、hfq这三个基因是Lm中重要的调控基因,参与体内毒力基因的表达和调控[23-26]。
通过对单增李斯特菌Lm319基因组中常见的27个毒力基因的PCR检测结果表明,该菌株中含有23个毒力基因,说明该菌株中毒力基因种类较丰富,是进行单增李斯特菌毒理机制研究较为理想的菌株。
2.2四种肉汤培养基中单增李斯特菌Lm319毒力基因RT-PCR检测
对接种单增李斯特菌Lm319的猪肉汤在200r/min,37℃下培养12h,提取李斯特菌总RNA,然后采用RTPCR方法对其中的27个毒力基因进行检测,结果见图2。
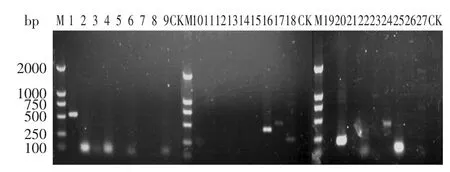
图2 猪肉汤培养基中Lm319中27个毒力基因的RT-PCR检测结果Fig.2 Agarose(1.0%)gel electrophoresis of RT-PCR products of twenty-seven virulence genes of Lm 319 from the pork broth
图2显示猪肉汤中检测到iap、inlB、prfA、fbp、hpt、bsh、hfq、mprF、dltB、dltC 10个毒力基因的电泳条带,表明这10个毒力基因在猪肉汤培养条件下得到了表达,而其余的13个基因从电泳图谱中未发现明显条带,表明未表达或表达的量极少,未检测到。其中iap、inlB、fbp、hfq和dltC这5个基因电泳条带清晰、明亮。
对鸡肉汤中Lm319的RT-PCR检测结果见图3。

图3 鸡肉汤培养基中Lm319中27个毒力基因的RT-PCR检测结果Fig.3 Agarose(1.0%)gel electrophoresis of RT-PCR products of twenty-seven virulence genes of Lm 319 from the chicken broth
图3显示在鸡肉汤中只获得了inlA、inlB和mpl共3个毒力基因的电泳条带,表明在鸡肉汤中这3个基因获得了明显的表达。
对牛肉汤中Lm319的RT-PCR检测结果见图4。
图4显示在牛肉汤中获得了mpl、hfq、mprF、dltB、 dltC和dltD共6个毒力基因的电泳条带,表明在牛肉汤中这6个基因获得了明显的表达。其中mpl基因条带清晰、亮度高,表明该基因在牛肉汤中获得了高表达。
对牛肉汤中Lm319的RT-PCR检测结果见图4。
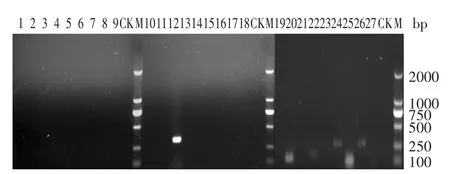
图4 牛肉汤培养基中Lm319中27个毒力基因的RT-PCR检测结果Fig.4 Agarose(1.0%)gel electrophoresis of RT-PCR products of twenty-seven virulence genes of Lm 319 from the beef broth
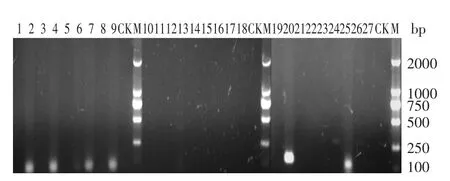
图5 羊肉汤培养基中Lm319中27个毒力基因的RT-PCR检测结果Fig.5 Agarose(1.0%)gel electrophoresis of RT-PCR products of twenty-seven virulence genes of Lm 319 from the mutton broth
图5显示在羊肉汤中获得了inlB、mpl、hfq、dltB、dltC和dltD共6个毒力基因的电泳条带,表明在羊肉汤中这6个基因获得了明显的表达。其中hfq基因条带较宽且非常明亮,甚至超过了DNA Marker条带的亮度和宽度,表明该基因在羊肉汤中表达的量很大。
为了直观的比较单增李斯特菌Lm319的27个毒力基因在四种肉汤中的表达情况,对其进行了列表统计,见表2。
表2显示,猪肉汤中毒力基因表达的数目最多,共有10个毒力基因有明显表达,并且发现电泳条带相对较明显,条带明亮,表明相应的毒力基因的表达量较多;鸡肉汤中表达的毒力基因数目最少,只检测到3个表达的毒力基因且条带不够清晰,表明相应的毒力基因表达量较少;牛肉汤和羊肉汤中表达的毒力基因情况最为接近,都检测到了6个毒力基因,并且表达的毒力基因种类基本相同。
比较发现hfq、dltB和dltC三个基因在猪肉汤、牛肉汤和羊肉汤种都表达了,但在鸡肉汤中没有检测到;而mpl基因在鸡肉汤、牛肉汤和羊肉汤中都有表达,但在猪肉汤中未检测到;对于内化素基因inlB在猪肉汤、鸡肉汤和羊肉汤中有较明显的条带;而dltB和dltC在猪肉汤、牛肉汤和羊肉汤中都有表达,但在鸡肉汤中没有发现dlt基因。本研究显示在猪肉汤中有prfA基因表达,也检测到iap、fbp、hpt和bsh四个基因的表达,而在其他三种肉汤中,没有检测到prfA基因表达,同样也没有检测到iap、fbp、hpt和bsh这四个基因的表达。表明iap、fbp、hpt和bsh这4个基因的表达与prfA基因存在相关性。已有研究表明prfA基因是重要的毒力调控因子,Lm中的大多数重要毒力基因都受其调控[23-24]。而本研究中iap、fbp、hpt和bsh 4个毒力基因是否受prfA基因调控,尚需进一步研究证实。
2.3四种肉汤培养基中单增李斯特菌Lm319毒力基因定量测定
为了更客观地反映单增李斯特菌在四种肉汤培养基中毒力基因的表达量的差别,对定性检测实验中在四种肉汤培养基中检出频率较高的inlB、hfq和 dltC 3个毒力基因采用实时荧光定量PCR检测。这4个毒力基因的表达情况见图6。

表2 毒力基因在四种肉汤中的表达情况比较Table 2 The comparison of virulence gene expression in four kinds of broth
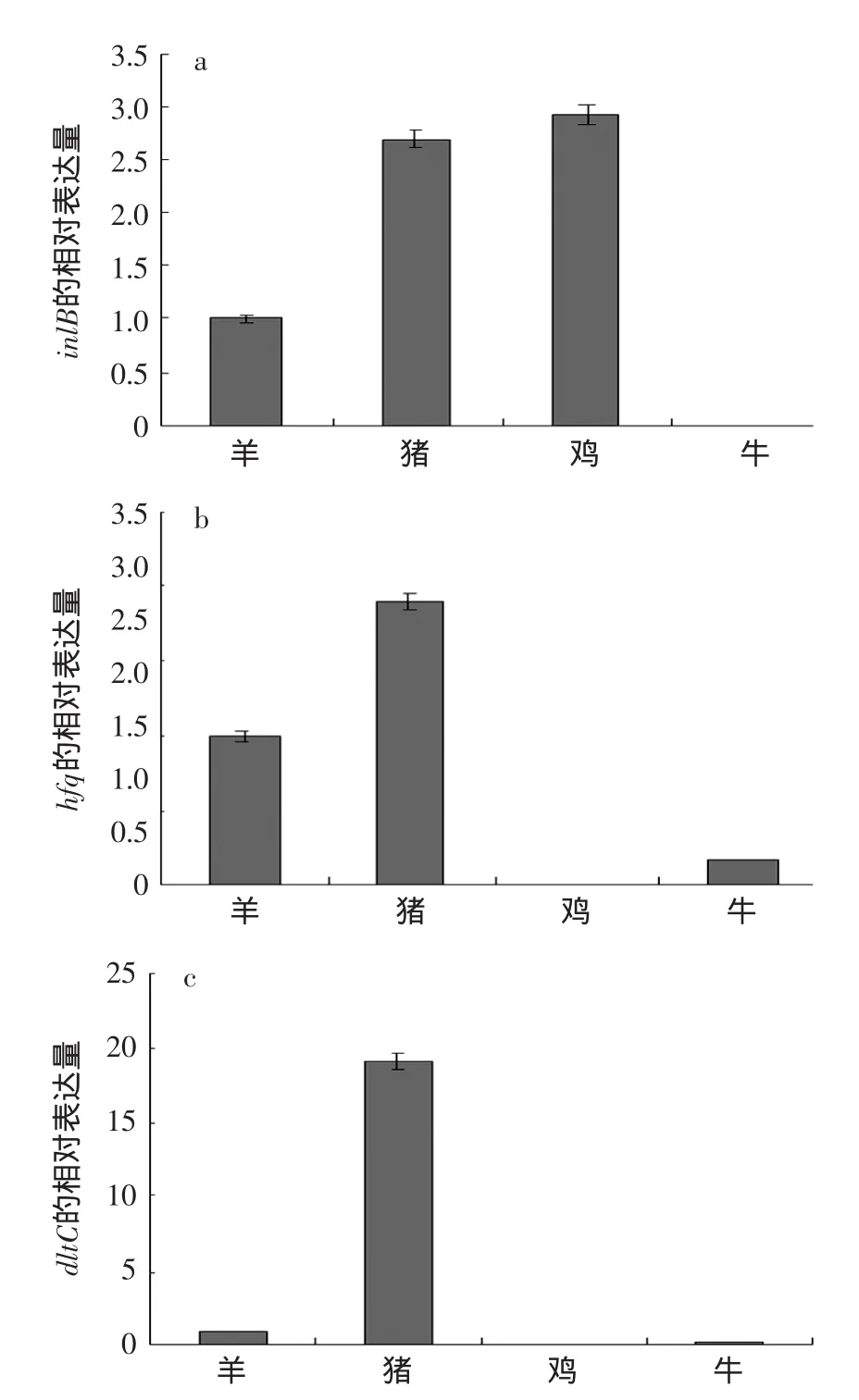
图6 Lm319中3个毒力基因在四种肉汤培养基中的定量表达Fig.6 The quantitative expression of three virulence genes in four kind of broth medium
图6显示,对于inlB基因,在鸡肉汤培养基中表达量最大,猪肉汤中次之,但两者相差不大,分别为羊肉汤中表达量的2.93倍和2.70倍,inlB基因在牛肉汤培养基中没有检测到明显的荧光信号;对于hfq和dltC基因,图6可明显看出猪肉汤中表达量最大,羊肉汤中表达量次之,在牛肉汤中表达量更小,而在鸡肉汤中未检测到。
通过对单增李斯特菌毒力基因在四种肉汤培养基中的表达情况的研究显示:无论是毒力基因的种类、数目,还是毒力基因的表达量都有明显差异,表明生长的环境条件对于单增李斯特菌毒力基因表达有较大影响。
以猪、鸡、牛和羊这四种日常生活中最常见的动物性材料制作的肉汤为培养基,其中没有加其他任何成分,目的就是模拟真实的肉制品中单增李斯特菌的污染情况,更能客观的反映肉类食品中单增李斯特菌污染所产生的致病效果,对于肉制品中单增李斯特菌的的安全监测具有实际指导意义。
3 结论
通过对单增李斯特菌Lm319中的27个毒力基因在猪、鸡、牛、羊四种肉汤培养基中表达情况研究发现:猪肉汤培养基中无论是毒力基因表达的种类还是基因表达量都是最高的,其次是羊肉汤中和牛肉汤中,而鸡肉汤中能表达的毒力基因最少,表明生长环境条件对单增李斯特菌毒力基因表达有较大影响;同时发现iap、fbp、hpt和bsh这4个毒力基因的表达水平与prfA基因存在相关性。
[1]冯延芳,冉陆,张立实.2000-2009年中国李斯特菌病文献报告病例分析[J].疾病监测,2011,26(8):654-659.
[2]Scallan E,Hoekstra R M,Angulo F J,et al.Foodborne illness acquired in the United States--major pathogens[J].Emerging Infectious Diseases,2011,17:7-15.
[3]Gandhi M,Michael L,Chikindas L.Listeria:a foodborne pathogen that knows how to survive[J].Int J Food Microbiol,2007,113:1-15.
[4]Mead P S,Dunne E F,Graves L,et al.Nationwide outbreak of listeriosis due to contaminated meat[J].Epidemiol Infect,2006,134:744-751.
[5]Schraff R L.Economic burden from health losses due to foodborne illness in the United States[J].J Food Prot,2012:75(1):123-131.
[6]彭俊,杨淞,王珏,等.昆明市西山区食品中单核细胞增生李斯特菌的污染状况调查[J].中国食品卫生杂志,2014,26(1):74-76.
[7]乌日娜,刘翔,郭邦成,等.银川市市售食品中单增李斯特菌污染状况分析研究[J].安徽农业科学,2014,42(18):5958-5961.
[8]靳晓燕,韩军,于宏伟,等.食品中单核增生性李斯特菌(Listeria monocytogenes)污染状况研究[J].中国食品学报,2009,9(1):226-231.
[9]刘翔,詹军,郭邦成,等.宁夏地区2006~2012年食品中单核细胞增生李斯特菌污染监测分析[J].现代医药卫生,2014,30(11):1642-1643.
[10]Freitag N E,Port G C,Miner M D.Listeria monocytogenes from saprophyte to intracellular pathogen[J].Nat Rev Microbiol,2009,7:623-628.
[11]白帆,陈健舜,程昌勇,等.单核细胞增生李斯特菌弱毒株主要毒力基因表达水平分析[J].动物医学展,2010,31:108-111.
[12]魏丽,邓兴梅,蒋建军,等.单增李斯特菌inlB基因缺失株的构建及其生物学特性[J].动物医学进展,2014,35(10):19-24.
[13]Gao X,Lorinczi M,Hill KS,et al.Met receptor tyrosine kinase degradation is altered in response to the leucine-rich repeat of the Listeria invasion protein internalin B[J].J Biol Chem,2009,284(2):774-783.
[14]Dramsi S,Bourdichon F,Cabanes D,et al.FbpA,a novel multifunctional Listeria monocytogenes virulence factor[J].Mol Microbiol,2004,53(2):639-649.
[15]Le Monnier A,Autret N,Join-Lambert O F,et al.ActA is required for crossing of the fetoplacental barrier by Listeria monocytogenes[J].Infect Immun,2007,75(2):950-957.
[16]Javier A,Carrero,Boris C,et al.Listeriolysin O from Listeria monocytogenes is a lymphocyte apoptogenic molecule[J].The Journal of immunology,2004,172:4866-4874.
[17]Glomski I J,Decatur A L,Portnoy D A.Listeria monocytogenes mutants that fail to compartmentalize listerolysin O activity are cytotoxic,avirulent,and unable to evade host extracellular defenses[J].Infect Immun,2003,71(12):6754-6765.
[18]Grundling A,Gonzalez M D,Higgins D E.Requirement of the Listeria monocytogenes broad-range phospholipase PC-PLC during infection of human epithelial cells[J].J Bacteriol,2003,185(21):6295-6307.
[19]Yeung P S,Zagorski N,Marquis H.The metalloprotease of Listeria monocytogenes controls cell wall translocation of the broad-range phospholipase C[J].J Bacteriol,2005,187(8):2601-2608.
[20]Chico-Calero I,Suarez M,Gonzalez-Zorn,et al.Hpt,a bacterial homolog of the microsomal glucose-6-phosphate translocase,mediates rapid intracellular proliferation in Listeria[J].Proc Natl Acad Sci USA,2002,99(1):431-436.
[21]Pilgrim S,Kolb-Maurer A,Gentschev I,et al.Deletion of the gene encoding p60 in Listeria monocytogenes leads to abnormal cell division and loss of actin-based motility[J].Infect Immun,2003,71(6):3473-3484.
[22]Milohanic E,Jonquieres R,Cossart P,et al.The autolysin Ami contributes to the adhesion of Listeria monocytogenes to eukaryotic cells via its cell wall anchor[J].Mol Microbiol,2001,39(5):1212-1224.
[23]De las Heras A,Cain R J,Bielecka M K,et al.Regulation of Listeria virulence:PrfA master and commander[J].Curr Opin Microbiol,2011,14(2):118-127.
[24]江玲丽,陈健舜,李爱云,等.单核细胞增多性李斯特菌弱毒株的生物学特性鉴定[J].畜牧兽医学报,2014,45(2):274-280.
[25]Hayashi-Nishino M,Fukushima A,Nishino K.Impact of hfq on the intrinsic drug resistance of salmonella enterica serovar typhimurium[J].Front Microbiol,2012(3):205.
[26]Mandin P,Fsihi H,Dussurget O,et al.VirR,a response regulator critical for Listeria monocytogenes virulence[J].Mol Microbiol,2005,57(5):1367-1380.
Study on the virulence gene expression of foodborne Listeria monocytogenes(Lm319)in four kinds of broth
KANG Chun-yu1,YU Hong-wei1,GUO Run-fang1,JIA Ying-min2,*,YAO Zhen-yu1
(1.College of Food Science and Technology,Agriculture University of Hebei,Baoding 071001,China;2.College of Bioscience and Bioengineering,Hebei University of Science and Technology,Shijiazhuang 050018,China)
In order to know the virulence gene expression of foodborne Listeria monocytogenes in four kinds of broth,to reveal the toxicity levels of Listeria monocytogenes in different kinds of meat products.The PCR was employed to investigate 27 virulence genes in the Listeria monocytogenes strain Lm319.The expression level of 27 virulence genes in four kinds of broth was carried out by using RT-PCR.The results showed that a total of 23 virulence genes were detected in Listeria monocytogenes strain Lm319.As for the expression of virulence gene,both the number of virulence gene and the magnitude of gene expression were the highest in pork broth,followed by mutton broth,then beef broth.The number of virulence genes which could express was the least in chicken broth.It also found that the expression level of iap,fbp,hpt and bsh related to prfA.This study indicated there was a big difference in the expression level of virulence gene when the Listeria monocytogenes grew in different environment.
Listeria monocytogenes;virulence genes;broth;gene expression
TS201.3
A
1002-0306(2015)14-0229-06
10.13386/j.issn1002-0306.2015.14.039
2014-11-18
亢春雨(1972-),男,博士研究生,讲师,研究方向:食品微生物与食品安全。
贾英民(1961-),男,博士,教授,研究方向:食品微生物。
河北省自然科学基金(C2006000514)。
——羊肉汤

