阳离子涡流在线固相萃取/液相色谱-串联质谱快速分析猪尿液中16种β受体激动剂残留
祝伟霞,杨冀州,郭慧领,张 莉,王彩娟,张 丽
(河南出入境检验检疫局,河南 郑州 450003)
β受体激动剂是天然儿茶酚胺类化学合成的衍生物,具有苯乙醇胺结构母核,因结构中含有碱性β-羟胺侧链,可与细胞膜的β-受体结合而得名,临床主要用于治疗哮喘、肺炎、休克等疾病[1]。在畜牧养殖生产中,β受体激动剂类药物常被非法添加到饲料中以提高动物生长率和瘦肉率[2],人类长期亚剂量食用β受体激动剂污染的食品易导致人体器官中毒[3]。农业部196号和235号公告均禁止β受体激动剂作为生长促进剂用于畜牧业,为了逃避政府部门监管,不法商家合成新的苯乙醇胺类替代物用于养殖过程,因此建立一种β受体激动剂多残留的分析方法对于兽药残留监管具有重要意义。
目前,β受体激动剂的多残留检测常采用酶联免疫法(ELISA)[4]、气相色谱-质谱联用法(GCMS)[5]、液相色谱 - 串联质谱法(LC - MS/MS)[6-8]和液相色谱 - 高分辨质谱法(LC -TOF)[9]等。LC -MS/MS 和 LC - TOF 技术是目前测定饲料[10]、尿液[11-12]、动物组织[13-14]和污水[15]等样品的主要分析方法,样品前处理采用传统的离线固相萃取(SPE)法,而离线SPE需要多步骤的溶剂转移和浓缩,实验操作繁琐。近年来研究者开始采用在线SPE技术净化样品中β受体激动剂类药物[16],但未见有关全自动在线固相萃取联用质谱技术分析尿液中16种β受体激动剂的报道。本方法采用在线阳离子涡流固相萃取柱净化,通过对净化、色谱分离和基质效应等条件的优化,建立了猪尿液中16种β受体激动剂的阳离子涡流在线固相萃取/液相色谱-串联质谱全自动分析的方法。
1 实验部分
1.1 仪器与试剂
TranscendTM在线净化液相色谱TSQ Ultra串联四极杆分析系统(美国Thermo Fisher公司);16种β受体激动剂标准品(纯度均≥95%,德国Dr.Ehrenstorfer公司);β葡萄糖苷酸酶/芳基硫酸酯酶(德国Merck公司);甲醇、乙腈、异丙醇、丙酮、甲酸(色谱纯,美国Fisher公司);甲酸铵(美国Sigma-Aldrich公司);其它试剂均为市售分析纯;实验用水为Millipore纯水系统制备的高纯水(≥18 MΩ·cm)。
1.2 标准溶液的配制
准确称取纯度折算为100%的β受体激动剂标准品各20.0 mg,以甲醇溶解并定容于100 mL容量瓶中,配成质量浓度为200 μg/mL的标准储备液,于-18℃下保存;分别吸取500 μL标准储备液,用甲醇稀释成质量浓度为1 μg/mL的混合标准工作溶液,于0~4℃下保存。取适量的标准混合液添加阴性猪尿液按本方法进行分析,制得基质标准工作溶液,现用现配。
1.3 TurboFlow在线净化与LC-MS/MS条件
TurboFlow净化色谱柱为MCXTM(50 mm×0.5 mm);进样量为100 μL;TurboFlow上样泵流动相:水(A1)、氨水甲醇(B1)、乙腈-异丙醇-丙酮(4∶4∶2,C1)。液相分离色谱柱为SHISEIDO CAPCELL MGⅡ(150 mm ×2.0 mm,3.0 μm);进样量为50 μL,流动相为0.1%甲酸甲醇(A2)、0.1%甲酸溶液中含5 mmol/L甲酸铵(B2),在线净化和液相梯度洗脱程序见表1。
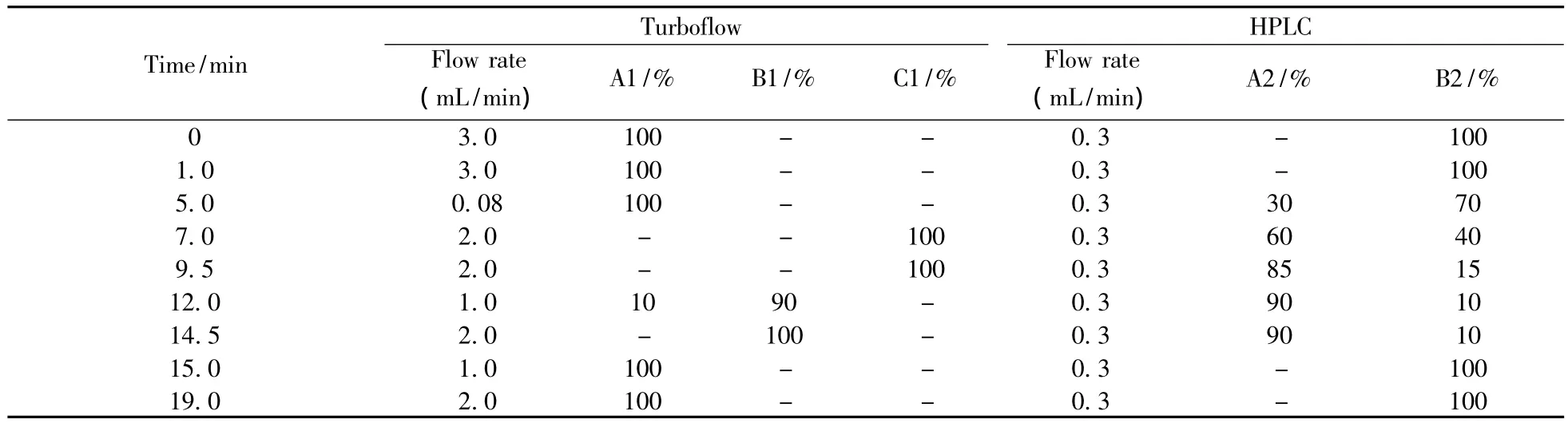
表1 16种β受体激动剂的在线净化与液相色谱洗脱程序Table 1 Online MCX SPE and HPLC elution program of 16 β-agonists
质谱条件:电喷雾正离子模式下离子化(ESI+),蒸发温度为300℃,毛细管温度为350℃,喷雾电压为3 500 V,鞘气压力为40 psi,辅助气压力为15 psi,检测模式为选择反应监测模式(SRM),检测离子对、碰撞能量(CE)、聚焦电压(Tublens)等质谱参数见表2。
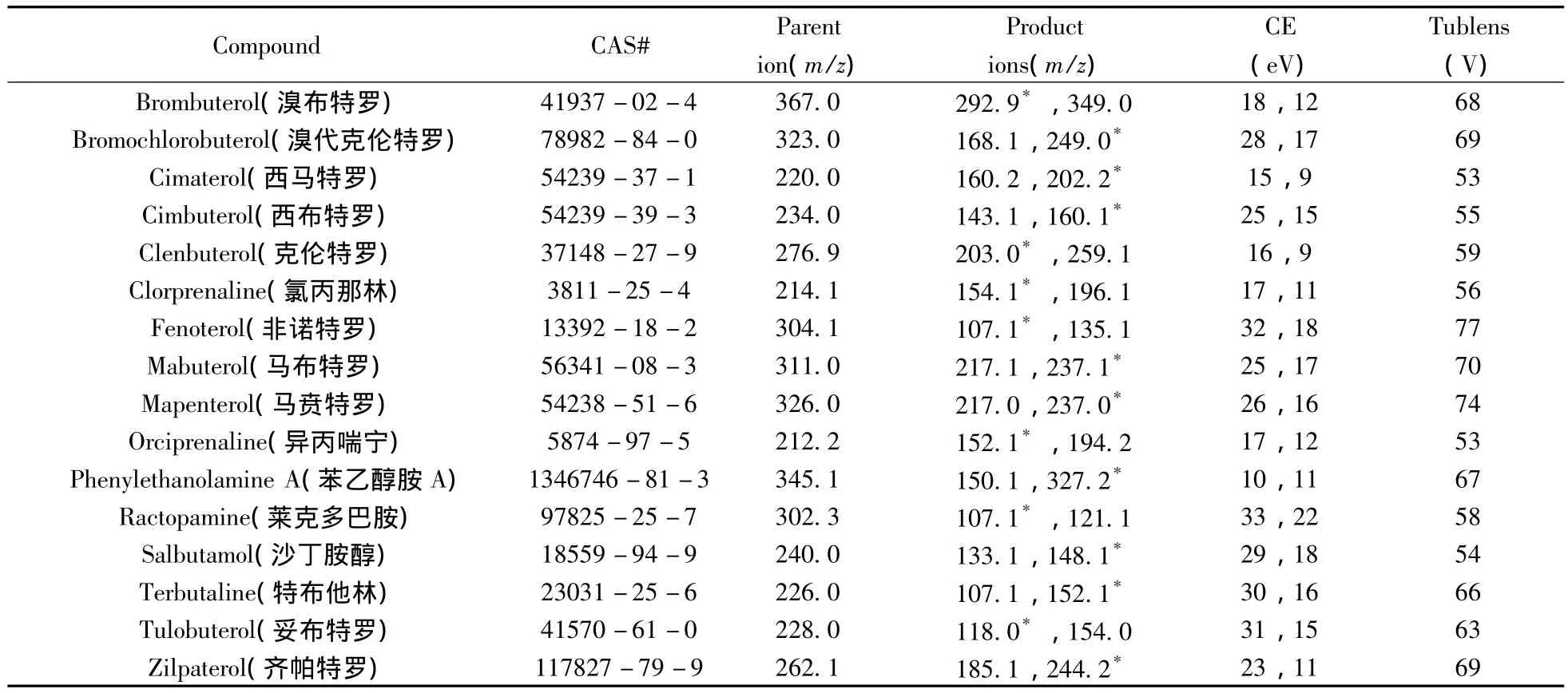
表2 16种β受体激动剂的质谱参数Table 2 Mass parameters of 16 β-agonists
1.4 样品前处理
量取5 mL尿液,加入4 mL 20 mmol/L乙酸铵溶液,用乙酸调至pH 5.2,加入50 μL β葡萄糖苷酸酶/芳基硫酸酯酶液,用乙酸铵定容至10 mL,于37℃下酶解过夜,取出后于4 000 r/min离心5 min,上清液经0.22 μm滤膜过滤后,进行Online-MCX-SPE和LC-MS/MS全自动测定。
2 结果与讨论
2.1 酶解提取条件的优化
16种β受体激动剂按苯环上取代基的差异可分为苯胺与苯酚两种类型,其中克伦特罗、马布特罗、西马特罗等苯胺型激动剂在动物体内主要发生氧化代谢作用,轭合反应率低。但非诺特罗、莱克多巴胺、沙丁胺、特布他林等苯酚型化合物在生物酶的作用下易生成各种轭合物。研究表明,尿液中以轭合物代谢的苯酚型β受体激动剂残留物≥50%[12],因此苯酚型化合物测定前常需要酶解。本方法对比了猪尿液(莱克多巴胺和克伦特罗阳性)分别在不酶解与酶解的测定结果,结果表明,在不酶解时莱克多巴胺的测定值为3.4 μg/L,克伦特罗为3.8 μg/L,而酶解后莱克多巴胺测定值为18.2 μg/L,克伦特罗为4.1 μg/L。为同时测定猪尿液中16种β受体激动剂残留,本实验选择将猪尿液在37℃酶解过夜后测定。
2.2 在线固相萃取条件的优化
β受体激动剂结构中含有苯胺和苯酚的氮碱性中心,属中等极性的疏水物质,在酸性条件下呈阳离子特征,离线SPE方法常采用反相C18和MCX柱净化。为了建立在线SPE前处理方法,本文考察了5种TurboFlow在线净化柱的效果,包括反相(Cyclone,Cyclone-p,C18,C18-P)以及阳离子交换MCX柱,结果表明,异丙喘宁、沙丁胺醇、齐帕特罗、特布他林和西马特罗5种分析物极性强,在Cyclone,Cyclone-p,C18,C18-P柱中富集性差,相对回收率在6.7% ~71.5%之间;而MCX柱是基于尺寸排阻、反相和离子交换等多种混合保留机理的净化柱,16种分析物在此柱上的回收率均不低于76.2%,因此本方法选择MCX柱为在线净化柱。
方法优化了不同淋洗强度对于待测物的影响,分别将5%氨化甲醇与水的体积比设为0∶10,2∶8,4∶6,5∶5,6∶4,7∶3,8∶2,9∶1,10∶0进行洗脱,16种β受体激动剂的回收率结果显示,淋洗强度对妥布特罗、克伦特罗、溴代克伦特罗、马贲特罗、苯乙醇胺A、溴布特罗7种化合物的影响显著,当氨化甲醇比例增至90%时,16种分析物的回收率不低于85.7%,因此本方法选用5%氨水甲醇水(体积比,9∶1)作为洗脱溶剂。
为了增加分析物洗脱的选择性,实验对洗脱流速(10,20,30,50,80,100,150 μL/min)进行了优化。结果表明,10 μL/min和20 μL/min流速不利于化物洗脱,流速在30~80 μL/min范围时,待测物的响应信号随流速的增加呈线性增加,80 μL/min后增幅减少。由于在该洗脱模式时,净化泵和液相色谱泵串联,为了减少色谱柱的承受压力,在保证16种分析物洗脱完全的条件下,本方法选用80 μL/min为洗脱流速。
2.3 色谱分离的优化
β受体激动剂类化合物具有疏水的饱和烃链,属碱性或酸碱两性物质,因此在反相色谱柱上的保留性弱。为增加化合物的保留行为,实验对比了CAPCELL MGⅡ柱和Sunshell C18两种色谱柱的分离效果,结果发现:Sunshell C18柱分析异丙喘宁时呈双色谱峰,西马特罗、特布他林和齐帕特罗3种物质峰形展宽;而采用CAPCELL MGⅡ柱分析时16种化合物均得到较好的保留。因此,方法选用CAPCELL MGⅡ柱进行分离。
2.4 基质效应的影响
实验以50 ng/mL标准溶液作为对照,比较了猪尿液加标(50 ng/mL)后直接测定、经TurboFlow净化分析的相对回收率。测定结果表明,猪尿液未经净化直接分析时的质谱响应强度降低了42.1%~91.3%,其中对异丙喘宁、沙丁胺醇和克伦特罗的质谱响应值分别降低91.3%,81.4%和88.7%。而经TurboFlow在线净化后,基质效应明显降低,而质谱响应值仅降低6.4%~17.2%。因此方法采用TurboFlow在线净化来有效降低基质干扰,并且采用基质匹配校正曲线进行定量分析。
2.5 灵敏度、线性范围及回收率
向阴性猪尿液中添加不同浓度的标准溶液,按本方法进行测定,以信噪比S/N≥3为方法检出限(LOD),S/N≥10为定量下限(LOQ),16种 β受体激动剂的 LOD为0.01~0.025 μg/L,LOQ为0.025~0.10 μg/L。在0.01~50 μg/L浓度范围内,分析物的质量浓度(X,μg/L)与对应峰面积(Y)呈良好线性关系,相关系数(r2)≥0.998 3(见表3)。
采用阴性猪尿液在LOQ,2LOQ和4LOQ水平进行加标回收实验,色谱图如图1所示,每个水平平行测定10次,结果如表3所示。16种分析物的回收率为62.4%~117.1%,相对标准偏差(RSD)为3.9%~16.3%。

表3 方法的验证数据Table 3 The validated data of method

图1 猪尿液在定量下限水平的加标回收色谱图Fig.1 Chromatograms of 16 β-agonists spiking at LOQ level in pig urine
2.6 实际样品的测定
为验证该方法的有效性,实验共收集了213个供港活猪尿样进行分析。在优化条件下,根据保留时间和特征离子碎片对测定结果进行确证分析,经基质匹配校正曲线定量,检测结果均为阴性。本方法的测定结果与标准方法[17-18]的测定结果一致。
3 结论
本方法采用Online-MCX-TurboFlow在线净化,液相色谱分离,串联四极杆质谱在电喷雾模式下检测,建立了猪尿液中16种β受体激动剂的在线全自动分析方法。与标准方法相比,本方法减少了离线的手工操作,降低了操作人员的劳动强度,减弱了基质效应。方法学验证和实际样品分析表明,该方法的灵敏度高、准确度好、操作简便,可用于实验室批量猪尿液中16种β受体激动剂残留的快速测定和确证。
[1]Courtheyn D,Le Bizec B L,Brambilla G,De Brabander H F,Cobbaert E,Van de Wiele M V,Vercammen J,De Wasch K.Anal.Chim.Acta,2002,473(1/2):71-82.
[2]Lopez-Carlos M A,Ramirez R G,Aguilera-Soto J I,Plascencia A,Rodriguez H,Arechiga C F,Rincon R M,Medina-Flores C A,Gutierrez-Bauelos H.Livestock Sci.,2011,138(1/3):251-258.
[3]Page K A,Hartzell D L,Li C L,Westby A L,Della-Fera M A,Azain M J,Dean Pringle T,Baile C A.Domestic Animal Endocrinol.,2004,26(1):23 -31.
[4]Cao B Y,He G Z,Yang H,Chang H F,Li S Q,Deng A P.Talanta,2013,115(15):624 -630.
[5]Caban M,Stepnowski P,Kwiatkowski M,Migowska N,Kumirska J.J.Chromatogr.A,2011,1218(44):8110-8122.
[6]Williams L D,Churchwell M I,Doerge D R.J.Chromatogr.B,2004,813(1/2):35 -45.
[7]Shao B,Jia X F,Zhang J,Meng J,Wu Y N,Duan H J,Tu X M.Food Chem.,2009,114(3):1115 -1121.
[8]Juan C,Igualada C,Moragues F,León N,Maes J.J.Chromatogr.A,2010,1217(39):6061 -6068.
[9]Wang X J,Zhang F,Ding F,Li W Q,Chen Q Y,Chu X G,Xu C B.J.Chromatogr.A,2013,1278(22):82-88.
[10]Gao Z,Wu M T,Cao J M.J.Instrum.Anal.(高照,吴侔天,曹建民.分析测试学报),2012,31(1):7-14.
[11]Moragues F,Igualada C.Anal.Chim.Acta,2009,637(1/2):193-195.
[12]Fiori M,Civitareale C,Mirante S,Magarò E,Brambilla G.Anal.Chim.Acta,2005,529(1/2):207 -210.
[13]Shishani E,Chai S C,Jamokha S,Aznar G,Hoffman M K.Anal.Chim.Acta,2003,483(1/2):137-145.
[14]Jiang W F,Zhao S.J.Instrum.Anal.(蒋万枫,赵珊.分析测试学报),2013,32(6):675-680.
[15]Salem A A,Wasfi I A,Al-Nassibi S S.J.Chromatogr.B,2012,908(1/2):27-38.
[16]Liu S,Wang M M,Ai L F,Xing T,Hao Y L,Wang X S.J.Instrum.Anal.(刘珊,王曼曼,艾连峰,邢涛,郝玉兰,王学生.分析测试学报),2013,32(5):547-552.
[17]Ministry of Agriculture Proclamation 1063 -3 -2008.Determination of β-Agonists Residues in Pig Urine Liquid Chromatography-Tandem Mass Spectrometry.The Agricultural Ministry Standard of China(动物尿液中11种β-受体激动剂的检测液相色谱-串联质谱法.中国农业部标准).
[18]Ministry of Agriculture Proclamation 1031 -3 -2008.Determination of β-Agonists Residues in Swine Liver and Urine Gas Chromatography-Mass Spectrometry Method.The Agricultural Ministry Standard of China(猪肝和猪尿中β-受体激动剂残留检测气相色谱-质谱法.中国农业部标准).

