β位淀粉样前体蛋白裂解酶2基因敲除斑马鱼动物模型的构建及其初步应用
卢 晶 吴 谦 谢荣荣 仇海燕 程 呈 杨金奎*
(1.首都医科大学附属北京同仁医院内分泌科 糖尿病防治研究北京市重点实验室,北京100730;2.北京大学生命科学院,北京100871)
β位淀粉样前体蛋白裂解酶1(β-site APP-cleaving enzyme 1,BACE1)在阿尔茨海默病(Alzheimer’s disease,AD)脑组织中的β-淀粉样蛋白沉淀中起重要作用[1]。BACE2是BACE1的密切同源物,在阿尔茨海默病的发病中同样起重要作用。已有研究[2]表明,糖尿病与阿尔茨海默病的发病密切相关。BACE1和BACE2均在人类胰腺组织中高表达,BACE1在胰腺的内分泌和外分泌腺中均有表达,而BACE2仅在胰岛β细胞中特异性表达[3]。BACE2在维持胰岛β细胞的形态方面具有重要作用。将小鼠BACE2基因敲除后,小鼠的胰岛β细胞团增大,空腹血糖下降。葡萄糖刺激后,敲除鼠的胰岛素分泌增加,血糖降低明显[4]。BACE2特异性阻滞剂在小鼠中可刺激新的胰岛β细胞生成。BACE2已经成为2型糖尿病的药物治疗新靶点[5]。BACE2在胰岛β细胞生成和胰腺发育中的具体作用机制尚不清楚,此外,为寻找糖尿病药物治疗新靶点,针对BACE2基因的大规模药物筛选亟须建立。
糖尿病动物模型是研究糖尿病发病机制、临床表现和药物靶点筛选的基础。糖尿病动物模型可分为自发性和实验性糖尿病动物模型两类。前者与人类的单基因及多基因遗传的2型糖尿病仍相差甚远。新近的实验性糖尿病动物模型包括采用基因敲除技术构建基因修饰动物模型。传统的基因敲除技术包括胚胎干细胞(embryonic stem cell,ES)细胞打靶技术、锌指核酸酶(zinc finger nucleases,ZFNs)技术和转录激活因子样效应物核酸酶(transcription activator-like effector nucleases,TALEN)技术[6]。成簇的规律间隔的短回文重复序列(clustered regularly interspaced short palindromic repeats,CRISPR)-Cas9是细菌用来抵御病毒侵袭/躲避哺乳动物免疫反应的基因系统。2013年1月,科学家们利用RNA引导Cas9核酸酶技术可以在多种细胞中特定的基因组位点进行切割、修饰,这一技术随即被运用到构建基因敲除动物模型中[7-9]。目前这一技术已广泛用于斑马鱼的敲除动物模型。
斑马鱼的内脏器官、血液与视觉系统,在基因水平上87%与人类同源。斑马鱼具有胚胎透明、体外发育、发育快、后代数量大等优势,逐渐使其成为遗传发育研究领域中的一种重要的模式生物[10]。斑马鱼在药物筛选方面尤其具有极强应用价值。斑马鱼胚胎可以同时提供大量互不干扰的形态学信息,在药物筛选初期就可评估药物的毒性,并尽早排除那些能引起毒性的化合物,因此构建疾病基因相关的转基因斑马鱼可以筛选治疗相关疾病的潜在药物[11]。此外,尽管人和斑马鱼的胰腺形态上存在一定的差别,但是与胰腺发育和疾病相关的分子机制相似。因此,构建斑马鱼动物模型可以观察特定基因对胰腺发育的影响。
本研究拟应用CRISPR/Cas9技术构建BACE2大片段删除的斑马鱼模式动物模型。该动物模型将被用于斑马鱼BACE2基因对胰腺发育的功能研究,为阐释斑马鱼胰腺发育机制提供了动物模型。本课题组将在后续研究中进一步运用BACE2斑马鱼模式动物模型进行大规模药物筛选,筛选出针对糖尿病的新型药物。
1 材料和方法
1.1 实验材料
本研究在北京大学生命科学院张博教授斑马鱼饲养中心培育斑马鱼。选用AB品系的斑马鱼作为研究对象。斑马鱼的养殖条件是28.5℃的恒温鱼房,14 h光照/10 h黑暗交替循环,饲养环境保持日夜循环水,每天另补充10%新鲜去离子水。
pMD 19-gRNA scaffold质粒由北京大学熊敬维教授馈赠。MirVanaTMmiRNA isolation kit(Ambion公司,美国);动物组织总RNA提取试剂盒(货号DP431),Fast Quant cDNA第一链合成预混试剂(货号KR108)均购自天根生化科技有限公司。
1.2 实验方法
1.2.1 设计BACE2基因敲除靶点
本实验从斑马鱼基因组网站(http://www.ensembl.org/Danio_rerio/Info/Index)得到斑马鱼BACE2基因的序列和结构信息。根据CRISPR/Cas9介导的斑马鱼基因组定点突变靶点设计原则,对BACE2基因进行靶向设计。Cas9基因打靶系统由Cas9核酸酶和guide RNA(gRNA)构成,其中gRNA中含有主位点序列,负责识别靶基因;Cas9核酸酶负责切割靶点,造成DNA双链断裂(double strand break,DSB)。Cas9靶点要求包含20个碱基的主位点和紧邻主位点3’端的PAM区。PAM区的序列要求为NGG,N为任意碱基。
本研究采用大片段删除的突变(deletion)的方法,因此需要同时设计两个位点。删除长度应控制在0.5~3 Kb之间,两个靶点的效率应分别在30%和50%以上。根据这一原则,最终选择BACE2的两个靶点序列分别为:上游靶位点序列5'-GGTTGAGTAGCATGTGATGCAGG-3';下游靶位点序列为5'-GGTGTGCTATGTTGGAGATGGG-3'。
1.2.2 gRNA的制备
1)制备gRNA体外转录模板
根据BACE2靶点设计、合成含有SP6启动子序列的引物序列。上游的引物序列为:5'-ATTTAGGTGACACTATA GGTTGAGTAGCATGTGATGC GTTTTAGAGCTAGAAATAGC-3'。下游的引物序列为5'-ATTTAGGTGACACTATA GGTGTGCTATGTTGGAGAT GTTTTAGAGCTAGAAATAGC-3'(5'下划线加粗部分为SP6启动子序列,中间画框为Cas9主位点序列,3'下划线部分为gRNA scaffold固定序列)。
合成Tracr rev引物,序列为5'-AAAAAAAGCACCGACTCGGTGCCAC-3'。使用 SP6引物和 Tracr rev引物对,以pMD19-gRNA scaffold质粒(质粒图谱详见图1)为模板,采用PCR扩增得到体外转录gRNA模板。PCR产物采用DNA产物超薄纯化试剂盒(天根生化科技有限公司,货号DP203)回收。
2)体外转录和回收gRNA
按照gRNA体外转录体系配置方法,体外转录gRNA。体外转录体系(20 μL)如下:SP6 Enzyme 2 μL,5×TransBuffer 2 μL,100 mmol/L DTT 2 μL,RNasin 0.5 μL,NTP(10 mmol/L)2 μL,DNA 模板1 μg,补足DEPC H2O至20 μL。37℃ 体外转录1 h,加入1 μL TURBO DNase,再次放入37 ℃,15 min;取3 μL 电泳查看转录效果,采用mirVanaTMmiRNA isolation kit回收gRNA。

图1 pMD19-gRNA scaffold质粒载体示意图Fig.1 pMD19-gRNA scaffold plasmid vectors
1.2.3 制备F0斑马鱼和靶点突变效率筛选
将Cas9 mRNA和gRNA混合注射到一细胞期的斑马鱼鱼卵中,注射量为:Cas9 mRNA 300 pg,gRNA 150 pg;取注射后受精后2~4 d(2~4 days post fertilization,2~4 dpf)的斑马鱼胚胎,提取基因组DNA,进行PCR。PCR上游引物为5'-TGTTCCGCGGATGCATTAAG-3';下游引物为5'-TACCACACGACACCCAATGC-3'。反应条件为:95℃ 5 min;95℃ 30 s,59℃ 30 s,72 ℃ 60 s,33 cycles;72 ℃ 5 min,自然冷却至室温。将Deletion的条带回收、连接、转化,构建到pGEM-T-easy载体后测序。
将突变成功的F0胚胎饲养直至性成熟(90 dpf),与野生型(wild type,WT)成鱼交配,收集1 dpf胚胎,4个为一组,针对每一条F0分组提取基因组DNA,进行PCR。
1.2.4 筛选BACE2基因删除的F1成鱼
将含有BACE2基因大片段删除的F0斑马鱼与WT交配,产生大量F1,至少需要60条成鱼,筛选F1(杂合子)。将F1饲养至两个月左右剪尾鳍,提基因组,进行PCR,PCR反应条件同1.2.3。将Deletion的条带回收、连接、转化,构建到pGEM-T-easy载体后测序确定基因型。带有同一突变的杂合子的鱼可以混合饲养。以筛选出的F1作为亲本,建立突变群体。
1.2.5 RT-PCR检测不同时间BACE2表达
为了研究BACE2基因在斑马鱼胰腺发育过程中的表达情况,本研究采用RT-PCR的方法对不同时间点的斑马鱼胚胎进行分析。采用动物组织总RNA提取试剂盒提取成鱼的RNA,采用FastQuant cDNA第一链合成预混试剂合成cDNA。β-actin基因作为内参。采用DragonPCR仪器检测BACE2基因在不同时间的斑马鱼胚胎中的表达情况。β-actin基因上游引物:5'-TGTTTTCCCCTCCATTGTTGG-3';下游引物:5'-TTCTCCTTGATGTCACGGAC-3'。BACE2基因上游引物:5'-TATTTGCGGGGAAATTCAAC-3';下游引物:5'-TGATGTAGGGATGTGCTGCT-3'。PCR反应体系为20 μL,2×Enzyme mix 10 μL;正向引物 0.4 μL;反向引物0.4 μL;cDNA 1.5 μL,DEPC H2O 7.7 μL。扩增条件为94 ℃ 5 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 20 s,35 cycles;72℃ 5 min,自然冷却至室温。
2 结果
2.1 成功构建BACE2大片段删除的F0斑马鱼
将Cas9 mRNA和gRNA混合注射到一细胞期的斑马鱼鱼卵中,取注射后2~4 dpf的斑马鱼胚胎,提取基因组DNA,进行PCR。PCR结果见图2。结果显示,WT为一条带,大小为1 025 bp,含有BACE2基因删除的斑马鱼除了WT条带,还有一条477 bp的条带。将477 bp条带切胶回收构建到pGEM-T-easy载体,测序结果显示该条带为BACE2基因删除548 bp后的序列(图3,测序图为反向互补序列)。
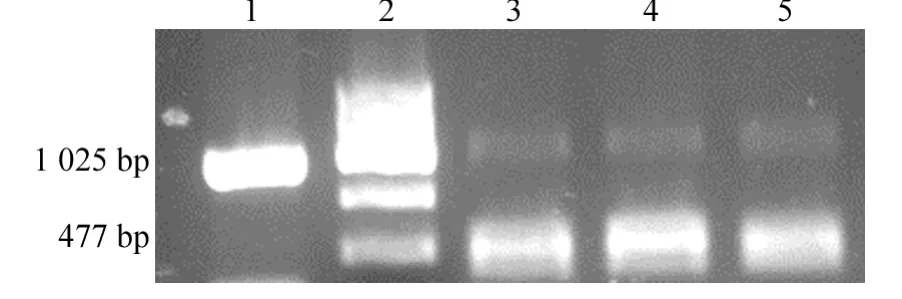
图2 PCR扩增BACE2删除序列附近PCR产物Fig.2 PCR amplification of BACE2,delete PCR product near the sequence

图3 BACE2基因删除548bp测序图及序列示意图Fig.3 Sequencing graph of BACE2 gene after deleting 548 bp using reversed complementary sequence
2.2 BACE2基因缺失对斑马鱼生长发育的影响
本研究将筛选后得到的BACE2基因大片段删除F1经内交后得到F2代斑马鱼。F2代斑马鱼继续饲养至12~16 d时,有部分幼鱼死亡。收集死亡幼鱼尸体,提取基因组,经 PCR检测鉴定死鱼大部分为BACE2纯合突变体。为深入研究这一现象,本研究收集100条幼鱼进行常规饲养,饲养至12~16 d时共收集到24条死亡幼鱼的尸体,经PCR扩增后鉴定结果显示,24条死鱼中有14条为BACE2纯合突变体。这一数据表明,缺失BACE2基因的幼鱼在发育早期部分无法存活。
本研究继续饲养F2斑马鱼至其成熟后剪尾鳍,做PCR检测鉴定其基因型发现只有极少的纯合突变体可以长至成鱼。BACE2纯合突变斑马鱼的体质量、体长与野生对照组无明显差异。
2.3 BACE2基因在斑马鱼胰腺的表达谱
为研究BACE2基因在斑马鱼胰腺发育过程中的表达情况,本实验采用RT-PCR对不同时间点的斑马鱼胚胎的BACE2基因表达进行检测。选用β-actin作为内参。结果显示BACE2基因在斑马鱼发育早期(从受精后18 h到3 d)持续表达,这说明BACE2基因在斑马鱼胚胎胰腺发育中起重要作用。详见图4。

图4 RT-PCR扩增BACE2在斑马鱼发育早期的表达Fig.4 Expression of RT-PCR amplification of BACE2 in the early development of zebrafish
3 讨论
本研究利用CRISPR/Cas9基因打靶技术,成功构建了BACE2基因大片段删除的斑马鱼动物模型。筛选F1代成鱼后结果显示,BACE2纯合突变体在发育早期部分死亡,仅有部分能存活至成鱼。通过RTPCR检测发现,BACE2基因在斑马鱼发育早期从5 hpf到6 d持续表达,这说明说明BACE2在斑马鱼胚胎的胰腺发育中起重要作用。
本研究采用新型的基因敲除技术,即CRISPR/Cas9基因打靶技术。这一技术具有以下几点优势。首先,CRISPR/Cas9基因打靶技术无物种限制,可以用于小鼠[12-13]、大鼠、酵母[14]、线虫、斑马鱼[15]等多种生物。其次,与其他基因敲除技术,如传统的ES细胞打靶技术、锌指核酸酶技术和TALEN相比,CRISPR/Cas9敲除技术具有时间周期短的优点。传统的ES细胞打靶技术周期约为12个月,采用TALEN技术构建基因敲除动物模型周期约为9个月,而CRISPR/Cas9敲除技术仅需要6个月即可得到F1代基因敲除斑马鱼。第三,与锌指核酸酶技术和TALEN技术相比,CRISPR/Cas9技术具有敲除效率更高,脱靶率更低的优点。第四,CRISPR/Cas9基因打靶技术操作简单,需要的仪器较少。根据靶点选择原则设计合适的CRISPR/Cas9靶点,构建gRNA后与Cas9共同注射斑马鱼卵,检测敲除效率即可。本研究利用最新的CRISPR/Cas9基因打靶技术,3个月内即成功构建了BACE2基因大片段删除的斑马鱼动物模型。
本研究的后续工作将围绕胰岛发育机制和药物筛选两方面进行。首先,本课题组将检测BACE2杂合或纯合突变体和WT斑马鱼的血糖和胰岛素分泌情况。为进一步研究BACE2基因在斑马鱼胰腺发育中的作用机制,本课题组将利用原位杂交技术和实时荧光定量PCR技术探究胰腺主要表达基因,如标记内分泌腺的胰岛素、胰高血糖素、生长抑素以及标记外分泌腺的胰蛋白酶等,在BACE2杂合或纯合突变体中的表达情况。此外,运用斑马鱼作为整体动物模型进行高通量的筛选并跟踪考察药物在斑马鱼模型体内的吸收、代谢及分布等情况,将为糖尿病研究提供更多的具有临床应用价值的有效信息。本课题组将运用本研究构建的BACE2敲除斑马鱼动物模型进行糖尿病的药物筛选,寻找糖尿病的药物治疗新靶点。
[1] Vassar R,Bennett B D,Babu-Khan S,et al.Beta-secretase cleavage of Alzheimer’s amyloid precursor protein by the transmembraneaspartic protease BACE[J].Science,1999,286(5440):735-741.
[2] Carlsson C M.Type 2 diabetes mellitus,dyslipidemia,and Alzheimer’s disease”[J].J Alzheimers Dis,2010,20(3):711-722.
[3] Casas S,Casini P,Piquer S,et al.BACE2 plays a role in the insulin receptor trafficking in pancreatic β-cells[J].Am J Physiol Endocrinol Metab,2010,299(6):E1087-E1095.
[4] Esterházy D,Stutzer I,Wang H Y,et al.Bace2 is a β cell-enriched protease that regulates pancreatic β cell function and mass[J].Cell Metab,2011,14(3):365-377.
[5] Southan C.BACE2 as a new diabetes target:a patent review 2010-2012[J].Exerp Opin Ther Pat,2013,25(3):649-663.
[6] Huang P,Xiao A,Zhou M,et al.Heritable gene targeting in zebrafish using customized TALENs[J].Nature Biotechnol,2011,29(8):699-700.
[7] Cong L,Ran F A,Cox D,et al.Multiplex genome engineering using CRISPR/Cas systems[J].Science,2013,339(6121):819-823.
[8] Mali P,Yang L,Esvelt K M,et al.RNA-guided human genome engineering via Cas9[J].Science,2013,339(612):823-826.
[9] Wang H,Yang H,Shivalila C S,et al.One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genomeengineering [J].Cell,2013,153(4):910-918.
[10] Spagnoli F M.From endoderm to pancreas:a multistep journey[J].Cell Mol Life Sci,2007,64(16):2378-2390.
[11]Zorn A M,Wells J M.Molecular basis of vertebrate endoderm development[J].Int Rev Cytol,2007,259:49-111.
[12] Osiak A,Radecke F,Guhl E,et al.Selection-independent generation of gene knockout mouse embryonic stem cells using zinc-finger nucleases[J].PloS One,2011,6(12):e28911.
[13]Doyon Y,McCammon J M,Miller J C,et al.Heritable targeted gene disruption in zebrafish using designed zinc-finger nucleases[J].Nat Biotechnol,2008,26(6):702-708.
[14] Li T,Huang S,Zhao X,et al.Modularly assembled designer TAL effector nucleases for targeted gene knockout and gene replacement in eukaryotes[J].Nucleic Acids Res,2011,39(14):6315-6325.
[15]Xiao A,Wang Z X,Hu Y Y,et al.Chromosomal deletions and inversions mediated by TALENs and CRISPR/Cas in zebrafish[J].Nucleic Acids Res,2013,41(14):e141.

