S-腺苷甲硫氨酸增加salsolinol对多巴胺能神经细胞SH-SY5Y的毒性
卢剑清 邓玉林
(北京理工大学生命学院,北京100081)
帕金森病(Parkinson’s disease,PD)是常在老年发生的神经退行性疾病,是目前世界上第二大神经退行性疾病,PD的一个重要病征就是黑质区多巴胺能神经元的丧失,但是目前其发病机制尚不清楚[1]。目前的关于PD病因的研究主要集中在遗传因素和环境因素方面,其中在环境因素方面主要包括1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine,MPTP)、鱼藤酮、百草枯等外源性神经毒素,多种实验均证明此类神经毒素可引起多巴胺能神经元凋亡[2-3]。多巴胺与醛类缩合生成的儿茶酚四氢异喹啉(catechol tetrahydroisoquinolines,CTIQ),例如与乙醛缩合形成儿茶酚异喹啉类神经毒素(salsolinol,Sal),然后氮甲基化形成氮甲基去甲猪毛菜碱(N-methylsalsolinol,NMSal),最后氧化生成异喹啉离子DMDHIQ+,其代谢过程如图1所示[4]。而DMDHIQ+与MPP+是结构类似物,可以抑制线粒体复合体Ⅰ的活性,引起氧化应激,造成细胞凋亡[5-6]。而在此过程中,第一步的缩合反应和最后一步的氧化反应都可以通过自发反应或者酶促反应发生,而中间的氮甲基化反应则必须由酶促反应生成,所以氮甲基化是整个反应的较为关键的步骤。

图1 DA生成CTIQ的代谢过程Fig.1 The metabolism from DA to CTIQ
S-腺苷甲硫氨酸(S-adenosyl methionine,SAM)是氮甲基化反应的甲基供体。近年来,SAM作为药物或者保健品在肝损伤、抑郁症等病症的治疗方面得到了应用[7]。而在PD方面,有研究[8]发现,经左旋多巴治疗的PD患者体内出现SAM与S-腺苷-L-高半胱氨酸(S-adenosyl-L-homocysteine,SAH)比率的降低。临床上有利用SAM治疗PD患者的抑郁症状,改善患者生活品质,因此对于SAM对PD患者的安全性考察很有必要[9]。
本实验采用多巴胺能神经元SH-SY5Y为模型,使用Sal以及SAM联合的方式诱导细胞。综合使用MTT、Hoechst 33258对核染色的方式检测了其凋亡水平,检测了胞内ATP的量,最后使用高效液相色谱法(high performance liquid chromatograph,HPLC)检测了胞内Sal氮甲基化后的产物NMSal的量,通过这些实验考察了SAM对Sal神经毒性的影响,以评价其在PD治疗中的应用价值。
1 材料与方法
1.1 试剂与仪器
DMEM培养基(美国Gibco公司),胎牛血清(杭州四季青),0.25%(质量分数)胰蛋白酶(北京索莱宝科技有限公司),ATP检测试剂盒(碧云天生物技术公司),SAM、Sal、MTT、Hoechst 33258、偏亚硫酸氢钠、Na2EDTA(美国 Sigma-Aldrich 公司),NaCl、高氯酸等分析纯试剂购自北京化学试剂公司。酶标仪(美国Thermo-Fisher公司,型号:Multiskan Ascent),激光共聚焦显微镜(德国Leica公司,型号:TCS-SP5),荧光素酶检测仪(美国Promega公司,型号:2031),HPLCECD(美国ESA公司,型号:6210),五氟苯基柱(美国Sigma-Aldrich 公司,4.6 mm i.d. × 250 mm,5 μm)。
1.2 细胞培养
SH-SY5Y细胞使用DMEM,10%(体积分数)胎牛血清,37℃,5%CO2条件下培养。
1.3 MTT 实验

1.4 Hoechst 33258细胞核染色实验
将细胞种植于盖玻片上,置于6孔板中,按相应的浓度加药后,孵育24 h。取出盖玻片,PBS清洗后使用甲醇:冰乙酸(3∶1)4℃处理5 min固定细胞,蒸馏水漂洗干净后使用20 μg/mL的Hoechst 33258室温避光染色10 min,使用三蒸水洗3次,每次5 min。然后将盖玻片用甘油-PBS封片剂封片。激光共聚焦显微镜显微镜观察,使用405 nm紫外光激发观察核质固缩情况并拍摄。随机选择3个以上的视野,统计其中凋亡细胞的数量,并除以总细胞数,则为凋亡率。
1.5 ATP含量检测
将细胞种入6孔板中,按相应的浓度加药后,孵育24h。使用0.25%(质量分数)胰蛋白酶消化下来,1 000 r/min离心后,弃去上清。根据试剂盒说明书,加入100 μL裂解液,涡旋混匀,12 000 g,4℃离心10 min取上清。准备好标准品溶液和检测工作液,将100 μL工作液加入离心管中,室温放置3~5 min消除本底,加入20 μL标准品或者样品后,迅速混匀,间隔2 s后用荧光素酶检测仪测定,然后根据标准曲线计算样品中ATP的绝对浓度。
1.6 HPLC-ECD测定NMSal的含量
将细胞种入10 cm培养皿,按相应浓度加药后,孵育24 h,使用0.25%(质量分数)胰蛋白酶消化下来,1 000 r/min离心后,弃去上清,再使用PBS洗3次后重悬于200 μL PBS中。使用超声破碎仪破碎细胞,功率210 W,超声1 s,停2 s,超声时间1 min。超声完成后将样品12 000 g,4℃离心10 min,取上清,以1∶10的比例加入2 mol/L的高氯酸(含0.4 mmol/L偏亚硫酸氢钠和0.1 mmol/L的Na2EDTA),12 000 g,4℃离心10 min除去蛋白,上清即为样品。
样品经0.22 μm滤头过滤之后即可进样,HPLCECD的检测条件如表1所示。

表1 HPLC-ECD色谱条件Tab.1 Chromatographic condition of HPLC-ECD
1.7 统计学方法
所有数据均使用SPSS 13.0统计分析,所得结果以均数±标准差(±s)表示,组间比较使用单因素方差方法和LSD分析法,以P<0.05差异有统计学意义。
2 结果
2.1 SAM降低Sal诱导之后细胞的存活率
从图2可以看出,在Sal的作用之下,SH-SY5Y细胞随着Sal浓度的增加存活率逐渐下降,在400 μmol/L之前,下降的幅度不是很大,超过400 μmol/L之后,存活率越来越低,半数致死浓度约在800 μmol/L左右,当浓度超过1 000 μmol/L时,存活率急剧下降接近全部死亡。当使用100 μmol/L SAM同时诱导之后,在没有加入Sal时,其存活率与正常细胞一致,说明SAM在此浓度之下本身不对细胞造成影响,在400 μmol/L时,其存活率与未加SAM的组也差异无统计学意义(P>0.05)。而当Sal的浓度达到500 μmol/L之后,可以明显看到加入SAM共同诱导的细胞其存活率明显下降,存活率下降的幅度在Sal浓度为500~1 000 μmol/L时基本保持一致。而当Sal浓度超过1 000 μmol/L后,由于细胞病死率太高,此时SAM并未表现出明显的促进死亡的效应。
从以上结果可以看出,SAM可以增加Sal对多巴胺能神经元的毒性作用,并且这种促进作用并不随着Sal浓度的增加而变大。
2.2 SAM增加Sal引发的细胞凋亡
凋亡细胞表现出细胞核核质固缩的效应,核体积变小,呈现深染的现象。图3展示的就是使用Hoechst 33258对细胞核进行染色之后的结果,从图3中可以看出,对照组和单独使用100 μmol/L SAM处理组细胞核状态正常,细胞核大小均一。而当加入500 μmol/L和1 000 μmol/L Sal后,细胞核出现了体积变小,核质固缩的现象,说明出现了细胞凋亡(图3C和3E)。当加入100 μmol/L SAM后,细胞凋亡的情况更为严重(图3D和3F)。图3G表示的是统计了所有细胞之后的结果,从结果来看,SAM能够显著增加SH-SY5Y细胞在Sal诱导之下的凋亡程度。
2.3 SAM促进Sal引起的细胞内ATP量的减少
ATP是细胞内最重要的能量分子,其含量反映了细胞的活力。图4展示了各组ATP量的结果,对照组和单独使用100 μmol/L SAM诱导组其ATP浓度差异无统计学意义。当使用Sal诱导之后,ATP浓度开始下降,其中1 000 μmol/L Sal组ATP浓度下降的程度要高于500 μmol/L Sal组。当加入SAM共同孵育之后,可以看到与对应组相比,ATP浓度有了下降,而在1 000 μmol/L Sal组,ATP浓度具有显著下降。
2.4 SAM增加Sal诱导之后细胞中NMSal的量
NMSal是多巴胺通过代谢生成毒性物质DMDHIQ+的重要的中间物质,也是Sal与SAM在氮甲基转移酶的作用之下的直接产物,图5A展示的是使用HPLC-ECD检测的样品中内源性神经毒素的量,其中箭头所指的14 min左右的峰即为NMSal。图5B为统计了各组细胞中NMSal的含量所得结果,从图中可以看出,在对照和100 μmol/L SAM诱导的组中未检测到有显著的NMSal出现,说明此时内源性NMSal的量在检测限之下。而当加入Sal之后,NMSal的水平大幅度增加,说明Sal代谢生成了NMSal,而当加入100 μmol/L SAM联合诱导之后,NMSal浓度升高,其中在1 000 μmol/L Sal组 NMSal浓度显著升高。这说明SAM作为生成NMSal的底物之一,它的加入可以促进Sal代谢成为NMSal。

图2 MTT检测细胞存活率Fig.2 The cell survival curve determined by MTT
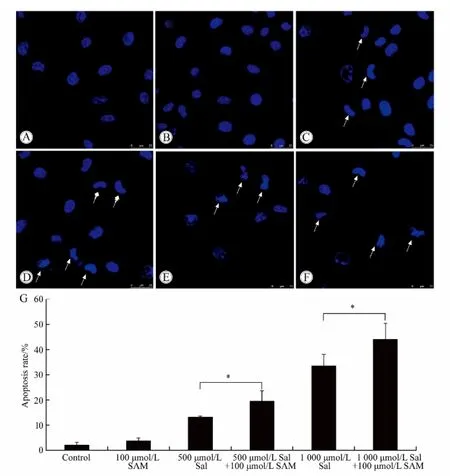
图3 Hoechst 33258对细胞核染色检测细胞凋亡Fig.3 Apoptosis determined by the Hoechst 33258 stain nucleuses
3 讨论
环境因素是目前PD发病机制的研究方向之一,而内源性神经毒素的研究是其中很重要的一个方面,CTIQs作为多巴胺的直接代谢产物,可以在很多方面解释PD发病过程中多巴胺能神经元选择性死亡的原因[10]。对于 CTIQs毒性机制的研究已有很多文献[11-12]报道,Sal可以在SH-SY5Y细胞中引发氧化应激,造成GSH水平和ATP量下降,凋亡水平增加,同时激活JNK和NFκB等信号通路。NMSal的毒性要高于 Sal[13],NMSal在体外可以引起羟基自由基的增加[14],在NMSal的诱导之下,SH-SY5Y细胞呈现出核质固缩、DNA Ladder、caspase 3被激活等一系列凋亡相关现象,并且线粒体膜电位也随之下降[15]。而在α-synuclein过表达以及Parkin敲低的PC12细胞中,能够检测到 salsolinol和 NMSal含量的显著升高[16-17]。在大鼠体内,使用NMSal定位注射至大鼠脑部纹状体区后,可以观察到其行为学的改变,同时可以检测到对应位置的多巴胺能神经元受到损伤[4]。

图4 各组细胞中ATP量Fig.4 ATP content in the cells

图5 HPLC-ECD检测SH-SY5Y细胞中的NMSalFig.5 The NMSal level determined by HPLC-ECD in the SH-SY5Y cells
本课题中,使用Sal与SAM联合诱导多巴胺能神经细胞SH-SY5Y,从结果来看,SAM可以促进Sal毒性作用的发挥,降低细胞存活率,并且引发细胞凋亡水平的增加。与此同时,Sal也可以破坏细胞的能量代谢稳态,胞内ATP的含量降低,而SAM可以增加这种损伤的水平。而且在MTT的实验结果可以看出,单独使用SAM诱导细胞并不会影响细胞的存活率,这就说明了SAM增加Sal的毒性作用是因为其与Sal发生了相互作用引起的。在大鼠脑中,使用微透析的方式可以检测到,输入Sal之后生成了NMSal,这说明Sal在脑内可以生成 NMSal[18-21]。Naoi等[19]在脑内和淋巴细胞中检测到了中性和碱性两种氮甲基转移酶可以催化Sal生成NMSal,并且这些酶的活性在PD患者中活性较高[20]。在本实验中,通过 HPLC-ECD的检测发现,SAM诱导之后,NMSal的生成量有显著增加,这说明了SAM所引发的Sal毒性的增加可能是通过是Sal生成更多毒性较大的NMSal引起的。
通过以上结果证明了,在多巴胺能细胞中,SAM的加入可以增强内源性神经毒素Sal的毒性,因此SAM可能对PD的治疗具有不利的效应。但是SAM除了引发Sal的毒性增加外,还有增强基因甲基化水平等其他效应,其综合作用如何尚未有明确的结果,所以需要进行其他方面的研究才能最终确定SAM在PD治疗方面的应用价值。
[1] Mhyre T R,Boyd J T,Hamill R W,et al.Parkinson's disease[J].Sub cell Biochem,2012,65:389-455.
[2] Blesa J,Przedborski S.Parkinson's disease:animal models and dopaminergic cell vulnerability[J].Front Neuroanat,2014,8:155.
[3] Hipkiss A R.Aging risk factors and Parkinson's disease:contrasting roles of common dietary constituents[J].Neurobiol Aging,2014,35(6):1469-1472.
[4] Naoi M,Maruyama W,Dostert P,et al.Dopamine-derived endogenous 1(R),2(N)-dimethyl-6,7-dihydroxy-1,2,3,4-tetrahydroisoquinoline,N-methyl-(R)-salsolinol,induced parkinsonism in rat:biochemical,pathological and behavioral studies[J].Brain Res,1996,709(2):285-295.
[5] Morikawa N,Naoi M,Maruyama W,et al.Effects of various tetrahydroisoquinoline derivatives on mitochondrial respiration and the electron transfer complexes[J].J Neural Transm,1998,105(6-7):677-688.
[6] Arshad A,Chen X,Cong Z,et al.TRPC1 protects dopaminergic SH-SY5Y cells from MPP+,salsolinol,and N-methyl-(R)-salsolinol-induced cytotoxicity[J].Acta Biochim Biophysi Sin,2014,46(1):22-30.
[7] 万红贵,郭一丹,蔡恒,等.S-腺苷甲硫氨酸研究进展及市场应用分析[J].现代生物医学进展,2008,8(10):1951-1955.
[8] Obeid R,Schadt A,Dillmann U,et al.Methylation status and neurodegenerative markers in Parkinson disease[J].Clin Chem,2009,55(10):1852-1860.
[9] 王苏华,赵杨静,曾萍,等.S-腺苷蛋氨酸的神经保护作用的研究进展[J].毒理学杂志,2012,26(5):381-384.
[10] Nagatsu T.Isoquinoline neurotoxins in the brain and Parkinson's disease[J].Neurosci Res,1997,29(2):99-111.
[11] Wanpen S,Govitrapong P,Shavali S,et al.Salsolinol,a dopamine-derived tetrahydroisoquinoline,induces cell death by causing oxidative stress in dopaminergic SH-SY5Y cells,and the said effect is attenuated by metallothionein[J].Brain Res,2004,1005(1-2):67-76.
[12] Wanpen S,Kooncumchoo P,Shavali S,et al.Salsolinol,an endogenous neurotoxin,activates JNK and NF-kappaB signaling pathways in human neuroblastoma cells[J].Neurochemi Res,2007,32(3):443-450.
[13]Naoi M,Maruyama W,Nagy G M.Dopamine-derived salsolinol derivatives as endogenous monoamine oxidase inhibitors:occurrence,metabolism and function in human brains[J].Neurotoxicology,2004,25(1-2):193-204.
[14] Maruyama W,Dostert P,Matsubara K,et al.N-methyl(R)salsolinol produces hydroxyl radicals:involvement to neurotoxicity[J].Free Radic Biol Med,1995,19(1):67-75.
[15]Naoi M,Maruyama W,Akao Y,et al.Apoptosis induced by an endogenous neurotoxin,N-methyl(R)salsolinol,in dopamine neurons[J].Toxicology,2000,153(1-3):123-141.
[16] Su Y,Duan J,Ying Z,et al.Increased vulnerability of parkin knock down PC12 cells to hydrogen peroxide toxicity:the role of salsolinol and NM-salsolinol[J].Neuroscience,2013,233:72-85.
[17]Zhang Y,Ma H,Xie B,et al.Alpha-synuclein overexpression induced mitochondrial damage by the generation of endogenous neurotoxins in PC12 cells[J].Neurosci Lett,2013,547:65-69.
[18]Maruyama W,Nakahara D,Ota M,et al.N-methylation of dopamine-derived 6,7-dihydroxy-1,2,3,4-tetrahydroisoquinoline,(R)-salsolinol,in rat brains:in vivo microdialysis study[J].J Neurochem,1992,59(2):395-400.
[19]Naoi M,Maruyama W,Matsubara K,et al.A neutral N-methyltransferase activity in the striatum determines the level of an endogenous MPP+-like neurotoxin,1,2-dimethyl-6,7-dihydroxyisoquinolinium ion,in the substantia nigra of human brains[J].Neurosci Lett,1997,235(1-2):81-84.
[20] Deng Y,Zhang Y,Duan J,et al.An overview of endogenous catechol-isoquinolines and their related enzymes:possible biomarkers for Parkinson’s disease[J].Curr Tran Geriatr Gerontol Rep,2012,1(2):59-67.
[21]张忠霞,马晓伟,顾平,等.年龄对MPTP作用于快速老化小鼠SAMP8环氧化酶2表达的影响[J].中国医科大学学报,2013,42(8):697-701.

