不同蛋白质摄入对慢性肾脏病3期患者肾功能的影响
王小琪 代文迪 刁宗礼 王丽妍 刘文虎
(首都医科大学附属北京友谊医院肾内科,北京100050)
慢性肾脏疾病(chronic kidney disease,CKD)作为严重危害全球公共健康的慢性病之一,具有发病率及致死率高、而知晓率和治疗率低的特点,常合并心血管、脑等重要靶器官损害,已成为继冠状动脉粥样硬化性心脏病(以下简称冠心病)、糖尿病之后的又一高发疾病。CKD患者的治疗强调全面的干预和综合性治疗,其中对于患者的营养管理也是治疗中重要的组成部分。目前对肾功能中度受损的CKD患者的每日的最佳蛋白质摄入量尚存争议,长期持续的低蛋白饮食似乎有利于这部分患者改善临床症状以及延缓患者肾功能进展,但常常对患者生活质量带来不利影响且依从性较差,长此以往还可能会增加营养不良的风险。从国内外已发表的报道[1-3]来看,大多数涉及蛋白质摄入的研究均将低蛋白饮食的摄入量锁定在0.6~0.8 g·kg-1·d-1范围内,目前尚无有效证据表明0.6 g·kg-1·d-1以下的超低蛋白质摄入可以为CKD患者带来收益。因此,本文采用回顾性研究方法主要分析不同蛋白质摄入量下对3期CKD患者肾功能进展的影响。
1 研究对象和方法
1.1 研究对象
采用回顾性研究方法,选取2013年1月至2015年5月在首都医科大学附属北京友谊医院肾内科CKD门诊长期规律随访的患者。
1)入选标准:年龄18~80岁,符合CKD诊断的CKD3期患者〔CKD诊断参见肾脏病预后生存质量指导(Dialysis Outcome Quality Initiatives,K/DOQI)[4]:血尿和(或)蛋白尿判定为尿检异常;根据肾脏病饮食改良(modification of diet in renal disease,MDRD)公式估算肾小球滤过率(estimated glomerular filtration rate,eGFR)值,判断肾功能分期〕,随访时间超过24个月。
2)排除标准:肾动脉狭窄、先天性肾脏畸形(孤立肾、马蹄肾等)、单肾缺如或无功能、急性肾衰竭、存在严重的其他脏器功能损害、肿瘤、消化道出血、免疫性疾病活动期;严重感染;正在服用糖皮质激素;孕妇或准备近期怀孕的妇女。
1.2 随访及分组
收集患者的一般资料,包括年龄、性别、身高、体质量、既往病史、吸烟史、握力、目前治疗等,并计算身体质量指数(body mass index,BMI),对所有患者进行规律随访,并根据指南予以规范治疗;每3个月评估1次患者营养状况,检测体质量、BMI、血清白蛋白,记录24 h饮食以计算每日蛋白质摄入量(dietary protein intake,DPI),并进行一次血及尿液检查,观察患者eGFR下降情况。随访过程中由首都医科大学附属北京友谊医院经培训的CKD专科门诊的医护人员进行资料的采集及数据整理。
根据患者多次测量的DPI值求得平均DPI,并按平均DPI水平将患者分为3组,极低蛋白饮食(very low protein diet,VLPD)组:DPI≤0.6 g·kg-1·d-1、低蛋白饮食(low protein diet,LPD)组:DPI在0.6~0.8 g·kg-1·d-1以及高蛋白饮食(normal protein diet,NPD)组:DPI>0.8 g·kg-1·d-1。
1.3 测量方法及检测指标
1)DPI测量:采用饮食回顾和记录法计算。患者每3个月进行1次24h的饮食记录,然后由一个在饮食回顾和计算营养物质摄入方面经过培训的肾内科医务人员进行统计和计算,得出患者每日蛋白质摄入量。取患者多次测量的DPI平均值,得出患者的平均DPI水平。
2)化验检查:取随访当日的空腹静脉血和晨尿为标本,检测项目包括:血常规、血生化(白蛋白、肌酐、尿素氮、总胆固醇、尿酸等)、尿肌酐、尿微量白蛋白。通过所测指标计算肾小球率过滤(eGFR)以及尿白蛋白/肌酐比值(ACR)。
计算公式:BMI=体质量(kg)/身高(m)2。ACR=尿微量白蛋白(mg/L)/尿肌酐(mmol/L)×8.84。MDRD 简化公式:eGFR〔mL·min-1·(1.73 m2)-1〕=175×〔肌酐(mg/dl)〕-1.234×〔年龄(岁)〕-0.179×性别(男性=1,女性=0.79)。
1.4 统计学方法
采用SPSS 16.0进行统计分析。服从正态分布的计量资料用均数±标准差(±s)表示,组间比较采用单因素方差分析和LSD检验方法。不服从正态分布的计量资料用中位数±四分位数间距(M±Q)表示,组间比较用Kruskal-Wallis秩和检验。重复测量资料用重复测量数据方差分析方法。计数资料用频数和百分数表示,组间比较采用行×列表卡方检验。以P<0.05为差异有统计学意义。
2 结果
2.1 患者一般资料
本研究统计的221例患者中,男性165例(74.7%),女性56例(25.3%),男女性别比例为2.95∶1,最小年龄30岁,最大年龄80岁,平均年龄(64.59±8.88)岁,其中极低蛋白饮食(VLPD)组61例,平均DPI为(0.44±0.03)g·kg-1·d-1,低蛋白饮食(LPD)组118人,平均DPI为(0.68±0.05)g·kg-1·d-1,高蛋白饮食(NPD)组42 例患者,平均 DPI为(0.88±0.08)g·kg-1·d-1,随访时间为24个月,详见表1。
表1 不同DPI分组下基线社会人口学指标Tab.1Basic demographics of different DPI groups〔±s,n(%)〕

表1 不同DPI分组下基线社会人口学指标Tab.1Basic demographics of different DPI groups〔±s,n(%)〕
DPI:dietary protein intake;VLPD:very low protein diet;LPD:low protein diet;NPD:normal protein diet;SH:smoking history;HT:hypertension;DM:diabetes mellitus history;BMI:body mass index;GS:grip strength.
Basic demographics VLPD(n=61) LPD(n=118) NPD(n=42) F/χ2P Age/a 65.08±7.75 64.80±9.13 63.29±9.59 0.577 0.563 Gender(male) 41(67.2) 90(76.3) 34(81.0) 2.829 0.243 SH 19(38.0) 40(45.5) 11(35.5) 1.282 0.527 HT 52(89.7) 102(88.7) 34(81.0) 2.034 0.362 DM 10(16.4) 22(18.6) 7(16.7) 2.476 0.646 BMI/(kg·m-2) 27.64±3.59 25.85±2.91 23.91±3.06 17.75 0.000 GS/kg 32.10±9.89 33.63±9.14 30.89±9.04 0.538 0.585
对基线数据进行分析后结果表明:不同DPI分组的CKD患者基线BMI水平不同,应用LSD检验进行组间比较,组间均数差异均有统计学意义,极低蛋白摄入组 BMI值最高,平均(27.64±3.59)kg/m2,高蛋白摄入组 BMI值最低,平均(23.91±3.06)kg/m2,低蛋白摄入组居中,平均为(25.85±2.91)kg/m2(P=0.000,表2)。此外,本研究发现各组患者原发病、化验室检查指标以及初始用药之间差异均无统计学意义(P>0.05),表明不同DPI分组下CKD患者原发病构成比、基线化验室检查指标以及初始用药情况构成比均相同,详见表3。
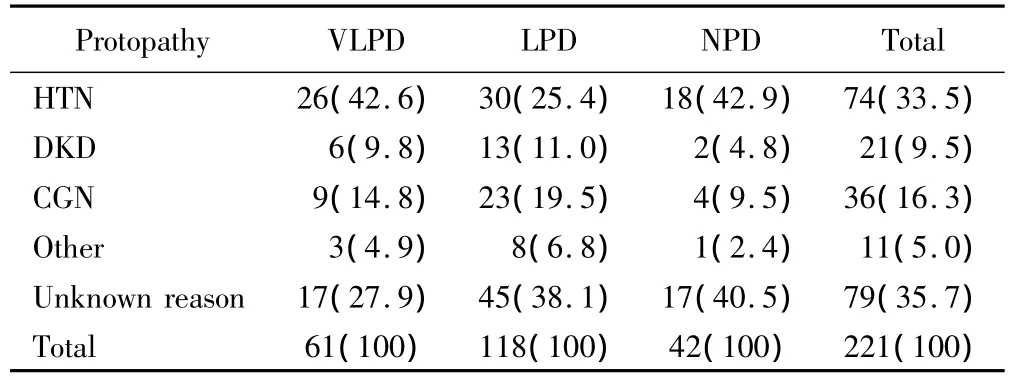
表2 不同DPI分组下CKD患者原发病情况Tab.2 Protopathy of different DPI groups n(%)
表3 不同DPI分组下基线检查指标Tab.3Baseline laboratory examination of different DPI groups(±s)

表3 不同DPI分组下基线检查指标Tab.3Baseline laboratory examination of different DPI groups(±s)
DPI:dietary protein intake;VLPD:very low protein diet;LPD:low protein diet;NPD:normal protein diet;Hb:hemoglobin;Alb:albumin;ALT:glutamic-pyruvic transaminase;Ca:serum calcium;P:serum phosphorus;CRP:C reactive protein;CHOL:serum cholesterol;LDL-C:low-density lipoprotein cholesterol;UA:uric acid;ACR:urinary albumin to creatinine ratio;eGFR:estimated glomerular filtration rate.No statistically significant difference was found between DPI groups in the baseline laboratory examination.
Examination VLPD(n=61) LPD(n=118) NPD(n=42) F/χ2P Hb/(g·L-1) 136.70±15.88 137.24±16.54 135.46±15.71 0.124 0.883 Alb/(g·L-1) 41.50±2.21 41.70±4.61 42.04±3.42 0.138 0.871 ALT/(U·L-1) 22.36±12.05 20.75±11.41 18.93±6.81 0.762 0.469 Ca/(mmol·L-1) 2.30±0.88 2.31±0.13 2.29±0.11 0.334 0.717 P/(mmol·L-1) 1.09±0.19 1.12±0.18 1.09±0.13 0.650 0.523 CRP/(mg·L-1) 3.22±3.17 2.48±2.51 2.50±3.08 0.828 0.439 CHOL/(mmol·L-1) 5.07±1.22 4.99±1.14 4.80±1.00 0.426 0.654 LDL-C/(mmol·L-1) 2.84±0.77 2.74±0.61 2.69±0.64 0.447 0.640 UA/(μmol·L-1) 418.58±99.59 379.41±107.97 388.14±71.67 1.940 0.148 ACR/(mg·g-1) 89.89±320.40 50.77±237.47 26.99±101.54 2.332 0.312 eGFR/〔mL·min-1·(1.73 m2)-1〕 42.69±7.34 44.40±8.34 45.13±8.21 0.147 0.257
2.2 不同DPI分组比较eGFR变化情况
3组CKD3期患者eGFR在基线水平下无明显差异;随着随访时间延长,VLPD组和NPD组CKD患者eGFR均较基线逐步下降,但至第24个月两组eGFR与基线相比差异无统计学意义(P=0.050,P=0.054),而至随访结束时,LPD组eGFR与基线相比无明显下降(P=0.538)。随访至第24个月,3组eGFR比较差异有统计学意义(F=3.441,P<0.05),组间比较示VLPD组eGFR较LPD组降低,差异存在统计学意义(P=0.024),NPD组eGFR较LPD组亦有降低,但差异无统计学意义(P=0.068),而VLPD组eGFR与NPD组相比差异无统计学意义(P=0.977),其余随访月份3组eGFR比较差异均无统计学意义,各月份组间两两比较差异亦无统计学意义(P>0.05),详见表4,图1。

表4 不同DPI分组下CKD患者基线用药情况Tab.4 Baseline medication of different DPI groups n(%)

图1 不同DPI组eGFR随时间的变化趋势Fig.1 Comparison each group of eGFR changes over time
3 讨论
目前,关于低蛋白饮食对CKD患者的残肾功能是否存在保护作用仍无定论。既往普遍认为低蛋白饮食在可以延缓CKD患者肾功能的恶化,但对于肾功能中度损害的患者何时开始低蛋白饮食以及限制程度均无定论。本研究回顾了CKD3期患者24个月的随访资料后发现,整个随访过程中LPD组eGFR水平与基线相比无明显下降,这提示适当降低DPI对CKD患者肾功能存在保护作用。这与郭全付等[1]、邵春海等[2]研究结果相似。另外一篇发表于2007年的涵盖7项研究共计1 400余例患者的荟萃分析[3]也认为降低DPI可以延缓进入透析时间。
本研究还发现,在随访过程中VLPD组及NPD组患者eGFR均较基线水平均有所下降(P=0.050,P=0.054),并且至第24个月,VLPD组eGFR水平与LPD组相比有降低,差异有统计学意义(P=0.024)。这提示对CKD3期患者而言,进一步降低DPI并不能进一步延缓残肾功能减退。而根据影响较大的MDRD研究[4]显示,对肾功能中度受损的患者而言,当CKD患者的平均DPI<0.28 g·kg-1·d-1时,不仅未带来肾脏保护作用,反而增加了患者的病死率(38.9%vs 23.3%)。
与本研究相反的,一些研究[5-6]表明CKD患者不同DPI水平对eGFR下降速度的影响无明显差异,推测可能的原因在于:①患者低蛋白饮食依从性差,使实际蛋白质摄入较目标值更高,导致组间DPI差异不明显。②目前CKD患者大多服用多种保护肾脏的药物,使得低蛋白饮食的肾脏保护作用被掩盖。
随着CKD病程的进展,患者多会出现不同程度的纳差、肠道功能减退、营养成分缺乏、激素水平失调、代谢性酸中毒、系统性微炎性反应状态、尿毒症毒素蓄积等情况,这些导致并加重了CKD患者的蛋白质分解代谢,造成骨骼肌蛋白质储备减低,称之为蛋白质-能量消耗(protein energy wasting,PEW)[7]。据统计,CKD患者 PEW的发病率很高,在我国约占20% ~50%,在发达国家约有18% ~75%。CKD患者合并PEW后将使机体长期处于负氮平衡,造成自身组织蛋白不断消耗,引起免疫力降低,感染高发,并加重酸中毒,从而导致肾功能恶化。除此之外,PEW还会造成CKD患者心、脑、肺、内分泌、骨骼肌等多系统及靶器官的损伤,最终使住院率和病死率增加,生存率下降[8-9]。在这种情况下,对CKD患者进行过度的蛋白摄入限制往往无法满足CKD患者的基本营养需要,可能会增加或加重患者PEW的发生。虽然目前众多指南均推荐CKD患者应采用低蛋白饮食,对于非透析的CKD患者多建议每日蛋白质摄入量在0.6 ~0.8 g/kg,并可酌情辅以 α-酮酸补充[10-13]。然而由于中国人与西方人饮食结构存在显著差异,加之出于各种原因往往难以及时、足量的补充α酮酸,我国CKD患者每日蛋白质摄入量本身即处在较低水平[14-15]。若医护人员在CKD患者日常管理中再强调严格的限制蛋白质摄入,势必会增加患者出现PEW的风险,反而不利于CKD患者预后。
另外,本研究还发现,不同DPI摄入组患者的基线BMI值存在明显差异,极低蛋白饮食组的BMI值最高,而正常蛋白饮食组BMI值最低,这可能是因为BMI值高的患者相对BMI值偏低的患者而言,主观上有更强烈的限制饮食的意愿,患者及家属对限制饮食蛋白质摄入的依从性更好。
本研究为回顾性研究,且样本量较小,仅涉及单中心,缺乏普遍代表性,仍需进行多中心、大样本的前瞻随机对照试验进一步验证本结果。
综上所述,对于CKD3期的患者而言,相比正常蛋白饮食(DPI>0.8 g·kg-1·d-1),适当地降低饮食中蛋白质摄入量(DPI为0.6~0.8 g·kg-1·d-1)对延缓肾功能进展可能有益,而极低蛋白饮食(DPI≤0.6 g·kg-1·d-1)与低蛋白饮食相比并不能进一步延缓eGFR下降速度,反而有可能会增加肾功能恶化的风险。
[1] 郭全付,毛焕东,乌新春,等.不同蛋白质饮食对慢性肾病患者肾功能的影响[J].西部医学,2015,27(2):190-195.
[2] 邵春海,朱云,刘静芳,等.低蛋白饮食对3/4期慢性肾脏病患者肾功能呢及营养状况的影响[J].中华临床营养杂志,2009,17(6):339-342.
[3] Fouque D,Aparicio M.Eleven reasons to control the protein intake of patients with chronic kidney disease[J].Nat Clin Pract Nephriol,2007,3(7):383-392.
[4] Menon V,Kopple J D,Wang X,et al.Effect of a very low-protein diet on outcomes:long-term follow-up of the Modification of Diet in Renal Disease(MDRD)Study[J].Am J Kidney Dis,2009,53(2):208-217.
[5] Cianciaruso B,Pota A,Bellizzi V,et al.Effect of a lowversus moderate-protein diet on progression of CKD:followup of randomized controlled trial[J].Am J Kidney Dis,2009,54(6):1052-1061.
[6] 代文迪,尹道鑫,崔文英,等.不同蛋白质摄入对进展期慢性肾脏病患者肾脏预后的影响[J].中华医学杂志,2014,94(4):256-259.
[7] Leinig C E,Moraes T,Ribeiro S,et al.Prediction value of malnutrition markers for mortality in peritoneal dialysis patients[J].J Ren Nutr,2011,21(2):176-183.
[8] Kovesdy C P,Kalantar-Zadeh K.Why is protein-energy wasting associated with mortality in chronic kidney disease?[J].Semin Nephrol,2009,29(1):3-14.
[9] Chan M,Kelly J,Batterham M,et al.Malnutrition(subjective global assessment)scores and serum albumin levels,but not body mass index values,at initiation of dialysis are independent predictors of mortality:a 10 year clinical cohort study[J].J Ren Nutr,2012,22(6):547-557.
[10] Greene J H.The new CKD nutrition practice guidelines[J].Nephrol News Issues,2011,25(4):22.
[11]秦春节.以消化道症状为首发的慢性肾功能衰竭38例误诊分析[J].临床误诊误治,2013,26(5):39-40.
[12]佐楠,冯江敏,王力宁.老年肾病综合征的临床表现与病理特点[J].中国医科大学学报,2014,43(2):178-180.
[13]王向杰,周英杰,刘键,等.非肾脏病科医生对慢性肾衰竭知晓率的调查研究[J].解放军医药杂志,2012,24(2):45-47.
[14]马路.肾脏病学科新进展与发展设想[J].解放军医药杂志,2013,25(3):1-5.
[15]王芊,华川.肾损伤标志物在糖尿病肾病早期诊断中的应用[J].解放军医药杂志,2012,24(2):56-58.

