镍(Ⅱ)配合物与DNA相互作用的研究*
胡喜兰,路 静,陆丹丹,施鹏飞,张珍明
(1淮海工学院化学工程学院,江苏连云港222005;2淮海工学院江苏省海洋资源开发研究院,江苏连云港222005)
苯妥英(5,5-Diphenylhydantion,简写为 Hpht)是治疗癫痫病的首选药物。作为生物配体,苯妥英是以N和O原子为配位原子,与过渡金属形成的配合物有着丰富的立体结构和生物活性[1-3]。镍是生命科学中极为重要的生命元素,是生物体内必需的痕量元素,在氢酶、甲基辅酶M还原酶、一氧化碳脱氢酶、超氧歧化酶和尿酶中均发现其活性中心含有镍离子[4-6]。因此,模拟合成生命体系中过渡金属与苯妥英配体形成的配合物对其结构和性能进行研究,对揭示金属酶的结构,开发疗效高、活性强、毒性小的新药具有重要的意义[7-10]。为此我们利用水热法,以苯妥英及1,2-丙二胺为配体与醋酸镍反应,合成得到了一个新颖的三元镍配合物[Ni(pht)2(pn)2][11],利用电子吸收光谱法、溴化乙锭荧光分析法以及粘度测定研究了此种配合物与DNA的相互作用,为进一步的研究打下了基础。
1 实验部分
1.1 仪器与试剂
配合物的元素分析由Perkin Elmer2400型元素分析仪测定;配合物的红外光谱由WGH-30/6型双光束红外分光光度计(KBr压片)测定;岛津UV-2550型紫外可见分光光度计;日立F4500型荧光光谱仪,激发波长为525nm,扫描速度15nm·s-1,在220nm~900nm测量发射荧光光谱。小牛胸腺(CT-DNA,生化试剂,sigma公司);三羟甲基氨基甲烷(分析纯,天津市福晨化学试剂厂);溴化乙锭(EB,生化试剂,Fluka公司);醋酸镍、1,2- 丙二胺、苯妥英、无水乙醇等均为分析纯试剂;实验用水为二次蒸馏水。
1.2 配合物的合成及表征
配合物按文献[11]进行合成,得到淡紫色的块状晶体,其熔点大于573K;产物按C36H42N8NiO4计算的理论值(%):C 60.94,H 5.97,N 15.79;元素分析的测定值(%):C 61.56,H 6.09,N 16.46。IR(KBr压片,cm-1):3346,3178,2960,2876,1629,1493,1450,1263,1122,961,759,698,603,533。该晶体几乎不溶于水、醇,稍溶于二甲基甲酰胺(DMF)。性质测定中配合物用少量DMF溶解后用Tris缓冲溶液定容至一定体积,备用。
1.3 配合物与DNA作用的紫外吸收光谱研究
分别往样品池与参比池中加入2mL Tris-HCl缓冲溶液 (CTris=50mmol·L-1,CNaCl=10mmol·L-1,pH=7.42),进行基线扫描,然后用2mL的DNA溶液取代样品池的缓冲溶液进行扫描,再依次往样品池和参比池中加入一定体积的配合物,每加一次扫描一次。
1.4 配合物对EB-DNA体系荧光强度的影响
在溶液中,EB(ethidium bromide)能平行的插入到双螺旋DNA结构的碱基之间而产生较强的荧光。然而,当EB被其他能插入到DNA双螺旋结构中的分子挤出来时,整个体系的荧光显著降低,因此可通过测定配合物对EB-DNA体系的荧光光谱的影响来研究配合物与DNA的作用。在EB-DNA体系(CEB/CDNA=0.5)中,每次加入一定体积的的配合物,以525nm为激发波长,在550nm~650nm波长区间记录每次配合物对EB-DNA体系的荧光强度变化。
1.5 配合物与DNA作用的粘度测定
粘度测量时,将温度恒定在(25±0.1)℃进行。测试液相对粘度按下列公式计算:η=(t-t0)/t0,其中t0为缓冲液流经毛细管所需的时间,t为DNA溶液(含浓度不等的配合物)流经毛细管所需的时间,η0为未加配合物时DNA溶液的相对粘度,以(η/η0)1/3对结合比率 r(r=CComplex/CDNA)作图,可以看到镍配合物对DNA粘度的影响。
2 结果与讨论
2.1 红外光谱表征
该配合物的红外光谱中在3346cm-1、3178cm-1附近的吸收峰为1,2-丙二胺上的N-H键上的N-H键伸缩振动吸收,在2960cm-1及2876cm-1分别为甲基和亚甲基的吸收,1629cm-1可以确认为苯妥英咪唑环上的羰基吸收峰,与配体苯妥英咪唑环上的羰基吸收峰相比较,蓝移了 90cm-1,1493cm-1、1450cm-1为苯环的骨架振动,1263cm-1为C-N的伸缩振动,1122cm-1、961cm-1是苯环的C-H面内弯曲振动,759cm-1、698cm-1为苯环C-H的面外弯曲振动,603cm-1、533cm-1的弱双峰可确认为 Ni-NH2和Ni-N键的伸缩振动,而在配体苯妥英红外光谱中没有此吸收,进一步说明了镍离子与氨基、苯妥英咪唑环上的氮原子形成了配位键。
2.2 配合物与CT-DNA作用的紫外光谱
从图1中可以发现在260nm左右,CT-DNA在反应前有一较强的吸收峰,这是典型的DNA分子中碱基的紫外吸收,配合物在此也有吸收,CT-DNA与该配合物反应之后(如图1),呈现了较明显的减色效应,当加入 440μL配合物(r=CComplex/CDNA=1.78)时,其减色率达到了8.56%,这可能是由于配合物插入到DNA碱基之间,配体的空π轨道与DNA碱基填有电子的π轨道发生耦合,使π→π*轨的能量下降导致跃迁几率减小而产生减色效应,可认为是配合物与DNA之间存在一种插入作用[12-15]。

图1 DNA在不同配合物浓度作用下的电子吸收光谱Fig.1 Absorption spectra of the DNA upon addition of the complex:1.0 ×10 -4mmol·L -1CT-DNA.r=0,0.32,0.81,1.78,2.75
2.3 配合物与EB-DNA体系的荧光光谱
从图2中其中可以看出在EB-DNA体系中随着配合物浓度的增大,即r(r=Ccomplex/CDNA)值的增大,EB-DNA的荧光强度逐步被猝灭,说明配合物与DNA作用后,将EB从EB-DNA复合物中挤出,由此推测配合物中的苯妥英配体可能与DNA发生了部分插入作用。图3中I0为EB-DNA的荧光强度,I为加入配合物后EB-DNA的荧光强度,从图3中可以看出当r>3.3时,体系的荧光强度减弱为50%,说明该配合物与DNA发生了插入结合作用[12-14],这与紫外吸收光谱分析所得的结果是一致的。
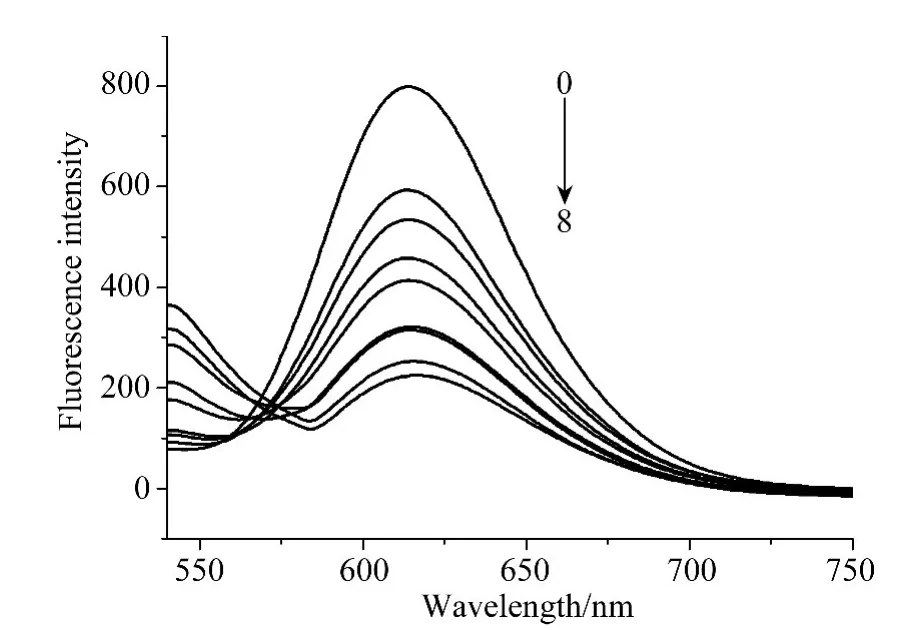
图2 配合物对EB-DNA体系的荧光光谱的影响Fig.2 Effects of the complex on the fluorescence spectra of EB-DNA system From top to bottom show the absorbance changing upon the increase in complex concentration,r:(0)0.79,(1)1.58,(2)2.37,(3)3.16,(4)3.95,(5)4.74,(6)5.53,(7)6.32,(8)7.11
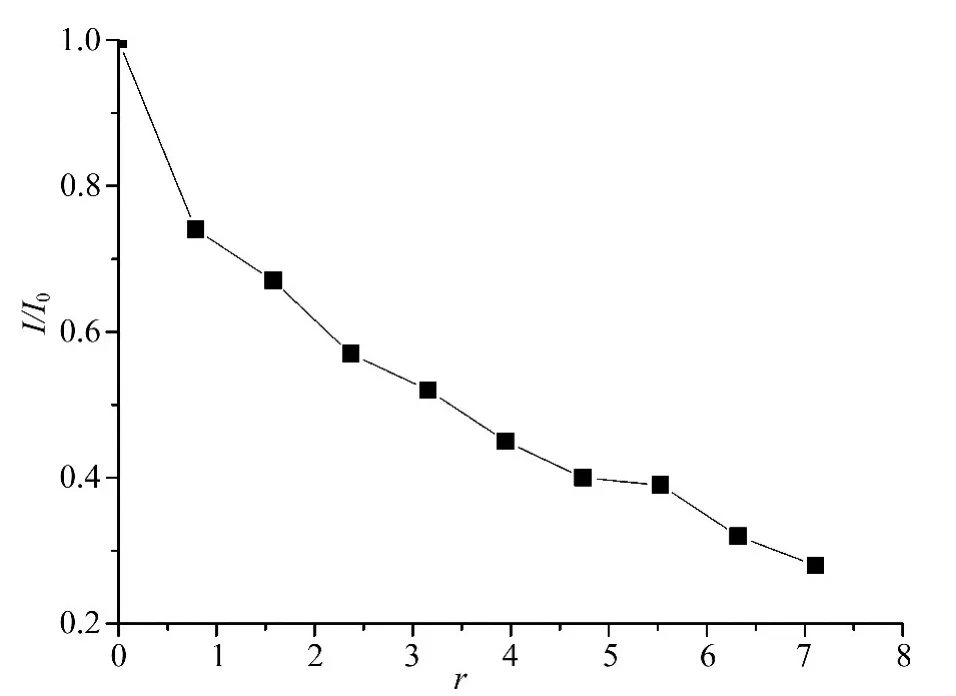
图3 配合物对EB-DNA体系的荧光猝灭Fig.3 Emission quenching of the complex to the EBDNA system plots of I0/I vs r for the titration of DNA with the complex;r:(0)0.79,(1)1.58,(2)2.37,(3)3.16,(4)3.95,(5)4.74,(6)5.53,(7)6.32,(8)7.11
2.4 配合物与DNA作用的粘度分析
粘度法一般认为是检测配合物与DNA结合方式的重要依据之一。从配合物与DNA作用的粘度(图4)判断该配合物是以插入方式与DNA相互作用的[12-14]。这一结果也与前面的紫外吸收光谱和荧光分析的结果相一致,进一步说明该配合物与DNA发生了插入结合作用。
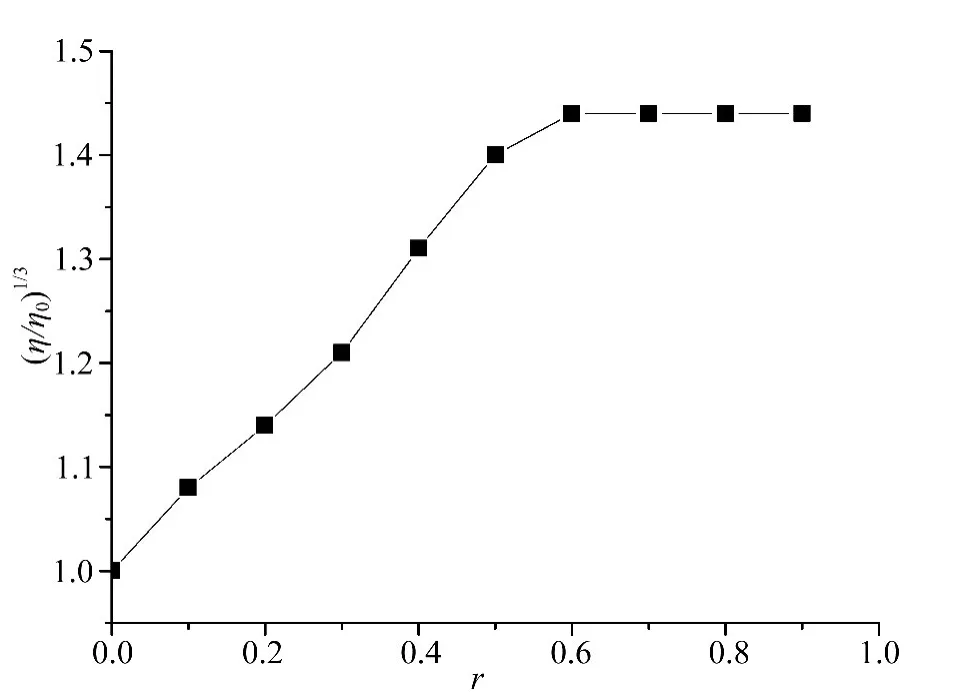
图4 DNA相对粘度随配合物加入量的变化Fig.4 Effects of increasing amounts of the complex on the relative viscosity of DNA
3 结论
三元配合物[Ni(pht)2(pn)2]可能是以插入方式与小牛胸腺DNA结合的。
[1]Nokhodchi A,Bolourtchian N,Dinarvand R.Crystal Modification of Phenytoin Using Different Solvents and Crystallization Conditions[J].Pharmaceutics,2003,250:85-97.
[2]Muhrer G,Meier U,Fusaro F,et al.Use of Compressed Gas Precipitation to Enhance the Dissolution Behavior of a Poorly Water-soluble Drug:Generation of Drug Microparticles and Drug-polymer Solid Dispersions[J].Inter.J.Pharmaceutics,2006,308:69-83.
[3]Milne P,Hô M,Weaver D F.Interaction of Anticonvulsant Drugs with Metals:a Semi-empirical Molecular Orbital Study of Phenytoin-zinc(Ⅱ)Complexation[J].Journal of Molecular Structure,1999,492:19-28.
[4]LU Z,CRABTREE R H.A Functional Modelling Study of the CO Oxidation Site of Nickel CO Dehydrogenase[J].J.Am.Chem.Soc,1995,117:3994-3998.
[5]DIXON N E,GAZZOLA C,BLAKELEY R L,et al.Jack bean urease(EC3,5,1,5)Metalloenzyme;Simple biological role for nickel[J].J.Am.Chem.Soc,1975,97:4131-4133.
[6]陈小华,刘世雄.[Ni(en)3]2+·H2dsh2-的合成和晶体结构[J].结构化学,2004,23(6):587-590.
[7]Hu Xi-Lan,Xu Xing-You,Xu T T,et al.(5,5-diphenylhydantoinato-кN3)[trisi(3-aminoprepyl)amine]copper(Ⅱ)5,5-diphenylhydantoinate Methanol Solvate[J].Acta Cryst,2006,E62:m2352-2353.
[8]Hu X L,Xu X Y,Xu T T,et al.Synthesis and Crystal Structure of A New Dinuclear Cu(Ⅱ)[J].Synth.React.Inorg.Metal-Org,2006,36:701-704.
[9]胡喜兰,许兴友,尹福军,等.Synthesis,Crystal Structure and Antimicrobial Study of a New Copper(Ⅱ)Complex[J]. 人工晶体学报,2008,37(6):1562-1566.
[10]胡喜兰,施鹏飞,许兴友,等.双核铜配合物[Cu(pht)2(ba)2]2的合成、晶体结构和抑菌活性[J]. 人工晶体学报,2009,38(5):1285-1289.
[11]Hu Xi-Lan,Xu Xing-You,Yin Fu-Jun,et al.trans-Bis(5,5-Diphenylhydantoinato-N3)Bis(1,2-propanediamine))Nickel(Ⅱ)[J].Acta Cryst,2008,E64:m1636.
[12]杨频,高飞.生物无机化学原理[M].北京:科学出版社,2002.
[13]胡喜兰,施鹏飞,许兴友,等.三核铜(Ⅰ/Ⅱ)配合物[Cu(en)2][Cu(pht)2]2的合成、晶体结构及与DNA相互作用的研究[J].化学学报,2009,67(21):2517-2522.
[14]胡喜兰,施鹏飞,许兴友,等.混价四核铜(Ⅰ/Ⅱ)配合物[Cu2L2][Cu(pht)2]2的合成、晶体结构及性质研究[J]. 化学学报,2009,68(6):487-492.

