乳酸杆菌对感染大肠杆菌小鼠肠黏膜免疫的影响
周晶,周颖,曹凤波,刘宾,霍贵成
(东北农业大学乳品科学教育部重点实验室,哈尔滨150030)
0 引言
大肠杆菌典型菌株O157:H7能够引起溶血性尿毒症、腹泻及出血性肠炎等疾病,危害人类健康[1]。肠道粘膜免疫系统是机体防御的重要防线,它能阻止病原微生物与肠上皮细胞的接触并通过抗原的刺激激发机体相应的免疫应答。病原菌入侵机体后,非特异性免疫系统被激活,病原菌被吞噬细胞识别吞噬,溶酶体将病原菌降解,进而激活T淋巴细胞等具有免疫功能的细胞,促使这些细胞分泌IL-2等细胞因子。细胞因子能够参与机体免疫应答,调节适应性免疫和固有免疫应答。sIgA是机体肠黏膜免疫系统重要的抗体之一,由sIgA参与的体液免疫是防御病原菌在肠黏膜定植的重要防线[2]。sIgA和细胞因子的质量浓度是研究肠道粘膜免疫反应的重要参考指标[3]。
乳酸杆菌能刺激肠粘膜免疫系统分泌sIgA等抗体及IL-6等细胞因子,对于大肠杆菌引起的腹泻起到预防和治疗的作用[4]。副干酪乳杆菌LAFTI L26能够促进IL-2等细胞因子的分泌,提高机体的免疫力[5]。本研究以副干酪乳杆菌KLDS1.0351和植物乳杆菌KLDS1.0986为目标益生菌,探究其对免疫的调节作用。
1 实验
1.1 材料与设备
菌种:副干酪乳杆菌KLDS1.0351,植物乳杆菌KLDS1.0985和 KLDS1.0986。大肠杆菌 O157:H7(Escherichia coli O157:H7 ATCC 43889)。
实验用小鼠:小鼠购买自哈兽研六周龄,等级为清洁级,体重约在20~25 g的雌性BALB/c小鼠;
试剂盒:小鼠sIgA,白细胞介素(IL-2、IL-6),IFN-γ ELISA试剂盒。
设备:高压灭菌锅HVE-50HIRAYAM,恒温培养箱,Model680型酶标仪,VD-1320洁净工作台。
1.2 方法
1.2.1 灌胃液的制备
将稳定期的副干酪乳杆菌、植物乳杆菌及大肠杆菌菌液6 000 rpm离心10 min,收集菌体无菌PBS洗涤两次,弃去上清液,用PBS悬浮并调节菌浓度至108cfu/mL,4 ℃保存备用[6-7]。
1.2.2 试验动物分组
试验将小鼠分为四组(空白组;大肠杆菌对照组;副干酪乳杆菌组;植物乳杆菌组),每天12∶00进行灌胃,灌胃体积为0.2 mL[8]。实验动物分组如表1所示。分别在第1,3,5,7,9,11,13,15 d 9∶00(提前进食)处死4组小鼠,每组3只,解剖取小肠组织。

表1 动物试验设计
1.2.3 小鼠外观及生长状况观察
试验期间观察小鼠的进食、毛色、精神状态、体重及粪便变化。
1.2.4 sIgA的测定
纵向剖开小肠,5 mL无菌的PBS冲洗小肠内容物,在4℃、10 000×g条件下离心10 min,收集上清液分装于离心管中,在-20℃下储存,待样品收集完后用sIgA ELISA试剂盒进行测定[9-10]。
1.2.5 细胞因子的测定
将小肠称重后按PBS∶小肠=9∶1的比例加入无菌PBS,用组织匀浆器将小肠破碎后倒入离心管中,在4℃(8 000 r/min)条件下离心10 min收集上清液并分装于离心管中,-20℃下储存,待样品收集完后用细胞因子ELISA试剂盒进行测定[11-12]。
1.2.6 数据处理
试验数据根据SPSS19.0统计软件和Excel进行相关性及方差分析并绘制图标,以0.05作为差异显著性判断标准。
2 结果与讨论
2.1 灌胃期间小鼠外观及体质量的变化
在灌胃期间观察小鼠的外观及体重变化。当小鼠的食欲降低、出现腹泻及毛色变得不柔顺没有光泽甚至出现掉毛现象时说明小鼠感染大肠杆菌模型建立成功。试验第4 d小鼠出现腹泻症状,精神萎靡,进食量减少,出现脱毛现象,说明大肠杆菌感染模型建立成功。从第8d补充两株乳酸杆菌后,小鼠的精神状态逐渐好转,进食量增加,腹泻症状逐渐缓解。灌胃期间小鼠体质量的变化如图1所示。
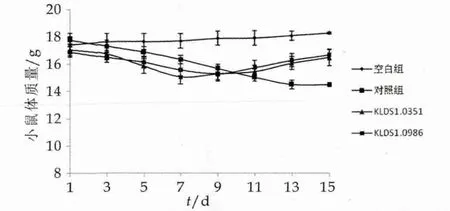
图1 两株乳酸杆菌对感染大肠杆菌O157:H7小鼠体质量的影响
由图1可以看出,在1~14 d的灌胃中空白组小鼠的体质量相对稳定,在1~7 d灌胃大肠杆菌的小鼠体质量呈下降的趋势,从第3天开始,灌胃大肠杆菌的三组小鼠体质量与空白组差异显著(P<0.05)。第8天对小鼠补充副干酪乳杆菌和植物乳杆菌后,从第9 d开始小鼠的体质量有所上升,虽然体重仍低于空白组和致病前的初始体质量,但与未补充大肠杆菌的对照组相比差异显著(P<0.05)。在灌胃两株乳酸杆菌后,小鼠的体质量有所增加,而对照组的小鼠体质量仍继续下降,这说明该两株乳酸杆菌对大肠杆菌引起的小鼠体质量减轻的症状能够起到一定的缓解作用;当在灌胃后的第15天对小鼠进行称量发现两株乳酸菌组小鼠的体质量之间并没有显著性差异,这说明两株乳酸杆菌对大肠杆菌引起的小鼠体质量减轻的缓解作用水平是相当的。
2.2 两株菌株对感染小鼠肠黏膜免疫的影响
2.2.1 对小鼠肠黏膜sIgA的影响
sIgA对致病菌在肠道的定植起到抑制作用,能与微生物等抗原结合形成抗原-抗体复合物[13-14],对维持机体肠道健康有着重要意义。小鼠在1~14 d灌胃中sIgA的变化如图2所示。
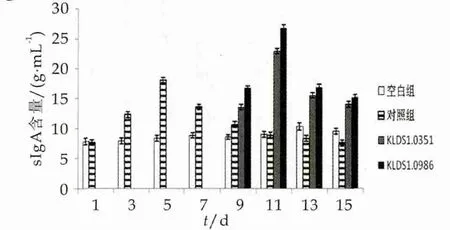
图2 两株乳酸杆菌对小鼠肠黏膜sIgA质量浓度的影响
由图2可知,空白组小鼠sIgA的质量浓度相对稳定;小鼠在感染大肠杆菌后sIgA的分泌量开始增加,并在第5 d达到最大值,从第7 d开始sIgA的分泌量减少,第11 d sIgA的质量浓度低于空白组,从第13 d开始与空白组差异显著(P<0.05);第8 d开始对小鼠分别补充副干酪乳杆菌和植物乳杆菌,从第9 d开始两株乳酸菌组sIgA的质量浓度上升,并且与空白组及对照组差异显著(P<0.05),当在第11 d达到最大值。两株乳酸菌引起肠粘膜中sIgA的质量浓度增加远高于大肠杆菌引起sIgA增加的最高水平。
2.2.2 对小鼠肠黏膜IFN-γ的影响
IFN-γ能够抑制IgE的分泌进而抑制由IgE引起的I型超敏反应[15],IFN-γ还可以激活NK细胞,是机体发挥免疫调节作用的重要细胞因子。小鼠在1~14 d灌胃中IFN-γ的变化如图3所示。

图3 两株乳酸杆菌对小鼠肠黏膜IFN-γ的影响
由图3可以看出,空白组小鼠IFN-γ的质量分数相对稳定,小鼠感染大肠杆菌后IFN-γ的质量分数增加,在第3 d达到最大值,之后降低,从第7 d开始低于对照组,在第15 d与空白组差异显著(P<0.05);在第8 d补充两株乳酸杆菌后,IFN-γ的质量分数增加,与空白组和对照组差异显著(P<0.05)。其中副干酪乳杆菌在第11 d达到最大值,之后下降,植物乳杆菌在第9 d达到最大值,之后开始下降。两株乳酸杆菌引起的IFN-γ的增加远高于小鼠感染大肠杆菌引起的IFN-γ增加的最大值。
2.2.3 对小鼠肠黏膜IL-2的影响
IL-2是由T细胞合成的,能够降低炎症作用,对由感染致病菌引起的免疫抑制起到一定的缓解作用[16]。小鼠在1~14 d灌胃中IL-2的变化如图4所示。
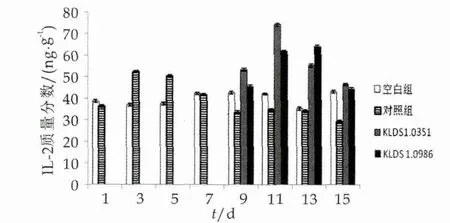
图4 两株乳酸杆菌对小鼠肠黏膜IL-2的影响
由图4可以看出,空白组小鼠IL-2质量分数相对较为稳定;对照组小鼠在灌胃大肠杆菌后IL-2质量分数增加,在第3天达到最大值,之后开始下降,第9天与空白组差异显著(P<0.05);第8天补充两株乳酸杆菌后,IL-2的质量分数在第9天开始增加,副干酪乳杆菌在第11天达到最大值,植物乳杆菌在第13天达到最大值;两株乳酸杆菌组IL-2的质量分数均显著高于空白组和对照组(P<0.05),在第15天时仍然与对照组和空白组差异显著(P<0.05)。
2.2.4 对小鼠肠粘膜IL-6的影响
IL-6能够参与NK细胞、T淋巴细胞活化,还能够促进淋巴细胞增殖。小鼠在1~14 d灌胃中IL-6的变化如图5所示。
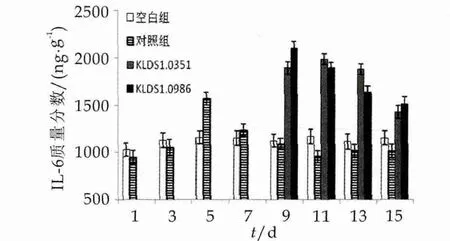
图5 两株乳酸杆菌对小鼠肠黏膜IL-6的影响
由图5右以看出,空白组IL-6质量分数较为稳定;灌胃大肠杆菌后,IL-6的质量分数增加并在第5天达到最大值,之后开始下降,从第9天开始小于对照组;在第8天对小鼠补充副干酪乳杆菌和植物乳杆菌后,IL-6的质量分数明显增加,并与对照组及空白组差异显著(P<0.05);植物乳杆菌和副干酪乳杆菌分别在第9天和第11天达到最大值,之后虽然有所下降,但均与对照组及空白组差异显著(P<0.05),且高于大肠杆菌引起的最大值。
2.3 讨论
对感染大肠杆菌的小鼠分别补充副干酪乳杆菌和植物乳杆菌后,小鼠的体质量有所上升,但仍较空白组低,说明乳酸杆菌对大肠杆菌引起的小鼠体重减轻有一定的延时性,如果长期服用效果可能会更好。小鼠在感染大肠杆菌初期sIgA及细胞因子的质量浓度上升,之后下降,这可能是由于大肠杆菌入侵后会刺激机体产生免疫反应,但随着大肠杆菌的不断入侵,小鼠肠黏膜免疫遭到破坏,抑制了细胞因子的分泌。补充两株乳酸杆菌后,sIgA及三种细胞因子的分泌量显著提高且都远远高于大肠杆菌引起的最大分泌量,由此我们猜测细胞因子及sIgA的分泌量是导致大肠杆菌对照组与两株乳酸杆菌组小鼠机体免疫反应差异的主要原因,乳酸杆菌可以调节肠粘膜中的细胞因子及sIgA的质量浓度进而对免疫机制进行调节,对机体感染大肠杆菌起到治疗的作用,这与相关研究也是吻合的[17]。
3 结论
副干酪乳杆菌KLDS1.0351和植物乳杆菌KLDS1.0986能对大肠杆菌感染引起的腹泻和体重减轻起到缓解的作用,两株菌株能显著促进感染大肠杆菌小鼠肠粘膜中IFN-γ,IL-2,IL-6及肠道中sIgA的分泌,并远远高于大肠杆菌刺激的最大值。
[1]KOOHMARAIE M,ARTHUR T M,BOSILEVAC J M,et al.Interventions to reduce/eliminate Escherichia coli O157:H7 in ground beef[J].Meat Science,2007,77(1):90-96.
[2]DIEBEL L N,LIBERATI D M,DULCHAVSKY S A,et al.Enterocyte apoptosis and barrier function are modulated by SIgA after exposure to bacteria and hypoxia/reoxygenation[J].Surgery.2003,134(4):574-580.
[3]JAIN S,Yadav H,SINHA PR.Probiotic dahi containing Lactobacillus casei protects against Salmonella enteritidis infection and modulates immune response in mice[J].Journal of Medicinal Food,2009,12(3):576-583.
[4]TSAI Y T,CHENG P C,PAN T M.The immunomodulatory effects of lactic acid bacteria for improving immune functions and benefits[J].Applied Microbiology And Biotechnology.2012,96(4):853-862.
[5]PATURI G,PHILLIPS M,Jones M,et al.Immune enhancing effects of Lactobacillus acidophilus LAFTI L10 and Lactobacillus paracasei LAFTI L26 in mice[J].International Journal Of Food Microbiology.2007,115(1):115-118.
[6]杜鹏,刘芳,霍贵成.离心条件对双歧杆菌存活力的影响[J].山东大学学报:理学版.2008,43(7):40-44.
[7]DOGI CA,GALDEANO CM,PERDIGO'N,et al.Gut immune stimulation by non pathogenic Gram(+)and Gram(-)bacteria.Comparison with a probiotic strain[J].Cytokine,2008,41(3):223-231.
[8]YANG H,LIU S,IBRAHIM SA,et al.Oral administration of live Bifidobacterium substrains isolated from healthy centenarians enhanced immune function in BALB/c mice[J].Nutrition Research,2009,29(4):281-289
[9]孟祥晨,霍贵成.双歧杆菌对正常小白鼠免疫调节及肠道菌群的影响[J].东北农业大学学报.2004,35(4):458-464.
[10]LEBLANC J,FLISS I,MATAR C.Induction of a humoral immune response following an Escherichia coli O157:H7 infection with an immunomodulatory peptidic fraction derived from Lactobacillus helveticus-fermented milk[J].Clinical And Diagnostic Laboratory Immunology.2004,11(6):1171-1181.
[11]SALVA S,VILLENA J,ALVAREZ S.Immunomodulatory activity of Lactobacillus rhamnosus strains isolated from goat milk:Impact on intestinal and respiratory infections[J].International Journal L Of Food Microbiology.2010,141(1-2):82-89.
[12]贾玉臣,陈庆森,王友湘,等.瑞士乳杆菌对小鼠肠道黏膜免疫应答及细胞因子的影响[J].食品科学.2010(23):335-339.
[13]DELCENSERIE V,MARTEL D,LAMOUREUX M,et al.Immunomodulatory effects of probiotics in the intestinal tract[J].Current Issues in Molecular Biology,2008,10(1/2):37-54.
[14]王友湘,陈庆森.益生菌和肠道粘膜免疫关系的研究进展[J].食品科学,2007,28(8):537-542
[15]STOBER H,MAIER E,SCHMIDT H.Protective effects of Lactobacilli,Bifidobacteria and Staphylococci on the infection of cultured HT29 cells with different enterohemorrhagic Escherichia coli serotypes are strain-specific[J].International Journal L Of Food Microbiology.2010,144(1):133-140.
[16]刘乃芝,陈静,崔诗法,等.不同浓度植物乳杆菌对肉鸡免疫机能的影响[J].吉林农业:学术版.2012(4):59-60.
[17]HOLSCHER H D,CZERKIES L A,CEKOLA P,et al.Bifidobacterium lactis Bb12 Enhances Intestinal Antibody Response in Formula-Fed Infants:A Randomized,Double-Blind,Controlled Trial[J].Journal Of Parenteral And Enteral Nutrition.2012,361:106S-117S.

