微小毛霉凝乳酶基因的定点突变及突变菌株的筛选
王茜,王昕,张杰,李倬林,李铁柱
(1.吉林大学生物与农业工程学院,长春130022;2.吉林省农业科学院农产品加工研究所,长春130124)
0 引言
干酪是我国乳制品工业新的增长点,凝乳酶是干酪产业的核心原料,其品质决定了干酪的品质。世界干酪生产中所使用凝乳酶约30%为微生物来源的基因工程凝乳酶[1-2]。
我国干酪生产所使用的高品质凝乳酶基本依赖进口,国产凝乳酶主要从小牛皱胃中获得,来源不稳定且成本较高。开发成本低、生产周期短的基因工程凝乳酶对于我国干酪产业的发展具有重要意义[3-5]。然而,微生物来源的基因工程凝乳酶普遍具有水解专一性差和热稳定性过高的缺陷[6-8]。
本研究针对前期构建的微小毛霉凝乳酶表达载体[9,10],依托计算机辅助分子模拟技术确定了突变位点Thr218(第218位苏氨酸)和Leu287(第287位亮氨酸)[11],通过生物工程技术实施分子改造,旨在获得更适于干酪加工的基因工程凝乳酶。
1 实验
1.1 材料
1.1.1 菌种及培养基
巴斯德毕赤酵母GS115,大肠杆菌DH5α,重组微小毛霉凝乳酶质粒由本实验室前期构建。
LLB培养基(胰蛋白胨1%,酵母浸提物0.5%,NaCl 0.5%,琼脂粉1.5%);YPD酵母培养基(酵母浸提物1%,蛋白胨2%,葡萄糖2%,琼脂粉2%)。均为质量分数,下同。
1.1.2 试剂和仪器
PrimeSTAR HS DNA Polymerase,限制性内切酶,DNA marker,其他试剂为国产分析纯。
1.2 方法
1.2.1 凝乳酶基因定点突变引物设计
微小毛霉凝乳酶基因定点突变方法采用PCR介导的一步法突变技术。根据PCR介导的一步法定点突变引物设计原则,利用primer5.0引物设计软件,设计 Thr218Ser(T218S)、Thr218Ala(T218A)、Leu287Gln(L287G)三对含预定突变的完全互补的寡核苷酸引物,送生工生物上海股份有限公司合成,如表1所示。

表1 定点突变所用引物
1.2.2 凝乳酶基因定点突变PCR反应
以实验室前期构建的重组微小毛霉凝乳酶质粒为模板,及PrimeSTAR HS DNA Polymerase高保真聚合酶,分别用3对引物对目的基因进行定点突变。PCR反应中各物质及含量如表2所示。

表2 PCR反应体系
表2中,PCR扩增条件为94℃预变性3 min;98 ℃变性10 s,68 ℃退伙延伸5 min;18次循环;72 ℃后延伸8 min。
本研究通过预实验来确定PCR反应中的模板DNA的质量浓度,以保证在PCR成功扩增的同时,模板质粒能被DpnI酶完全消化,提高突变效率。选择的模板质量浓度分别为20,30,40和50 μg/mL。PCR结束后取10 μL上样进行质量分数为1.0%琼脂糖凝胶电泳检测。
1.2.3 突变结果验证
采用宝生物公司的mix酶及微小毛霉凝乳酶基因通用引物α-Factor(TACTATTGCCAGCATTGCTGC)3`AOX1(GCAAATGGCATTCTGACATCC)进行突变质粒的扩增,质粒经EcoRI和NotI酶切后DNA电泳,完成PCR扩增目的基因和双酶切初步验证。
PCR扩增条件:94℃预变性5 min;然后94℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s;共进行31个循环;72℃后延伸10 min。双酶切及PCR鉴定结果正确的质粒,送生工生物上海股份有限公司进行序列测定。
1.2.4 重组子的筛选
质粒DNA的线性化有利于提高转化效率和与酵母基因组DNA组整合效率。SacI酶切后可与酵母基因组DNA发生单交换可提高转化拷贝数。设定质粒浓度梯度,来确保质粒DNA完全线性化。之后采用乙醇沉淀法将线性化的质粒浓缩后电转入毕赤酵母中,分别挑取平板上30个单克隆转化子,转接入15 mL YPD培养基中,30℃,200 r/min,培养30 h后,每隔24 h向培养基中加质量分数为100%甲醇至终质量分数为1%,连续诱导96 h。转速为10 000 r/min,离心1 min,取上清,得粗酶液。
筛选指标分别为凝乳酶水解活力(P),凝乳活力与水解活力比值(C/P比值)及热稳定性,具体测定方法如下:
凝乳活性(C)的测定:采用改进的MAGDA方法[12];
水解活力(P)的测定:采用中华人民共和国专业标准蛋白酶活力测定法SB/T10317-1999;
热稳定性的筛选方法:将待测样品分别放在45℃温度下保温120 min,每隔10 min取样,冰浴冷却,在35℃下测定微小毛霉凝乳酶的剩余凝乳酶活力;以相对凝乳活力(凝乳酶加热后与加热前活力比值)为纵坐标,以加热时间为横坐标,做改造前后凝乳酶热稳定性比较图。
2 结果
2.1 凝乳酶基因定点突变PCR反应
提取重组微小毛霉出发菌株质粒作为模板进行扩增。T218S,T218A,L287G的目的片段长1283bp,载体约3.6 kb,目的基因加载体总长度约4.9 kb,模板梯度稀释,突变扩增结果如图1所示。由图1可以看出,T218A模板质量浓度在20,30,40 μg/mL均扩增出清晰、明亮条带。T218S模板质量浓度在30 μg/mL和40 μg/mL扩增出条带清晰PCR产物。L287G模板质量浓度在40 μg/mL扩增出条带清晰明亮,无拖尾现象,与预期长度1283 bp相同,即为实验所需。结果表明,在这四个模板浓度范围内,三个突变PCR反应,均能得到所需PCR产物。随着模板浓度的增加,PCR产物的亮度也有所增加,显示产物的浓度也相继增加,但是,根据PCR扩增结果,同时为了保证突变的成功率,分别选择T218A模板质量浓度为20 μg/mL,T218S的模板质量浓度为30 μg/mL,L287G的模板质量浓度为40 μg/mL的PCR扩增产物用于DpnI酶切。

图1 不同模板浓度进行定点突变PCR的扩增结果
图1中,M为D15000 DNA分子量标准,1为模板质量浓度40 μg/mL,2为模板质量浓度30 μg/mL,3为模板质量浓度20 μg/mL,4为模板质量浓度10 μg/mL。取上述PCR产物和同PCR产物中含有相同模板浓度DNA(对照)经DpnI酶切作用,转入大肠肝菌DH5α,涂于含有zeocin的抗性LLB固体选择培养基,结果如图2所示。实验组T218A,T218S,L287G均出现转化子,对照组选择培养基上未出现转化子,证明DpnI酶对模板质粒已消除干净。

图2 DpnⅠ消化模板质粒转入大肠杆菌结果
2.2 突变结果验证
制备大肠杆菌DH5α感受态细胞,将PCR介导位点一步法突变得到的质粒转入大肠杆菌感受态细胞中,提取突变质粒,经PCR及双酶切(NotI,EcoRI)进行验证,结果如图3和图4所示。由图3和图4可以看出,扩增片段1,2,3大小约为1.3 kb,与微小毛霉凝乳酶基因片段大小相一致。酶切结果同样显示,1,2,3得到两条片段分别约为1.3 kb(目的片段)和3.6 kb(表达载体)。证明目的基因存在于扩增后的pPICZα A载体中。
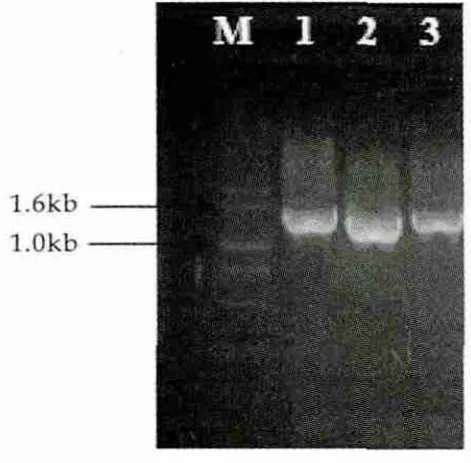
图3 PCR验证结果
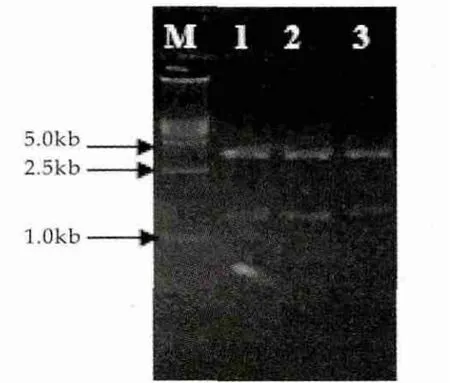
图4 双酶切验证结果
图3中,M为D2000 DNA分子量标准,1为T218A突变质粒,2为T218S突变质粒,3为L287G突变质粒。图4中,M为D15000 DNA分子量标准,1~3同图3。
将PCR、酶切鉴定后正确的质粒送至上海生物工程有限公司测序。利用DNAMAN分子生物学应用软件将测序结果与原始凝乳酶基因和Genebank上已登录的凝乳酶序列进行序列比对,结果如图5所示。由图5可以看出,218位Thr(ACC)突变为Ala(GCT)和Ser(TCC),287位Leu(CTT)突变为Gln(CAA),除突变位点氨基酸突变正确外,未发生额外突变,证明突变成功。

图5 基因突变测序结果
2.3 重组子的筛选
质粒梯度浓度线性化酶切后电泳结果如图6所示。由图6可以看出,质粒体积为6 μL和5 μL时,电泳结果显示出现两条条带,证明质粒DNA并没有完全线性化。当质粒体积为4 μL和3 μL时,酶切后电泳成单一条带,大小约为5.0 kb,质粒酶切完全,成线性条带,证明质粒DNA已经完全线性化。为了提高酵母转化的效率,所以选择质粒DNA体积4 μL,作为SacI酶切作用体积。并将酶切后呈线性化的质粒DNA,采用乙醇沉淀法浓缩法得到高浓度的线性化DNA,按照酵母电转化方法将浓缩的质粒转入毕赤酵母细胞中,涂于YPD(含zeocin)抗性平板,30℃静止培养4 d,如图7中结果表明转化效率较高,获得了较多的转化子。图6中,M为D15000 DNA分子量标准;3~6为质粒体积分别为3,4,5,6 μL电转化电泳结果。
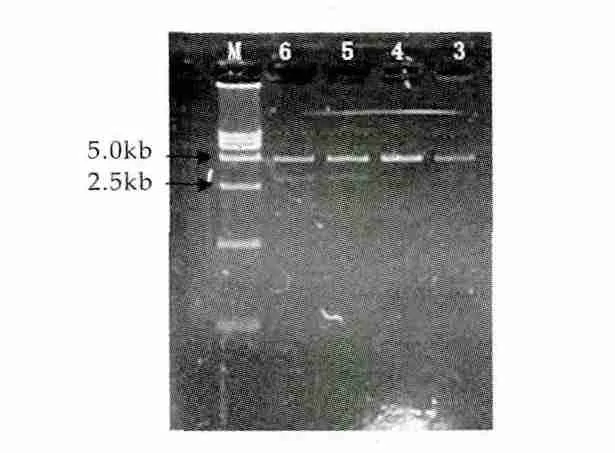
图6 不同浓度质粒线性化结果

图7 电击转化结果
2.3.1 凝乳酶酶学性质筛选
突变质粒T218A,T218S,L287G转化毕赤酵母GS115,经YPD培养基培养,随机挑取30个转化子,在YPD液体培养基中摇瓶发酵96 h,测定粗酶液凝乳酶活力,蛋白水解活力,计算C/P比值,最终获得上述参数优良的转化子各一株。结果如表3所示。
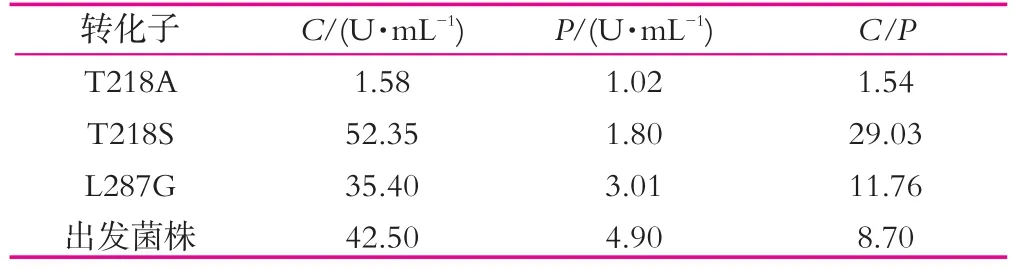
表3 突变菌株凝乳特性
由表3可以看出,T218A突变凝乳酶蛋白水解活性明显降低最为显著,但凝乳活性极低,不利于凝乳作用;T218S和L287G突变凝乳酶蛋白水解活性均有降低,同时二者的C/P比值均有提高,且T218S突变凝乳酶C/P比值提高幅度显著高于L287G突变凝乳酶。
2.3.2 凝乳酶热稳定性筛选
本研究将初筛C/P比值较高的T218S和L287G两个突变菌株凝乳酶进行热稳定性的复筛,结果如图8所示。由图8可以看出,T218S和L287G两个位点的突变,均使突变凝乳酶热稳定性降低,均低于出发菌株。相对于L287G位突变凝乳酶,T218S位突变凝乳酶具有更低的热稳定性。L287G位突变凝乳酶45℃处理60 min后,相对凝乳活力降到76.4%,经同样热处理,T218S位突变凝乳酶相对凝乳活力为62.0%。45℃热处理20 min后,T218S突变凝乳酶随着温度处理时间的增长,相对凝乳活力持续降低,60 min后,凝乳活力降低迅速,120 min达到约40%。由此可知,T218S突变菌株凝乳酶具有更低的热稳定性。
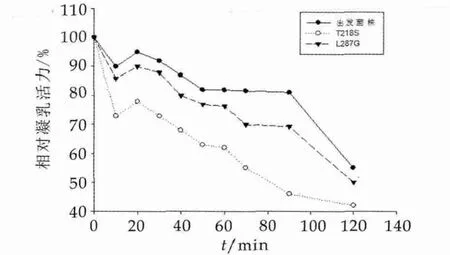
图8 45℃热处理改造前后微小毛霉凝乳酶的热稳定性
3 结论
本研究在前期研究的基础上了,设计了微小毛霉凝乳酶的分子改造方案,利用生物工程技术完成了改造工作。比较了改造前后凝乳酶的凝乳活力、蛋白水解活力及热稳定性,最终筛选到了突变体T218S一株,其凝乳活力、水解活力分别为52.35 U/mL和1.8 U/mL,C/P比值为29.03。相对于其他突变体及改造前微小毛霉凝乳酶,突变体T218S所产凝乳酶凝乳活性及C/P比值较高,热稳性较低,具有一定的应用前景。
[1]孟广震.凝乳酶研究进展[J].微生物学通报,1987,14(2):92-94.
[2]孙海蛟,吕敏,黄艾祥.我国干酪凝乳酶研究及应用现状[J].中国乳业,2008(5):50-52.
[3]WANG Y,CHENG Q,AHMED Z,et al.Purification and partial characterization of milk-clotting enzyme extracted from glutinous rice wine mash liquor[J].Korean Journal of Chemical Engineering,2009,26(5):1313-1318.
[4]YOUNG J W,WADESON A,GLOVER D J,et al.The extracellular acid protease of Yarrowia lipolytica:sequence and pH-regulated transcription[J].Microbiology,1996,142:2913-2921.
[5]YU P,CHOU C.Factors Affecting the Growth and Production of Milk-Clotting Enzyme by Amylomyces rouxii in Rice Liquid Medium[J].Food Technology and Biotechnology,2005,43(3):283-288.
[6]CLAUDIA M,MARIA L P,CRISTINA M,et al.Structural aspects of the Mucor bacilliformis proteinase,a new member of the aspartyl-proteinase family[J].Journal of Biotechnology,2006,123:443-452.
[7]PARK Y N,AIKAWA J,NISHIYAMA M,et al.Site-Directed Mutagenesis of Conserved Trp39 in Rhizomucor pusillus Pepsin:Possible Role of Trp39 in Maintaining Tyr75 in the Correct Orientation for Maximizing Catalytic Activity[J].The Japanese Biochemical Society,1997,121(1):118-121.
[8]AIKAWA J,PARK Y N,SUGIYAMA M,et al.Replacements of Amino Acid Residues at Subsites and Their Effects on the Catalytic Properties of Rhizomucor pusillus Pepsin,an Aspartic Proteinase from Rhizomucor pusillus[J].The Japanese Biochemical Society,2001,129(5):791-794.
[9]姜媛媛,王景会,李玉秋,等.微小毛霉凝乳酶基因的克隆与表达.中国乳品工业,2010,38(2):7-9.
[10]李玉秋,王景会,李铁柱,等.重组微小毛霉凝乳酶的发酵条件及其酶学性质.食品科学,2010,31(19):225-230.
[11]LI T,WANG J,LI Y,et al.Stucture of the complex between Mucor pusillus pepsin and the key domain of κ-casein for site-directed mutagenesis:a combined molecular modeling and docking approach[J].Journal of molecular modeling,2011,17(7):1661-1668.

