异体骨髓间充质干细胞对EAE大鼠神经再生保护作用的研究
何展文 刘木金 孟 哲 李平甘 罗向阳 李栋方 梁立阳
中山大学孙逸仙纪念医院儿科 广州 510120
炎症性脱髓鞘疾病是以神经髓鞘脱失为主要或始发病变的神经系统疾病,近来研究显示轴索损害和神经功能损伤同样参与其病理生理过程,而且可能是疾病后期导致持续不可逆神经功能障碍的主要原因[1-2]。如何能取得更满意的治疗效果,治疗上不仅需要免疫调节,更需要神经保护再生治疗。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)不仅具有免疫调节功能,而且具有多向分化能力,可分化成神经系统的神经元和神经胶质细胞,为细胞移植治疗炎症性脱髓鞘疾病开拓了新道路。本实验研究拟在实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)大鼠模型免疫后早期静脉输注BMSCs,观察输注后大鼠临床症状和神经功能变化,利用免疫组化方法检测神经元特异性烯醇化酶(NSE)、胶质纤维酸性蛋白(GFAP)、2’,3’-环腺苷酸-3’-磷酸二酯酶(CNPase)表达,观察移植后的BMSCs在EAE 大鼠体内存活、增殖、分化为神经元、星形胶质细胞和少突胶质细胞情况,了解BMSCs对EAE的神经再生的修复作用。
1 材料与方法
1.1 实验动物 健康雌性SD 大鼠,体质量190~220g,购自广东省医学动物实验中心,合格证号:广东省实验动物检测所合格证2008-0002号。本校北校区动物实验中心按SPF级饲养,环境温度25 ℃,湿度70%,适应性喂养1周,除实验时间外,可自由摄食和饮水。健康Wistar大鼠,200g左右,购自中山大学实验动物中心,合格证号:广东省实验动物检测所合格证2008-0562号。
1.2 主要实验材料 胎牛血清、DMEM 培养基购自美国HyClone公司,胰蛋白酶购置上海吉泰科技有限公司。FITC mouse IgG1 购 自BD pharmingen 公 司;Mouse anti-rat CD44、PE anti-rat CD3、PE mouse IgG1、PE anti-rat CD4、PE anti-rat CD8、PE anti-mouse/rat CD25 购 自Serotec 公 司;FITC anti-rat CD90、PE anti-rat CD106、PE anti-rat CD45、PE mouse IgG2a、PE anti-rat CD11b/c、PE Armenlan Hamster和PE anti-mouse/rat CD29 购 自Biolegend 公 司;CD34 PE 购 自Santa Cruz Biotechnology 公 司。MBP68-86(bs-0380p)购自北京博奥森生物技术有限公司。完全佐剂购自广州捷倍斯生物科技有限公司。百日咳疫苗购自河北石家庄伟天科学仪器设备有限公司。NSE 鼠多克隆抗体、GFAP鼠多克隆抗体、CNPase鼠多克隆抗体购自英国Abcam 公司。SA1022 兔IgG 试剂盒、SA1021 小 鼠IgG 试剂盒 和AR1022DAB显色试剂盒购自武汉博士德生物工程有限公司。
1.3 BMSCs的分离培养和表型鉴定 断颈处死Wistar大鼠,放置超净台上,剪开大鼠后肢皮肤,充分暴露剥离腿部肌肉,取出股骨和胫骨。剪去其两端骨骺,于10cm2培养皿内使用含10%胎牛血清的DMEM 培养液冲洗骨髓。用骨髓间质干细胞完全培养基反复吹打使之形成单细胞悬液,加入含10%胎牛血清的DMEM 培养液,接种于培养瓶中,37 ℃、5%CO2培养。贴壁3d后换液,每隔3d换液直至传代,待细胞80%~90%融合的时候传代,第4代(P4)用于实验。用0.25%胰蛋白酶消化收集细胞移入离心管中,1 100r/min离心4min,弃去上清。加PBS溶液重悬细胞,吸取100μL 细胞悬液(约3.0×105个细胞)加入EP管内。按量加入与PE或FITC标记的IgG1、CD34、CD44、CD45、CD11b/c、CD29、CD90、CD105单克隆抗体,避光孵育30min,上机检测。
1.4 方法
1.4.1 实验分组:SPF 级SD 大 鼠45 只,按体质量大小编号,随机分为3组,分别为EAE模型组、正常对照组、EAE模型BMSCs移植组。EAE模型组:每只大鼠用10%水合氯醛按体质量0.3mL/100g经腹腔注射麻醉至四肢松弛,75%酒精消毒足垫,四足垫皮下注射含有100μg(0.4 mL)的MBP68-86-CFA 混合免疫乳剂,免疫当日及2d后分别在两侧腹股沟皮下注射百日咳疫苗0.1mL(约1×109个菌体);免疫当天分别在尾静脉静注0.4mL等量生理盐水。以免疫当天为第0天。正常对照组:方法和步骤同上,但免疫诱导剂采用生理盐水制成的混合乳剂,注射后当日及2d后分别在两侧腹股沟皮下注射0.1 mL 生理盐水。EAE 模型BMSCs移植组:采用上述方法建立EAE 模型,免疫后第5天在尾静脉静注CFSE标记后BMSCs(4×106/只,0.4mL),大鼠共20只,随机分为4组,分别在移植后第7天、15天、21天及30天处死。
1.4.2 神经功能评价:免疫后所有动物每天称体质量并进行神经功能评分:0分:正常;1分:鼠尾张力障碍;2分:部分后肢瘫痪或步态不稳;3分:完全后肢瘫痪;4分:完全后肢瘫痪加部分或完全前肢瘫痪;5分:濒死状态或死亡;症状介于两条标准之间者用±0.5分表示。
1.4.3 免疫组织化学检测:各组大鼠按相应的时间点以10%水合氯醛腹腔注射麻醉后,用100mL 预冷的多聚甲醛经主动脉灌流至无血液流出时,小心取出脊髓及脑组织于10%福尔马林中保存。冠状位切取小段颈髓及部分脑组织,石蜡包埋,连续切片,片厚5μm。分别进行NSE、GFAP、CNPase免疫组织化学检测,观察输注后大鼠脑内及脊髓处的神经元、星形胶质细胞和少突胶质细胞的表达情况。组织切片置于二甲苯中浸泡10min,更换后再PBS浸泡10min;无水乙醇中浸泡5min;95%乙醇中浸泡5min;90%乙醇中浸泡5min;80%乙醇中浸泡5min;70%乙醇中浸泡5min;蒸馏水中浸泡5min。用3%H2O2,室温封闭10min,蒸馏水洗3次,PBS洗2次。滴加5%BSA 封闭液,室温20min,甩去多余液体。滴加NSE(1∶100)、GFAP(1∶4 000)和CNPase(1∶1 600)一抗,4℃过夜,PBS洗3次。滴加相应的生物素化二抗,37 ℃20min,PBS洗3次。滴加链霉素化亲和素试 剂,37 ℃20 min,PBS 洗4 次。DAB 显色试剂盒显色。苏木素复染2 min、饱和磷酸氢二钠分化。脱水、透明、封片。光学显微镜下观察,胞浆中有棕黄色颗粒的为阳性细胞。每张切片选择10个表达最强的视野,计数阳性细胞数后取平均值。
1.4.4 脑和脊髓的病理组织学检查:动物处死后,取脑室周围及脊髓腰膨大部位组织标本,石蜡包埋,切片5μm 厚,行HE染色和髓鞘染色,并在光镜下进行组织学评分,0:无炎症变化;1:炎症细胞浸润仅限于血管周围和脊膜周围;2:脊髓内轻微的炎症细胞浸润(1~10个细胞/片子);3:脊髓内中度的炎症细胞浸润(11~100个细胞/片子);4:脊髓内严重的炎症细胞浸润(>100个细胞/片子)。
1.5 统计学处理 所有数据均采用SPSS 16.0软件进行数据统计。计量资料采用均数±标准差(±s)表示。采用单因素方差分析,两两比较采用LSD-t法。检验水准α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 BMSCs分离培养与表型鉴定结果 原代培养的骨髓细胞接种第3天,部分贴壁生长,多呈长梭形、三角形和多角形,即为BMSCs;于第7~12天开始增长明显加快,具有一定的方向性,呈束状或放射状排列;第14天左右,单种细胞数量多,细胞贴壁率达90%。传代培养的BMSCs形态多为长梭形,较原代细胞体积增大,增殖速度加快,贴壁能力增强,约7d贴壁率达80%~90%。通过流式检测第4代Wistar大鼠BMSCs的表型,结果显示:强 表 达CD29、CD44 和CD90,少量表达CD34 和CD106,几乎不表达CD11b 和CD45。
2.2 BMSCs对EAE大鼠神经功能评分的影响 所有EAE模型大鼠未治疗时均出现不同程度的临床症状,表现为精神反应欠差,活动及进食减少,体质量下降,毛发疏松或脱毛,失去光泽,全身缩成一团,弓背,腹胀,尾巴无力,后肢、前肢、偏瘫或全身瘫痪,部分出现共济失调,濒死甚至死亡。我们在免疫后第5天静脉输注BMSCs,BMSCs移植组大鼠高峰期评分及整个病程的平均评分较EAE模型组显著降低(P<0.05)(表1),且发病时间延迟,发病率降低。
2.3 免疫组织化学检测 EAE 模型组和BMSCs移植组NSE阳性细胞较正常对照组明显减少,其中在移植后第15天和第21天减少最明显(P<0.05)。BMSCs移植组在第7天阳性细胞数较EAE 模型组表达水平增多,但并无显著性差异,而第15天、第21天和第30天NSE阳性细胞数明显高于EAE模型组的表达水平(P<0.05)(表2、图1)。各个时间点GFAP阳性细胞数无论是EAE 模型组还是BMSCs移植组,与正常对照组的表达水平并无显著性差异(表3、图2)。EAE模型组CNPase染色阳性细胞数较正常对照组明显减少(P<0.05)。BMSCs移植组在第7天阳性细胞数较正常对照组表达水平降低(P<0.05),随着时间迁移,BMSCs移植组CNPase染色阳性细胞数表达逐渐增加,各时间点CNPase染色阳性细胞数明显高于EAE 模型组的表达水平(P<0.05)(表4、图3)。
2.4 BMSCs对EAE脑脊髓病理检查的影响 脑脊髓病理检查示EAE组大鼠脑和脊髓内多处血管“袖套”样改变,表现为血管周围大量炎症细胞浸润,神经元变性,部分出现胶质细胞结节。BMSCs移植组与EAE 模型组比较,各时间点病理示炎症细胞浸润显著减少,脱髓鞘改变也显著减轻,神经元变性数目明显减少。

表1 各组大鼠神经功能评分
表2 不同时间大鼠脑组织切片NSE染色阳性细胞数比较 (±s,n=5)

表2 不同时间大鼠脑组织切片NSE染色阳性细胞数比较 (±s,n=5)
注:EAE group 比 较,* P <0.05,与Negative control group,△P<0.05
组别7d 15d 21d 30d EAE group 14.63±6.36△ 8.34±4.22△ 6.25±2.59△ 6.85±3.25△Negative control 24.37±4.12 BMSCs group 17.28±4.62 15.47±3.78△16.78±4.59*△18.41±4.25*

图1 NSE在大鼠脑中表达情况
表3 不同时间大鼠脑组织切片GFAP染色阳性细胞数比例 (±s,n=5)
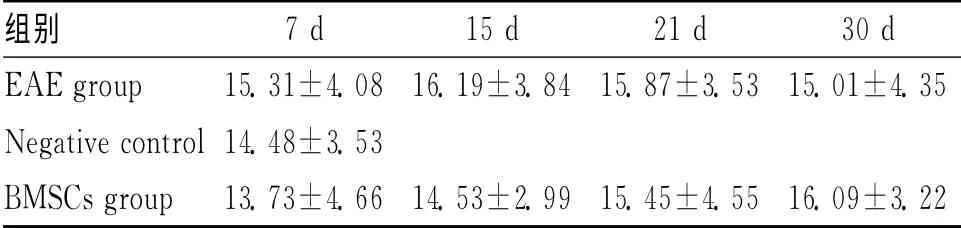
表3 不同时间大鼠脑组织切片GFAP染色阳性细胞数比例 (±s,n=5)
组别7d 15d 21d 30d EAE group 15.31±4.08 16.19±3.84 15.87±3.53 15.01±4.3 5 Negative control 14.48±3.53 BMSCs group 13.73±4.66 14.53±2.99 15.45±4.55 16.09±3.2 2

图2 GFAP在大鼠脑中表达情况
表4 不同时间大鼠脑组织切片CNPase染色阳性细胞数比较 (±s,n=5)

表4 不同时间大鼠脑组织切片CNPase染色阳性细胞数比较 (±s,n=5)
注:与EAE group 比 较,*P<0.05,与Negative control group比较,△P<0.05
组别7d 15d 21d 30d EAE group 10.66±4.53△ 11.87±4.0△ 10.27±3.97△ 12.47±3.29△Negative control 22.65±5.79 BMSCs group 16.35±4.74△ 19.25±3.95* 20.21±4.32* 25.43±5.04*

图3 CNPase在大鼠脑中表达情况
3 讨论
炎症性脱髓鞘疾病本身可能是炎症反应和神经退行性损伤的参与发病过程。炎症反应、髓鞘脱失和轴突损害是中枢神经系统炎症性脱髓鞘疾病三个重要病理改变。炎症反应导致脱髓鞘改变,炎症反应和髓鞘破坏损伤轴突,最终导致神经退行性损伤。目前对于炎症性脱髓鞘疾病主要是免疫调节治疗,但由于缺乏有效髓鞘再生机制,轴突损害或神经元不可逆的损伤,导致其治疗效果往往并不理想。近年来,不少神经病学学者致力研究脱髓鞘疾病神经损伤机制及如何促进神经保护再生,发现通过细胞生物治疗可以改善局部损伤微环境,从而促进髓鞘或神经再生,促进形成新的突触联系和信息传导恢复。
BMSCs作为骨髓造血干细胞的基质支持细胞,是一群多功能的干细胞,在特定的培养条件下分化为骨、脂肪、软骨和肌肉等结缔组织,也可分化成神经系统的神经元和神经胶质细胞。Priller等[3]在大鼠纹状体注射人BMSCs细胞,发现有20%移植的细胞能长时间在大鼠脑中存活并广泛分布于脑中,迁移路径和神经干细胞及星形细胞的迁移路径相同;同时移植后BMSCs失去BMSCs在培养中的典型特征而表现许多神经细胞的特征。Akiyama等[4]在脊髓损伤大鼠动物模型通过静脉输注BMSCs能显著改善脊髓损伤后髓鞘再生。同样Satake等[5]在脊髓横断损伤动物模型中鞘内注射BMSCs也能促进脊髓损伤后髓鞘再生和运动功能恢复。研究结果表明,BMSCs生物治疗有利于神经系统损伤疾病修复,显示出可观的神经再生可塑性。本实验在EAE 免疫后早期静脉输注CFSE标记的BMSCs,观察输注后大鼠神经功能变化及病变部位的标记细胞分布,利用免疫组化方法检测NSE、GFAP、CNPase表达,观察BMSCs移植后EAE 大鼠体内神经元(NSE)、星形胶质细胞(GFAP)和少突胶质细胞(CNPase)数量,了解BMSCs对EAE 的神经再生的修复作用及迁徙分化情况。
本实验中采用NSE、GFAP、CNPase抗体均为小鼠抗大鼠抗体,具有高度特异性,分别检测移植后不同时间点神经元、星形胶质细胞和少突胶质细胞表达情况,结果显示在EAE模型组,NSE 和CNPase的表达较正常对照组显著下降,提示在EAE模型中可能存在不同程度神经元和少突胶质细胞的损伤凋亡。目前研究显示在EAE 和MS的病灶内存在少突胶质细胞、神经元、小胶质细胞、巨噬细胞等多种细胞的凋亡,并在疾病的发病和病情发展中有重要的作用[6]。少突胶质细胞是髓鞘形成细胞,具有形成和修复髓鞘的能力,影响轴突的生长、结构以及功能。少突胶质细胞的凋亡影响髓鞘的结构和功能,引起髓鞘脱失,继发或加重轴突的损伤[7]。
研究显示,BMSCs植入实验动物体内后具有增殖、迁徙和分化的能力,可调节EAE 大鼠的免疫紊乱并分化为髓鞘形成细胞,刺激髓鞘再生,促进神经功能修复。关于BMSCs在炎症性脱髓鞘疾病中神经再生保护的机制尚未完全阐明,目前认为可能与下列几种因素有关:(1)BMSCs植入体内能向损伤处迁徙并向神经元、神经胶质细胞分化并替代死亡的宿主细胞,与局部残存的细胞重新建立联系,恢复神经元回路[8-9]。(2)BMSCs可分泌多种细胞因子及神经生长因子,改善局部微环境并启动再生相关基因的表达,促进轴突功能的再生[10-11]。Bianco等[12]将BMSCs植入动物体内后,可导致IL-6、IL-7、IL-12和脑源性神经营养因子(BDNF)等多种细胞因子分泌增多,这些细胞因子对神经损伤修复起重要作用,同样可能对免疫调控起一定作用。(3)BMSCs能够抑制神经元的凋亡,并使残存的脱髓鞘的神经纤维和新生的神经纤维髓鞘化,从而恢复神经结构的完整性[8,13-14]。
综上,预防给予BMSCs可以明显改善EAE大鼠神经缺损症状及缩短病程,可能机制是通过免疫调节,抑制免疫反应所致的神经细胞损伤,减少神经元和少突胶质细胞的凋亡,从而发挥神经保护作用,但不能排除仍有部分BMSCs在局部微环境信号的诱导下向脱髓鞘区迁徙并分化为髓鞘形成细胞的可能。本研究为BMSCs在临床上炎症性脱髓鞘疾病治疗提供了理论依据。
[1]Evangelou N,Konz D,Esiri MM,et al.Regional axonal loss in the corpus callosum correlates with cerebral white matter lesion volume and distribution in multiple sclerosis[J].Brain,2000,123(part9):1 845-1 849.
[2]Bitsch A,Schuchardt J,Bunkowski S,et al.Acute axonal injury in multiple sclerosis:correlation with demyelination and inflammation[J].Brain,2000,123(part 6):1 174-1 183.
[3]Priller J,Persons DA,Klett FF,et al.Neogenesis of cerebel-lar purkinje neurons from gene-marked bone marrow cells in vivo[J].J Cell Biol,2001,155(5):733-738.
[4]Akiyama Y,Radtke C,Honmou O,et al.Remyelination of the spinal cord following intravenous delivery of bone marrow cells[J].Glia,2002,39(3):229-236.
[5]Satake K,Lou J,Lenke LG.Migration of mesenchymal stem cells through cerebrospinaluid into injured spinal cord tissue[J].Spine,2004,29(18):1 971-1 979.
[6]Zipp F.Apoptosis in multiple sclerosis[J].Cell Tissue Res,2000,301(1):163-171.
[7]Baumann N,Pham-Dinh D.Biology of oligodendrocyte and myelin in the mammalian central nervous system[J].Physiol Rev,2001,81(2):871-927.
[8]Chen J,Li Y,Katakowski M,et al.Intravenous bone marrow stromal cell therapy reduces apoptosis and promotes endogenous cell proliferation after stroke in female rat[J].J neurosci res,2003,73(6):778-786.
[9]Munoz JR,Stoutenger BR,Robinson AP,et al.Human stem/progenitor cells from bone marrow promote neurogenesis of endogenous neural stem cells in the hippocampus of mice[J].Proc Natl Acad Sci USA,2005,102(50):18 171-18 176.
[10]Caplan AI,Dennis JE.Mesenchymal stem cells as trophic mediators[J].J cellular biochem,2006,98(5):1 076-1 084.
[11]Li Y,Chen J,Chen XG,et al.Human marrow stromal cell therapy for stroke in rat:Neurotrophins and functional recovery[J].Neurology,2002,59(4):514-523.
[12]Bianco P,Riminucci M,Gronthos S,et al.Bone marrow stromal stem cells:nature,biology and potential applications[J].Stem Cells,2001,19(3):180-192.
[13]Scuteri A,Cassetti A,Tredici G.Adult mesenchymal stem cells rescue dorsal root ganglia neurons from dying[J].Brain Res,2006,1116(1):75-81.
[14]Crigler L,Robey RC,Asawachaicharn A,et al.Human mesenchymal stem cell subpopulations express a variety of neuroregulatory molecules and promote neuronal cell survival and neurogenesis[J].Exp Neurol,2006,198(1):54-64.

