营养缺乏自噬因子1对人脑胶质瘤U251细胞增殖侵袭能力的影响
作者单位:315000 宁波,宁波明州医院神经外科(江汉清);510630 广州,中山大学附属第三医院(罗仑,梁朝峰)
营养缺乏自噬因子1对人脑胶质瘤U251细胞增殖侵袭能力的影响
江汉清罗仑梁朝峰
【摘要】目的探讨营养缺乏自噬因子1对人脑胶质瘤U251细胞增殖侵袭能力的影响。 方法 复苏培养人脑胶质瘤U251细胞,建立转染小干扰RNA(siRNA)的NAF1组(si-NAF1组)、阴性对照组(si-NC组)、未转染siRNA对照组(control组),采用CCK-8实验检测细胞增殖能力、平板克隆形成实验检测细胞克隆形成能力、细胞划痕实验检测各组细胞迁移能力、Transwell法观察各组细胞侵袭能力变化。结果与control组比较,NAF1-siRNA干预U251细胞后,si-NAF1组NAF1的mRNA和蛋白表达水平均明显降低(P均<0.05),其增殖细胞核抗原(PCNA)、基质金属蛋白酶-9(MMP-9)蛋白表达水平降低,细胞增殖能力下降,克隆形成能力明显减弱,迁移能力明显降低,穿过Transwell膜的细胞数量明显减少(P均<0.05)。si-NC组与control组各项结果比较差异无统计学意义(P>0.05)。结论转染siRNA后NAF1表达下降,进而下调PCNA水平,抑制人脑胶质瘤U251细胞的增殖能力;同时MMP-9蛋白表达水平下降,抑制U251细胞的迁移和侵袭能力。
【关键词】脑胶质瘤;RNA干扰;细胞增殖;肿瘤侵袭
DOI:10.3969/g.issn.0253-9802.2015.02.004
通讯作者,梁朝峰,E-mail:lcfjeff@163.com
收稿日期:(2014-10-09)
Influence of nutrient-deprivation autophagy factor-1 on the proliferation and invasion of human glioma cell line U251JiangHanqing,LuoLun,LiangChaofeng.DepartmentofNeurosurgery,NingboMingzhouHospital,Ningbo315000,China
Correspondingauthor,LiangChaofeng,E-mail:lcfjeff@163.com
Abstract【】ObjectiveTo investigate the effect of nutrient-deprivation autophagy factor-1 (NAF1) upon the proliferation and invasion of human glioma cell line U251. MethodsResuscitation of human glioma cell line U251 was conducted. The cultured U251 cells were divided into the si-NAF1, si-NC and control groups. CCK-8 assay was performed to assess the proliferation of U251 cells. Plate cloning formation assay was utilized to evaluate the formation of cell cloning. Wound healing assay was conducted to investigate the migration of U251 cells. Changes in the migration of U251 cells were determined by Transwell invasion assay. ResultsThe expression of NAF1 in U251 cells transfected with NAF1-siRNA at both protein and RNA levels was significantly down-regulated compared with those in si-NC and control groups (both P<0.05). The protein expression of proliferating cell nuclear antigen (PCNA) and matrix metalloprotein-9 (MMP-9) was significantly down-regulated. The proliferation, formation of cell cloning and migration of U251 cells in the si-NAF1 group were obviously suppressed, and the count of U215 cells trespassing the Transwell membrane was significantly decreased compared with those in the control group (all P<0.05). There was no statistically significant difference between Si-NC group and the control group in above indexes(P>0.05). ConclusionsAfter transfection with siRNA, the expression of NAF1 was decreased, thereby down-regulating the expression of PCNA and inhibiting the proliferation of U251 cells. Down-regulated expression level of MMP-9 protein suppressed the proliferation and migration of U251 cells.
【Key words】Glioma; RNA interference; Cell proliferation; Neoplasm invasion
脑胶质瘤是最常见的中枢神经系统恶性肿瘤[1]。脑胶质瘤的手术、放射治疗、化学治疗等治疗方法在不断改进,但其疗效仍然未得到明显提高,患者预后较差,中位生存期仅13个月左右[2-3]。阐明脑胶质瘤生存过程中导致增殖和侵袭的机制,有利于发现新的治疗策略[4]。因此,寻找和研究在脑胶质瘤的生物学过程中的关键分子具有重要的科学意义和临床应用价值。营养缺乏自噬因子1(NAF1)基因定位于人4号染色体长臂,是一种新发现的、与细胞能量代谢和增殖凋亡相关的蛋白[5]。近年研究表明,其表达与乳腺癌等多种恶性肿瘤的增殖、侵袭密切相关[6]。已证实其可能通过核因子-κB、Wnt等信号通路影响多种细胞和功能蛋白的表达[7]。该基因有望成为包括人脑胶质瘤在内的多种肿瘤治疗靶点[8]。目前,NAF1对人脑胶质瘤细胞增殖、侵袭的作用及其影响机制尚不明确[9]。为此,本研究采用针对NAF1的小干扰RNA(NAF1-siRNA)转染人脑胶质瘤U251细胞,观察其对NAF1基因的沉默作用,并进一步探讨其对人脑胶质瘤细胞增殖和侵袭能力的影响,现报告如下。
材料与方法
一、实验材料
人脑胶质瘤细胞株U251由中山大学附属第三医院神经外科实验室冻存。
二、主要试剂和仪器
主要试剂有DMEM高糖培养基,胎牛血清(FBS)、胰酶、磷酸盐缓冲液(PBS)、Trizol液、脂质体2000( LipofectamineTM2000)购自美国Invitrogen公司;CCK(cell counting kit)-8试剂盒购自日本同仁公司;RT-PCR引物采用Primer 3软件设计,由Invitrogen公司合成。实时荧光定量PCR试剂盒购自日本Takara公司。兔抗人NAF1抗体、β-actin抗体购自美国BD公司。辣根过氧化物酶标记的山羊抗兔IgG二抗、蛋白免疫印迹显色试剂盒、插入小干扰RNA的NAF1(NAF1-siRNA)、不表达NAF1的阴性对照siRNA(NC-siRNA)购自广州安邦生物科技有限公司。主要仪器包括细胞培养箱(美国Kendro公司)、倒置显微镜(日本Olympus公司)、酶标仪(美国Molecular Devices公司)、Labcycler48 PCR仪(德国 SensoQuest公司)和Mini-PROTEAN3 蛋白免疫印迹电泳系统(美国 Bio-Rad公司)。
三、实验方法
1. 细胞培养和siRNA转染
复苏培养人脑胶质瘤细胞株U251。以含有10%胎牛血清的DMEM高糖培养基作为培养基,常规培养。细胞融合度达60%时,采用转染试剂(脂质体2000)和NAF1-siRNA、NC-siRNA,按照试剂盒说明书,分别作为si-NAF1、si-NC组转染培养48 h。同时设立未转染空白对照组(control组)。每组设3个复孔,重复3次实验后取平均值。
2. NAF1 mRNA表达水平检测
Trizol法提取各组U251细胞的总RNA,逆转录合成模板DNA。采用荧光实时定量PCR法检测NAF1 mRNA表达水平。引物序列:NAF1上游5’-ATCATCATGTTCAATGCTTTTCT-3’,下游5’-TCAA-TGGCATCAGGGCTTCAC-3’,长度173 bp;内参照GAPDH上游5’-CAACGAATTTGGCTACAGCA-3’,下游5’-AGGGGTCTACATGGCAACTG-3’,长度432 bp。PCR反应条件:92℃ 30 s,92℃ 6 s,61℃ 35 s,共50个循环,循环延伸末端收集荧光信号,2-ΔΔCt法分析结果[10]。
3. NAF1 、增殖细胞核抗原、基质金属蛋白酶-9的蛋白表达强度检测
U251细胞转染后48 h,收集细胞,提取蛋白,使用蛋白免疫印迹法分析NAF1、增殖细胞核抗原(PCNA)、基质金属蛋白酶-9(MMP-9)和内参照GAPDH的蛋白表达强度[11]。
4. U251细胞增殖能力检测
采用CCK-8法检测细胞增殖能力。取对数生长期U251细胞,3×103/孔接种于96孔板,每组设3个复孔。培养12 h后分组转染。细胞转染后设24、48、72 h时间点,更换无血清培养基,按照试剂盒说明书加入12 μl CCK-8试剂[12]。37 ℃温箱孵育2 h。用酶标仪测定450 nm处吸光度值。
5. U251细胞克隆形成能力检测
采用平板克隆形成实验检测细胞克隆形成能力。取24、48、72 h时间点的各组U251细胞制备单细胞悬液,调整细胞密度,分别取500个细胞接种于6孔板中,慢速晃动培养10 min,使细胞分散均匀。于培养箱中静置培养10 d,弃去培养液,多聚甲醛固定后1%结晶紫染色[13]。光镜下计数细胞克隆数,设定细胞数大于20个为1个克隆,并计算克隆形成率,计算公式为:克隆形成率= (克隆形成数/接种细胞总数)×100%。
6. U251细胞迁移能力检测
分组转染U251细胞后分别接种于6孔板。培养至约60%融合度时进行划痕。PBS冲洗3次去除漂浮细胞[14]。加入无血清培养基继续培养12 h后拍照,以细胞迁移距离代表细胞的迁移能力。
7. U251细胞侵袭能力检测
Transwell小室上室加入40 μl稀释后的Matrigel基质胶,37℃孵育2 h凝固。分组转染后的细胞接种入小室上室。下室加入400 μl含血清完全培养基。常规培养24 h后取出小室,去除未过膜细胞后甲醇固定。1%结晶紫染色,显微镜下拍照,以穿过小孔的细胞数量表示细胞的侵袭能力。
四、统计学处理
结果
一、 siRNA干扰对U251细胞NAF1 mRNA表达的影响
si-NAF1组NAF1 mRNA表达水平为control组的3.5%,为3组中最低(F=38.72,P<0.05),即干扰效率达到96.5%,si-NAF1组与control组比较差异有统计学意义(t=20.38,P<0.05);而si-NC组与control组比较差异无统计学意义(t=0.36,P>0.05),说明NAF1-siRNA的基因沉默效果明显,见图1。

图1 3组U251细胞NAF1 mRNA表达水平的比较
二、siRNA干扰对NAF1、PCNA、MMP-9蛋白表达的影响
与control组比较,si-NAF1组NAF1、PCNA、MMP-9蛋白的表达强度均明显降低(t分别为32.75、26.88、21.42,P均<0.05),而si-NC组与control组之间的NAF1、PCNA、MMP-9蛋白表达强度比较差异无统计学意义(P均>0.05),见图2。
三、siRNA干扰对细胞生长曲线的影响
si-NAF1组U251细胞在24、48、72 h时吸光度值均明显著低于control组 (t值分别为18.65、23.60、35.92,P均<0.05);且细胞增殖能力的差异随着时间的变化逐渐明显。而各时间点si-NC组与control组比较差异无统计学意义(P均>0.05),见图3。

图23组U251细胞中NAF1、PCNA、MMP-9蛋白表达强度的比较
A:蛋白免疫印迹照片;B:定量分析结果,与control组比较,*P<0.05
四、siRNA干扰对细胞克隆形成能力的影响
各时间点si-NAF1组细胞的平板克隆形成率明显低于si-NC组与control组(F=45.77,P<0.05),而对照组与si-NC组比较差异无统计学意义(t=0.341,P>0.05),见图4。
五、siRNA干扰对细胞迁移能力的影响
划痕12h后,control组和si-NC组的迁移能力未受到明显抑制,细胞表现出相似的迁移能力。si-NAF1组细胞在划痕12h时迁移明显受限;与control组比较,si-NAF1组的迁移距离缩短,见图5。

图3 3组 U251细胞生长曲线的比较
六、siRNA对细胞侵袭能力的影响
培养24h后,si-NAF1组呈蓝紫色的穿膜细胞数明显少于对照组,而si-NC组与control组之间的差异不明显,见图6。
讨论
NAF1蛋白是结合毒性铁硫簇的NEET家族成员,与细胞的能量代谢有关[6]。近年研究发现,NAF-1可与凋亡相关蛋白Bcl-2/Bcl-XL结合配体发挥作用,调节细胞的自噬和凋亡,并在体内通过调节细胞营养和氧化应激从而影响细胞的生存[15]。

图43组U251细胞克隆形成能力的比较
A:平板克隆试验照片;B:定量分析结果,与control组比较,*P<0.05
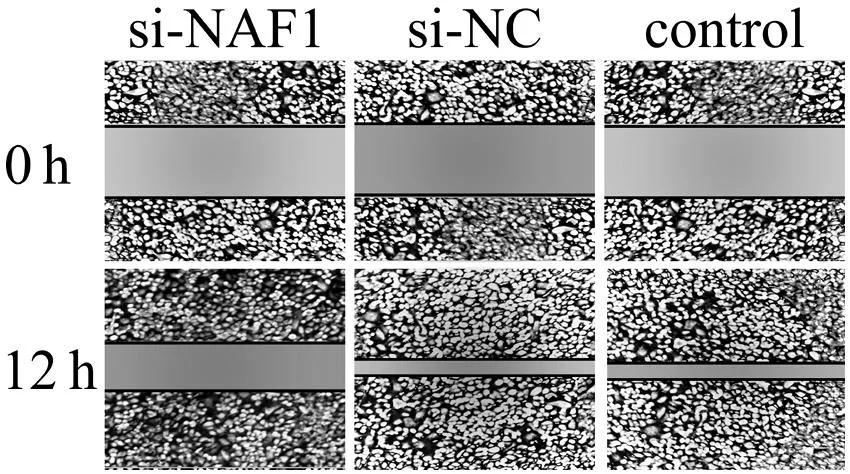
图5 3组 U251细胞在划痕12 h后的细胞迁移能力比较
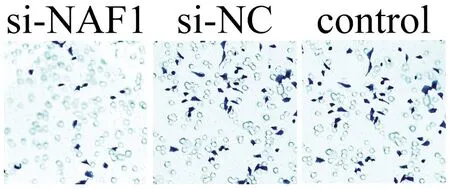
图6 3组 U251细胞培养24 h后的侵袭能力比较
本研究通过RNA干扰技术,将合成的NAF1-siRNA转染至人脑胶质瘤U251细胞[16]。结果显示,siRNA通过沉默NAF1基因的表达,减弱NAF1蛋白表达。研究进一步利用CCK-8试验和平板克隆形成试验检测了沉默NAF1表达后U251细胞的增殖能力。结果表明,细胞在转染NAF1-siRNA后出现明显的生长抑制,克隆形成能力也明显减弱。研究继而利用细胞划痕实验检测了沉默NAF1表达后U251细胞的迁移能力。结果显示,转染NAF1-siRNA后的U251细胞在划痕12h后,迁移能力受到明显抑制。研究结果表明,NAF1-siRNA可能通过降低NAF1的表达抑制了人脑胶质瘤细胞的迁移能力。细胞侵袭能力显示,转染NAF1-siRNA后,通过凝胶的细胞数量明显减少,提示肿瘤的侵袭能力随着NAF1蛋白表达的降低,验证了NAF1蛋白与U251细胞侵袭能力的相关性。
本研究进一步对U251细胞增殖、侵袭能力变化的可能分子机制进行了研究。结果发现,NAF1-siRNA的抗增殖和侵袭作用可能分别通过下调PCNA、MMP-9蛋白的表达而实现的。PCNA是真核细胞复制复合体的重要组成部分,可以通过调控细胞周期的相关蛋白影响细胞周期,进而影响细胞的增殖能力[17]。既往报道也认为PCNA含量的变化与胶质瘤细胞的增殖能力呈正相关[18]。在本研究中,PCNA表达的抑制可能是人脑胶质瘤细胞增殖能力下降的原因。此外,MMP-9参与了调控细胞外基质的降解和基底膜的破坏等肿瘤侵袭与转移过程[19]。肿瘤细胞可通过表达和分泌MMP-9等机制金属蛋白酶,导致基底膜的降解。如果MMP-9表达量降低,人脑胶质瘤细胞的迁移和侵袭能力就会受到明显抑制[20]。说明NAF1-siRNA对人脑胶质瘤细胞的迁移能力产生了明显的减弱作用。
U251细胞为典型的人脑胶质瘤细胞株,在抑制其表达NAF1蛋白后,可能通过影响PCNA蛋白的表达,并降低MMP-9蛋白表达,抑制其增殖和侵袭能力。NAF1在胶质细胞瘤中可能发挥了致癌因子的作用,BAF1的靶向性基因治疗有望成为提高人脑胶质瘤治疗效果、改善预后的有效方法之一。
参考文献
[1]PottsMB,SmithJS,MolinaroAM,etal.Naturalhistoryandsurgicalmanagementofincidentallydiscoveredlow-gradegliomas:Clinicalarticle.JNeurosurg, 2012, 116:365-372.
[2]SanaiN,BergerMS.Extentofresectioninfluencesoutcomesforpatientswithgliomas.RevNeurol, 2011, 167:648-654.
[3]WestphalM,LamszusK.Theneurobiologyofgliomas:fromcellbiologytothedevelopmentoftherapeuticapproaches.NatRevNeurosci, 2011, 12:495-508.
[4]HuseJT,HollandEC.Targetingbraincancer:advancesinthemolecularpathologyofmalignantgliomaandmedulloblastoma.NatRevCancer, 2010, 10:319-331.
[5]JonesMA,AmrS,FerebeeA,etal.GeneticstudiesinDrosophilaandhumanssupportamodelfortheconcertedfunctionofCISD2,PPT1andCLN3indisease.BiolOpen, 2014,3:342-352.
[6]SohnY,TamirS,SongL,etal.NAF-1andmitoNEETarecentraltohumanbreastcancerproliferationbymaintainingmitochondrialhomeostasisandpromotingtumorgrowth.ProcNatlAcadSciUSA, 2013, 110:14676-14681.
[7]TamirS,ZurisJA,AgranatL,etal.Nutrient-DeprivationAutophagyFactor-1 (NAF-1):BiochemicalPropertiesofaNovelCellularTargetforAnti-DiabeticDrugs.PloSOne, 2013, 8:e61202.
[8]ChaiJC,ParkS,SeoH,etal.Identificationofcancer-specificbiomarkersbyusingmicroarraygeneexpressionprofiling.BiochipJ, 2013, 7:57-62.
[9]JiaH,SaitoK,AwW,etal.Transcriptionalprofilinginratsandanexvivoanalysisimplicatenovelbeneficialfunctionofeggshellmembraneinliverfibrosis.JFunctFoods, 2013, 5:1611-1619.
[10]GuoY,ChenW,WangW,etal.Simultaneousdiagnosisandgenetherapyofimmuno-rejectioninratallogeneichearttransplantationmodelusingaT-cell-targetedtheranosticnanosystem.ACSNano, 2012, 6:10646-10657.
[11]GuoY,LiangX,LuM,etal.Mammaliantargetofrapamycinasanoveltargetinthetreatmentofhepatocellularcarcinoma..Hepatogastroenterology, 2009, 57:913-918.
[12]YeX,GuoY,ZhangQ,etal.βKlothosuppressestumorgrowthinhepatocellularcarcinomabyregulatingAkt/GSK-3β/CyclinD1signalingpathway.PloSOne, 2013, 8:e55615.
[13]WangC,GuoY,WangJ,etal.TheSuppressiveRoleofSOX7inHepatocarcinogenesis.PloSOne, 2014, 9:e97433.
[14]WangJ,OuJ,GuoY,etal.TBLR1isanovelprognosticmarkerandpromotesepithelial-mesenchymaltransitionincervicalcancer.BrJCancer, 2014, 111:112-124.
[15]ChangNC,NguyenM,BourdonJ,etal.Bcl-2-associatedautophagyregulatorNaf-1requiredformaintenanceofskeletalmuscle.HumMolGenet, 2012, 21:2277-2287.
[16]SpenglerRM,OakleyCK,DavidsonBL.FunctionalmicroRNAsandtargetsitesarecreatedbylineage-specifictransposition.HumMolGenet, 2014,23:1783-1793.
[17]StrzalkaW,ZiemienowiczA.Proliferatingcellnuclearantigen(PCNA):akeyfactorinDNAreplicationandcellcycleregulation.AnnBot, 2011, 107:1127-1140.
[18]ChenZ,LiuP,LiC,etal.Deregulatedexpressionoftheclockgenesingliomas.TechnolCancerResTreat, 2013, 12:91-97.
[19]QuailDF,JoyceJA.Microenvironmentalregulationoftumorprogressionandmetastasis.NatMed, 2013, 19:1423-1437.
[20]JinJ,CaiL,LiuZ,etal.miRNA-218inhibitsosteosarcomacellmigrationandinvasionbydown-regulatingofTIAM1,MMP2andMMP9.AsianPacJCancerPrev, 2013, 14:3681-3684.
(本文编辑:林燕薇)
临床研究论著

