不同培养条件下透析液和反渗水微生物监测的比较分析
周悦昌, 任丽娜, 王旭辉, 陈建文, 陈妙佩, 毛鸿忠, 韩立杰
不同培养条件下透析液和反渗水微生物监测的比较分析
周悦昌1,任丽娜1,王旭辉1,陈建文3,陈妙佩3,毛鸿忠3,韩立杰2
(1. 牡丹江巿第二人民医院检验科,黑龙江 牡丹江 157000;
2. 牡丹江巿第二人民医院血液净化中心,黑龙江 牡丹江 157000;
3. 屏基医疗财团法人屏东基督教医院教学研究部肾脏科研究小组,台湾 屏东 811)
摘要:目的比较不同培养基、孵育温度及培养时间的选择对透析液和反渗水微生物监测总菌落计数的差异,确认透析液和反渗水微生物监测的最佳培养条件。方法采用无菌透析液和无菌反渗水配置模拟污染水样本,倾注法接种于伊红美蓝琼脂(EMB)、大豆酪蛋白琼脂(TSA)、胰蛋白胨葡萄糖浸液(TGEA)培养基,于25℃和35℃分别进行培养,并记录培养48、72 h及7 d的生长情况。结果不论是25℃还是35℃,TGEA的生长情况均最佳且最接近预期菌落数(P<0.05);各种培养基培养72 h比48 h生长好(P<0.05);培养7 d后的菌落数与培养72 h比较差异无统计学意义(P>0.05)。 结论使用倾注平板法及TGEA培养基对透析液和反渗水进行微生物监测,需同时在25℃及35℃条件下培养至少72 h,方可产生有效的监测报告,确保患者的透析安全。
关键词:血液透析液;反渗水;总菌落数计算
Comparison analysis of microbiological monitoring between hemodialysate and reverse osmosis water under different mediaZHOUYuechang1,RENLina1,WANGXuhui1,CHENJianwen3,CHENMiaopei3,MAOHongzhong3,HANLijie2
.(1.DepartmentofClinicalLaboratory,theSecondPeople′sHospitalofMudanjang,HeilongjiangMudanjiang157000,China; 2.BloodPurificationCenter,theSecondPeople′sHospitalofMudanjang,HeilongjiangMudanjiang157000,China; 3.TeamofNephrologicalResearch,DepartmentofMedicalResearch,PingtungChristianHospital,TaiwanPingtung811,China)
Abstract:ObjectiveTo compare the difference between media, incubation temperatures and culture times on the choice of hemodialysate and reverse osmosis water for microbiological monitoring of heterotrophic plate count, and further to confirm the best culture method of microbiological monitoring for hemodialysate and reverse osmosis. MethodsThe polluted samples were simulated by using sterile dialysate and sterile reverse osmosis water, and then were incubated in 25℃ and 35℃ with eosin methylene blue agar(EMB), tryptone soy agar(TSA) and tryptone glucose extract agar(TGEA)for 48 h, 72 h and 7 d, respectively. ResultsEither on 25℃ or 35℃, the bacteria′s growth condition in TGEA was better than those under other conditions(P<0.05). The colony numbers of 72 h incubation were more than those of 48 h incubation in all media(P<0.05). However, there was no statistical significance of colony numbers between 7 d incubation and 72 h incubation(P > 0.05). ConclusionsThe microbiological monitoring for hemodialysate and reverse osmosis water needs to use pour plate method with TGEA, incubating in 25℃ and 35℃ for 72 h, which may provide the effective reports for ensuring the safety of hemodialysis patients.
Key words:Hemodialysate; Reverse osmosis water; Heterotrophic plate count
血液透析主要是靠血液与透析液在半透膜间进行弥散作用移除尿毒素,水是很好的溶剂,但进行高通量血液透析时微生物及其代谢产物会通过反弥散作用(back filtration)或透析器破膜方式进入血液,特别是当以透析液做为补充液时,微生物及其代谢产物更会直接进入人体[1-2],导致菌血症和脓毒血症的发生。因此,要避免血液透析带来的长期慢性微发炎反应,让透析更安全,透析液的微生物监测是血液透析质量达标的第一步[3]。
目前,透析液和反渗水的微生物培养普遍存在敏感性低、假阴性率高的情况,造成临床上低估透析液和反渗水的污染问题,增加了透析患者的安全隐患。各国对透析液和反渗水的微生物含量虽订有严格标准,但检验方式、培养方法及采样方式仍存在很大的差别。培养基与培养时间不同得到的结果也不同[4];水生细菌适合在乏营养环境中生长,在营养培养基中反而生长缓慢,甚至不能存活[5-6];不同的孵育温度和时间,培养的结果也会有所差异[7-8],如22℃培养7 d、37℃培养2 d或30℃培养5 d[9-11]。因此,用营养琼脂培养基培养微生物指标不超标,并不代表真的不超标。2001年EDTA best practice guideline、2003年国际肾脏病学会(International Society of Nephrology, ISN)及2005年德国卫生指南(German hygiene guideline)推荐使用胰蛋白胨葡萄糖浸液琼脂(tryptone glucose extract agar, TGEA)[5,9,12]。对于总菌落数计数,美国公共卫生协会(American Public Health Association, APHA)推荐以倾倒平板法做为水培养的标准方法[6,13]。
我们采用2种不同菌落数的标准菌液,以倾倒平板法接种于3种不同的培养基,分25℃及35℃进行培养,记录培养48、72 h及7 d的生长情况,以确认最佳的培养条件,供透析液和反渗水微生物监测使用。
材料和方法
一、材料
1.标准菌株大肠埃希菌ATCC 25922、金黄色葡萄球菌ATCC 25923、铜绿假单胞菌ATCC 27853e。
2.培养基大豆酪蛋白琼脂(tryptone soy agar, TSA)、伊红美蓝琼脂(eosin methylene blue agar, EMB)、TGEA。
3.主要仪器法国生物梅里埃公司DensiCHEK plus比浊仪、生物安全柜、细菌培养箱、振荡器。
二、方法
1.采样(1)透析液采集(透析机采样):以酒精消毒橡胶采样阀30 s,全新注射器抽取管路中的透析液,放入无菌收集瓶(采样方式见图1);(2)反渗水采集:以酒精消毒采集口,放入无菌收集瓶后经高温高压灭菌确保达到无菌状态。二者使用前先置于254 nm紫外线下照射8 h,确保杀灭可能的微生物[14]。
2.实验设计(1)采用无菌透析液和无菌反渗水配制浓度为McFarland 0.5的大肠埃希菌、金黄色葡萄球菌和铜绿假单胞菌的菌悬液,再利用无菌透析液和无菌反渗水进行稀释配制,模拟约6和60 CFU/mL菌落数污染的水样本(稀释倍数分别为25×106和2.5×106),在振荡器上温和混匀,以倾倒平板法接种于TSA、EMB、TGEA培养基,分别于25℃、35℃进行培养,记录培养48 h、72 h的生长情况,以无菌透析液和无菌反渗水作为空白对照;EMB组、TSA组和TGEA组的平行检测数为36;25℃组和35℃组的平行检测数为54;48 h组和72 h组的平行检测数为108,以各组实际检测数列表,进行统计学分析;(2)仅用金黄色葡萄球菌模拟约6和60 CFU/mL菌落数污染的水样,采用倾倒平板法接种于TSA、EMB、TGEA培养基,分别于25℃、35℃进行培养,记录培养48、72 h及7 d的生长情况,以无菌透析液和无菌反渗水作为空白对照;实验中72 h组和7 d组的平行检测数为36,以各组实际检测数列表,进行统计学分析。

图1 采样方式
三、统计学方法
采用SPSS 20.0软件进行统计分析。采用独立样本t检验、单因子变异数分析比较不同培养基、孵育温度及培养时间对透析用水总菌落计数的差异。以P<0.05为差异有统计学意义。
结果
以TGEA的生长最佳也最接近预期菌落数,其次为TSA,再次为EMB,各组间菌落数比较差异均有统计学意义(P<0.05)。25℃下各培养基的生长情况优于35℃(P<0.05)。各培养基培养72 h的生长情况优于48 h(P<0.05),金黄色葡萄球菌在EMB培养基上培养48 h未见生长。见表1、表2。
以金黄色葡萄球菌模拟污染水样本培养结果显示培养7 d的菌落数与培养72 h比较差异无统计学意义(P>0.05),但菌落明显变大。见表3、表4、图2。

表1 模拟污染透析液及模拟污染反渗水在各培养基中35℃培养48、72 h的菌落生长情况

表2 模拟污染透析液及模拟污染反渗水在25℃各培养基培养48、72 h的菌落生长情况

表3 以金黄色葡萄球菌模拟污染透析液及反渗水在各培养基中25℃培养48、72 h及7 d的菌落生长情况
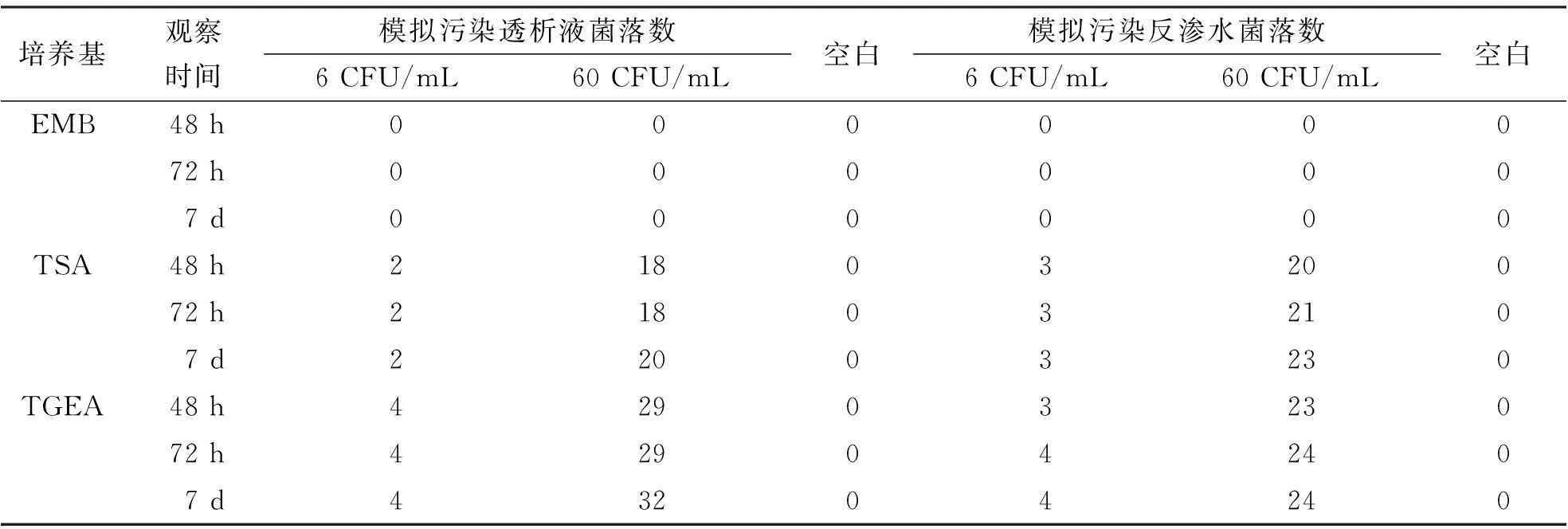
表4 以金黄色葡萄球菌模拟污染透析液及反渗水在各培养基中35℃培养48、72 h及7 d的菌落生长情况

(a)

(b)
注: (a)透析液,35℃培养; (b)反渗水,35℃培养
图2模拟污染透析液及模拟反渗水样本金黄色葡萄球菌(2.5×106CFU/L)在各种培养基48、72 h及7 d培养菌落生长情况
讨论
肾功能替代疗法在终末期肾脏疾病的治疗技术已经相当成熟,而感染却占慢性血液透析患者死亡率的12%~38%[15]。长期血液透析的患者每周暴露于约400~600 L的透析液中[4]。目前,高通透量血液透析及在线式血液透析过滤术被广泛应用,利用大孔径和大表面积的透析膜来增加中、大分子溶质的去除[2,16-17],但微生物及其代谢产物也会通过反扩散作用进入血液[1,4],加上透析液做为补充液,因此存在更大的微生物污染风险[2]。革兰阴性菌可以在所有类型的水样中生长,即使是在只含有少量有机物质的反渗水、蒸馏水或去离子水中也会生长,而且会在透析系统中形成生物膜,抵抗消毒并不断释放代谢产物[9]。这些细菌对血液透析患者的潜在危险主要表现为两种方式:一是在适当的条件下产生菌血症并导致患者发生脓毒性休克;二是这些生物的细胞壁成分含有脂多糖(内毒素),能产生热原反应。
各国对透析用水的微生物含量均有标准[18]。美国肾脏医学会依据美国医疗仪器协会RD52:2004的规范[19-20],透析液和反渗水均要求细菌数低于200 CFU/mL[2,21];英国肾脏医学会依据ISO 13959:2001[11],日本透析治疗学会依据ISO 11663:2009[22-24],均要求细菌数低于100 CFU/mL,并每月进行微生物监测[2,21,25]。因此,选择有效的培养基、接种方法、孵育温度、培养时间及采样方式是透析用水微生物监测的关键。
JACKSON等[13]研究了倾注平板琼脂[(35±0.5)℃,培养(48±2)h]计数与玻片荧光法对水质培养的敏感度,结果显示二者相关性极高(r=0.95, slop=0.99+0.06)。这也相对证明倾注平板法在透析液及反渗水微生物监测中的优势。
本研究观察了EMB、TSA及TGEA培养基在同等条件下培养48、72 h,结果显示TGEA培养基菌落生长最佳,而且在低菌落数(6 CFU/mL)模拟污染水样本中依然生长良好;EMB是选择性培养基,主要用于分离革兰阴性肠道致病菌,它可抑制革兰阳性菌的生长,故金黄色葡萄球菌在EMB培养48 h观察未见生长。由此可见,透析液及反渗水微生物培养时对培养基的选择相当重要。各种培养基72 h比48 h生长好;同样培养时间25℃组比35℃组生长好。在金黄色葡萄球菌模拟污染水样本培养中,25℃组和35℃组培养7 d的菌落数均增加不多(见表3),但菌落明显增大(见图2)。
综上所述,透析液和反渗水微生物监测培养基的选择TGEA优于TSA,而EMB会抑制革兰阳性菌的生长,所以并不适合;培养温度25℃优于35℃;培养时间72 h优于48 h。因此,使用倾注平板法及TGEA培养基对透析液和反渗水进行微生物监测,同时在25℃及35℃条件下培养至少72 h,方可产生有效的监测报告,确保患者的透析安全。
参考文献
[1]CANAU B, BOSC JY, LERAY H, et al. Microbiological purity of dialysate for on-line substitution fluid preparation[J]. Nephrol Dial Transplant, 2000, 15(Suppl 2):21-30.
[2]TATTERSALL JE,WARD RA, EUDIAL Group.Online haemodiafiltration:definition, dose quantification and safety revisited[J]. Nephrol Dial Transplant,2013,28(3): 542-550.
[3]魏媛媛, 马迎春. 透析用水及透析液的微生物检测[J]. 中国血液净化,2014,13(4):335-339.
[4]WARD DM. Hemodialysis water: an update on safety issues, monitoring, and adverse clinical events[J]. ASAIO J,2004,50(6):-ⅲ.
[5]林明滢,王复德,王永卫.不同培养基测定菌落总数的比较[J].感控杂志,2001,11(5):289-298.
[6]REASONER DJ. Heterotrophic plate count methodology in the United States[J]. Int J Food Microbiol,2004,92(3):307-315.
[7]NYSTRAND R. Microbiology of water and fluids for hemodialysis[J]. J Chin Med Assoc,2008,71(5):223-229.
[8]PONTORIERO G, POZZONI P, ANDRULLI S, et al. The quality of dialysis water[J]. Nephrol Dial Transplant,2003,18(Suppl 7): ⅶ21-ⅶ25.
[9]SMEETS E, KOOMAN J, VAN DER SANDE F, et al. Prevention of biofilm formation in dialysis water treatment systems[J]. Kidney Int,2003,63(4):1574-1576.
[10]RAY J. Microbiological monitoring of dialysis water systems-which culture method[J]. J Ren Care,2007,33(2):66-69.
[11]JAMES R. Monitoring of dialysis water systems-is there a need for increased sampling[J]. EDTNA ERCA J,2006,32(2):74-77.
[12]NYSTRAND R. The microbial world and fluids in dialysis[J]. Biomed Instrum Technol,2008,42(2):150-159.
[13]JACKSON RW, OSBORNE K, BARNES G,et al. Multiregional evaluation of the SimPlate heterotrophic plate count method compared to the standard plate count agar pour plate method in water[J]. Appl Environ Microbiol,2000,66(1):453-454.
[14]叶纯宜,林明滢,陈小妮,等.紫外线杀菌效能探讨[J].感控杂志,2005,15(5):293-300.
[15]ROTH VR, JARVIS WR. Outbreaks of infection and/or pyrogenic reactions in dialysis patients[J]. Semin Dial,2000,13(2):92-96.
[16]LEDEBO I, BLANKESTIJN PJ. Haemodiafiltration-optimal efficiency and safety[J]. NDT Plus,2010,3(1):8-16.
[17]ASCI G, TZ H, OZKAHYA M, et al. The impact of membrane permeability and dialysate purity on cardiovascular outcomes[J]. J Am Soc Nephrol,2013,24(6):1014-1023.
[18]NYSTRAND R. Official recommendations for quality of fluids in dialysis-the need for standardisation[J]. J Ren Care,2009,35(2): 74-81.
[19]AMATO RL. Water treatment for hemodialysis--updated to include the latest AAMI standards for dialysate(RD52: 2004) continuing[J]. Nephrol Nurs J, 2005,32(2):151-167.
[20]LAYMAN-AMATO R, CURTIS J, PAYNE GM. Water treatment for hemodialysis: an update[J]. Nephrol Nurs J,2013,40(5):383-404.
[21]FENDLEY DA, WARD RA. Dialysate quality: new standards require a new approach to compliance[J]. Semin Dial,2012,25(5):510-515.
[22]KAWASAKI T, UCHINO J, SHINODA T, et al. Guidance of technical management of dialysis water and dialysis fluid for the Japan Association for Clinical Engineering Technologists[J]. Blood Purif,2009,27(Suppl 1):41-49.
[23]KAWANISHI H, MASAKANE I, TOMO T. The new standard of fluids for hemodialysis in Japan[J]. Blood Purif,2009,27(Suppl 1):5-10.
[24]KAWANISHI H, AKIBA T, MASAKANE I, et al. Standard on microbiological management of fluids for hemodialysis and related therapies by the Japanese Society for Dialysis Therapy 2008[J].Ther Apher Dial,2009,13(2):161-166.
[25]WARD RA. New AAMI standards for dialysis fluids[J]. Nephrol News Issues,2011,25(13):33-36.
(本文编辑:范基农)

收稿日期:(2014-10-31)
中图分类号:
文章编号:1673-8640(2015)05-0478-06R446.11
文献标志码:ADOI:10.3969/j.issn.1673-8640.2015.05.017
作者简介:周悦昌,男,1978年生,硕士,副主任技师,主要从事临床检验工作。

