DADS对Chk1/2基因高表达人胃癌MGC803细胞G2/M期的影响
夏 红,向姝霖,2,曾 颖,陆丽峰,刘 芳,凌 晖,苏 波,苏 琦
(1.湖南省胃癌研究中心南华大学肿瘤研究所, 湖南省高校肿瘤细胞与分子病理学重点实验室,湖南 衡阳 421001;2. 南华大学附属怀化医院,怀化市第一人民医院,湖南 怀化 418000)
DADS对Chk1/2基因高表达人胃癌MGC803细胞G2/M期的影响
夏红1,向姝霖1,2,曾颖1,陆丽峰1,刘芳1,凌晖1,苏波1,苏琦1
(1.湖南省胃癌研究中心南华大学肿瘤研究所, 湖南省高校肿瘤细胞与分子病理学重点实验室,湖南 衡阳421001;2. 南华大学附属怀化医院,怀化市第一人民医院,湖南 怀化418000)
中国图书分类号:R329.24;R329.28;R345.57;R735.202.2;R916.4;R979.1
摘要:目的在建立Chk1/2基因高表达人胃癌MGC803细胞基础上,探讨DADS对Chk1/2高表达MGC803细胞G2/M期的作用。方法分别采用集落形成实验、流式细胞术、RT-PCR、Western blot等方法,检测DADS对Chk1/2高表达MGC803细胞增殖、细胞周期分布、Chk1与Chk2 mRNA与蛋白、p-Chk1与p-Chk2及CDC25C与cyclinB1的表达。结果软琼脂集落形成实验显示,30 mg·L-1DADS作用Chk1与Chk2高表达MGC803细胞组集落形成率均明显低于对照组与空载体组(P<0.05)。流式细胞术显示,30 mg·L-1DADS作用12、24、36、48 h后,Chk1/MGC803细胞G2/M期分别为41.3%、57.4%、68.9%、42.9%,较MGC803细胞与Chk2/MGC803细胞明显增加(P<0.05)。而Chk2/MGC803细胞与MGC803细胞差异没有显著性(P>0.05)。RT-PCR显示,Chk1/MGC803与Chk2/MGC803细胞Chk1与Chk2 mRNA水平较对照组无明显变化;并且,Western blot显示,Chk1与Chk2总蛋白及p-Chk2的表达无明显改变,但p-Chk1呈时间依赖性上调,CDC25C与cyclinB1呈时间依赖性下调(P<0.05)。结论DADS可阻滞Chk1/MGC803细胞于G2/M期,与上调磷酸化Chk1和下调CDC25C与cyclinB1有关。
关键词:二烯丙基二硫;人胃癌细胞;G2/M期;Chk1/Chk2激酶;CDC25C;cyclinB1
二烯丙基二硫(diallyl disulfide,DADS)是大蒜中的脂溶性有效成分,可抑制肿瘤细胞增殖、诱导肿瘤细胞分化与凋亡、阻滞细胞周期、抑制血管形成及侵袭等,是一种很有开发潜力的抗肿瘤药物[1]。我们已经证实,DADS抑制人胃癌细胞增殖和G2/M阻滞与激活p38、抑制ERK/AP-1、上调组蛋白乙酰化、p21 WAF1等有关[2-4]。但是,诱导G2/M阻滞的机制尚未完全阐明。G2/M期检查点失活在细胞癌变过程中起着重要的作用,Chk1和Chk2是G2/M期检查点的两个关键激酶,而Chk1是重要靶点[5]。本研究在构建Chk1/2基因高表达MGC803细胞的基础上[6],进一步探讨DADS对Chk1/2高表达人胃癌细胞周期阻滞的作用及其机制。
1材料与方法
1.1细胞培养人胃癌MGC803细胞株由本实验室保存,置于含10%小牛血清的RPMI 1640培养基中,37℃、5% CO2、饱和湿度的培养箱内传代培养。取对数生长期的细胞用于实验。
1.2主要试剂DADS为Fluka公司产品。DADS与Tween 80以1 ∶2的比例充分溶解后,加入体积分数为0.90%的生理盐水稀释100倍,作为母液保存于-20℃冰箱中。RT-PCR逆转录试剂盒为Promega公司产品;BCA蛋白定量试剂盒为Pierce公司产品;Chk1、Chk2、CDC25C、cyclin B1与β-actin抗体及ECL发光检测试剂盒购自Santa Cruz公司;p-Chk1(Ser345)、p-Chk2(Thr68)抗体与Anti-rabbit IgG购自Cell Signaling Technology;新生牛血清购自杭州四季青生物工程公司。引物用Primer Premier 5.0软件设计,由上海生工公司合成。
1.3软琼脂集落形成实验用双蒸水制备15 g·L-1和9 g·L-1浓度的低熔点琼脂糖溶液,高温高压灭菌后维持于40℃水浴中;同时制备3×RPMI 1640培养基(含300 mol·L-1小牛血清),保存于37℃温箱中,临用时1 ∶2混合琼脂糖与3×RPMI 1640培养液,调整细胞浓度使最终细胞接种为1 000个/孔,每组3个平行样本,2周后观察集落形成情况并计数集落数,计算集落形成率。集落形成率/%=(对照组克隆均数-实验组克隆均数)/对照组克隆均数×100%。
1.4流式细胞仪测定收集已处理好的细胞,1 000 r·min-1离心5 min,弃去培养液,5 mL PBS洗2次,离心,去PBS,加入70%乙醇固定24 h,流式细胞仪分析DNA含量,检测群体细胞中G1、S、G2/M期细胞百分率。
1.5RT-PCR分析Total RNA Kit提取细胞总RNA,在 AMV 酶作用下逆转录合成 cDNA。设计并合成PCR引物序列:Chk1:F 5′-CTGAAGAAGCA GTCGCAGTG-3′,R 5′-TTCCACAGGACCAAACATCA-3′,产物长度494 bp;Chk2:F 5′-TCCGCTTGCTGATGATCTTTATGG-3′,R 5′-GACCTACTCCTTGGGCTCG GCTAT-3′,产物长度498 bp;β-actin: F 5′-CGTCATA CTCCTGCTT-3′,R 5′-ATCTGGCACCACACCT-3′,产物长度820 bp。PCR反应条件:Chk1:95℃,5 min;30个PCR循环(95℃,30 s;53.5℃,30 s;72℃,60 s;72℃,5 min)。Chk2:95℃,5 min;30个PCR循环(95℃,30 s;60℃,15 s;72℃,60 s;72℃,5 min)。β-actin:94℃,5 min;30个PCR循环(94℃,30 s;62.7℃,30 s;72℃,60 s;72℃,5 min)。5 μL的PCR产物经1%的琼脂糖电泳,嗅化乙啶染色,通过IS1000图像分析软件读取目的条带灰度值,相对值以目的基因与β-actin灰度值之比表示。
1.6Western blot 分析分别收集细胞,冰PBS洗2次,以1×107个细胞浓度加入100~150 μL裂解液,冰上裂解1h,低温高速离心收集蛋白,以BCA蛋白定量测定法检测蛋白浓度。以每孔30μg的蛋白量加样,以5 ∶1倍体积与5×SDS加样缓冲液混合,100℃煮沸5 min变性,经10% SDS-PAGE凝胶电泳后,转移至硝酸纤维素膜上,用含5%脱脂牛奶的TBST(Tris-HCl 20 mmol·L-1,NaCl 137 mmol·L-1含0.1% Tween-20)封闭2 h,TBST洗膜3次,一抗37℃孵育2 h,TBST洗3次,每次15 min,相应的二抗孵育1 h,TBST洗3次,每次10 min,化学发光剂检测蛋白质印迹,薄层扫描仪测定印迹区带的光密度值。

2结果
2.1软琼脂集落形成实验Tab 1显示,30 mg·L-1DADS作用后,Chk1与Chk2高表达MGC803细胞集落形成率均明显低于对照组与空载体组(P<0.05)。并且,Chk1较Chk2高表达细胞组明显降低(P<0.05)。对照组与空载体组差异无显著性。表明Chk1与Chk2高表达可抑制MGC803细胞增殖,而Chk1高表达更为明显。
2.2DADS对Chk1/2高表达的MGC803细胞周期影响Tab 2与Fig 1显示,30 mg·L-1DADS作用12、24、36、48 h后,Chk1/MGC803细胞G2/M期分别为41.3%、57.4%、68.9%、42.9%,较MGC803细胞与Chk2/MGC803明显增加(P<0.05)。而Chk2/MGC803细胞与MGC803细胞差异没有显著性(P>0.05)。表明DADS可阻滞Chk1/MGC803细胞于G2/M期与Chk1基因表达增加有关。
**P<0.05vsMGC803 and Chk2/MGC803

Fig 2 Total RNA in Chk1/2 MGC803 cells
A: Chk1/MGC803; B: Chk2/MGC803;1:0 h;2:12 h;3:24 h;4:36 h;5:48 h

Tab 1 The colony forming efficiency in MGC803 cells of overexpression of Chk1/2 gene
**P<0.05vsMGC803 and vector/MGC803;#P<0.05vsChk2/MGC803

Fig 3 Effects of DADS on Chk1/Chk2 mRNA expression in Chk1 or Chk2/MGC803 cells
A:Chk1/MGC803; B: Chk2/MGC803; M: Marker; 1: 0 h; 2: 12 h; 3: 24 h; 4: 36 h; 5: 48 h.
2.3DADS对Chk1/2高表达MGC803细胞Chk1与Chk2 mRNA的影响Fig 2凝胶电泳显示28S和18S条带浓而亮,总RNA纯度高,完全符合RT-PCR要求。Fig 3显示,30 mg·L-1DADS处理12、24、36、48 h后,Chk1/MGC803与Chk2/MGC803细胞Chk1与Chk2 mRNA表达与对照组差异无显著性(P>0.05)。
2.4DADS对Chk1/2高表达MGC803细胞Chk1/Chk2蛋白与磷酸化的影响Fig 4显示,30 mg·L-1DADS处理12、24、36、48 h后,Chk1与Chk2高表达MGC803细胞Chk1与Chk2总蛋白及p-Chk2表达分别较对照组无明显改变(P>0.05)。而Chk1/MGC803细胞p-Chk1呈时间依赖性表达上调(P<0.05)。
2.5DADS对Chk1高表达MGC803细胞CDC25C与cyclinB1表达的影响Fig 5显示,30 mg·L-1DADS处理12、24、36、48 h后,Chk1/MGC803细胞CDC25C与cyclinB1表达呈时间依赖性表达下调(P<0.05)。
3讨论
G1/S和G2/M期检查点失活在细胞癌变过程中起着重要的作用,靶向检查点已成为肿瘤治疗的新策略。研究显示,α-pinene通过上调Chk1与Chk2和下调cyclin B、CDC25与CDK1抑制肝癌细胞增殖[7]。Jaridonin 通过上调p-ATM,激活Chk1与Chk2导致CDC25C、Cdc2与H2A.X磷酸化,阻滞食管癌细胞G2/M。ATM抑制剂可逆转ATM与Chk1/2活化以及CDC25C、Cdc2与H2A.X 的磷酸化和G2/M 阻滞[8]。
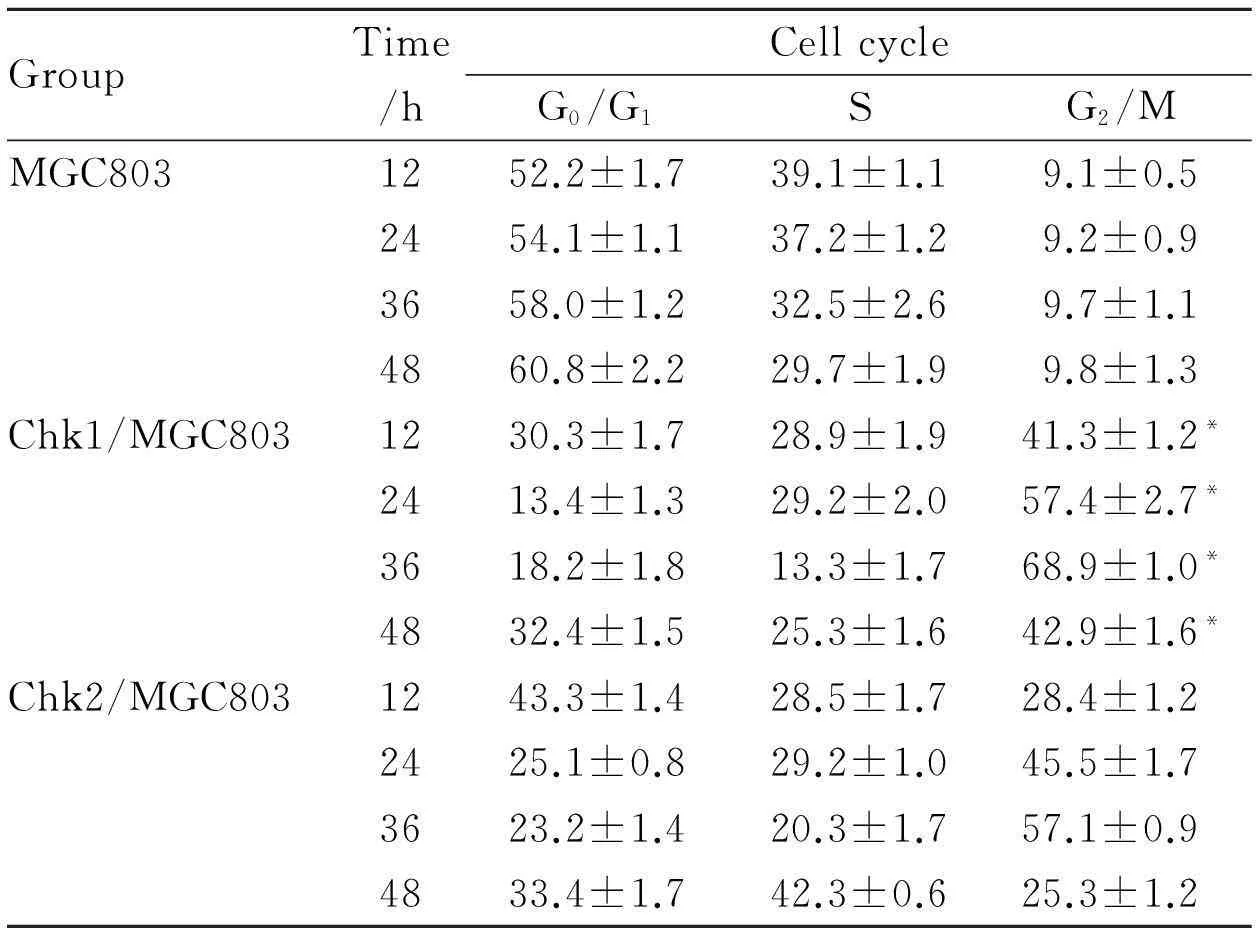
Tab 2 Effects of DADS on G2/M arrest in
**P<0.05vsMGC803 and Chk2/MGC803
大量研究表明,Chk1是G2/M 阻滞的关键靶点。Selvarajah等[9]报道,沉默mTOR或采用mTORC1/2激酶抑制剂可防止etoposide 诱导G2/M阻滞,阻止Chk1磷酸化与下调Chk1,而不是Chk2,表明mTOR抑制剂可通过mTORC2-Chk1途径克服乳腺癌治疗的抵抗。mTOR抑制剂RAD001可增加口腔癌SCC4细胞放疗敏感性,并且与放疗结合可通过活化Chk1增加G2/M阻滞[10]。恶嗪衍生物ZGDHu-1通过上调Chk1和下调cyclin B1与CDC2诱导胰腺癌PANC-1细胞凋亡与G2/M阻滞[11]。ZGDHu1可上调Chk1、p53、p27、pcdc25c, pChk1与pp53和下调cyclin B1、CDC2与CDC25c阻滞白血病Kasumi1细胞于G2/M,而Chk1抑制剂CHIR-124可消除ZGDHu1诱导G2/M阻滞[12]。gossypin可通过活化Chk1引起CDC25C磷酸化,诱导恶性胶质瘤U251细胞G2/M阻滞[13]。Chk1抑制剂与沉默Chk1通过ATR-Chk1途径,而不是ATR-Chk2可废除热应激诱导Jurkat细胞凋亡与G2/M检查点活化[14]。氯雷他定可直接损伤DNA,活化Chk1从而促进G2/M阻滞,使细胞对辐射诱导DNA损害易感[15]。

Fig 4 Effect of DADS on expression of Chk1/2
A:Chk1/MGC803; B: Chk2/MGC803; 1:0 h;2:12 h;3:24 h;4:36 h; 5:48 h;*P<0.05vscontrol.

Fig 5 Effect of DADS on CDC25C and cyclinB1
**P<0.05vscontrol
我们先前证明,DADS可通过ATR/Chk1/CDC25C/cyclin B1通路,磷酸化ATR,激活Chkl,下调CDC25C 和cyclinB1,阻滞MGC803细胞G2/M[16-17]。DADS通过特异性磷酸化Chk1,而不是Chk2,抑制CDC25C/cyclin B1途径,阻滞人胃癌BGC823细胞于G2/M期。沉默Chk1可消除G2/M期阻滞和下调CDC25C与cyclin B1,但沉默Chk2作用不明显。提示沉默Chkl基因可消除DADS诱导BGC823细胞G2/M期阻滞[18]。然而,阐明DADS阻滞MGC803细胞G2/M阻滞的作用靶点是Chkl或Chk2,必须建立高表达Chkl/Chk2胃癌细胞证实。
本研究在建立Chk1/Chk2基因高表达MGC803细胞的基础上,进一步研究显示,DADS作用12、24、36、48 h后,Chk1/MGC803细胞G2/M期较MGC803细胞与Chk2/MGC803细胞明显增加(P<0.05)。但是,Chk1/MGC803细胞G2/M期较MGC803细胞没有明显差异。并且,Chk1、Chk2 mRNA与总蛋白和p-Chk2表达无明显变化,而Chk1/MGC803细胞p-Chk1上调和CDC25C与cyclin B1下调(P<0.05)。表明DADS通过Chk1/CDC25C/cyclin B1途径阻滞Chk1/MGC803细胞于G2/M期,进一步证实DADS阻滞人胃癌细胞G2/M阻滞的作用靶点是Chkl。
参考文献:
[1]Yi L, Su Q. Molecular mechanisms for the anti-cancer effects of diallyl disulfide[J].FoodChemToxicol,2013,57:362-70.
[2]Yuan J P, Wang G H, Ling H, et al. Diallyl disulfide-induced G2/M arrest of human gastric cancer MGC803 cells involves activation of p38 MAP kinase pathways[J].WorldJGastroenterol, 2004, 10(18):2731-4.
[3]Su B, Xiang S L, Su J, et al. Diallyl disulfide increased histone acetylation and p21WAF1 expression in human gastric cancer cellsinvivoandinvitro[J].BiochemPharmacol, 2012,1(7): 1-10.
[4]Ling H, Zhang L Y, Su Q, et al. Erk is involved in the differentiation induced by diallyl disulfide in the human gastric cancer cell line MGC803[J].CellMolBiolLett, 2006, 11(3): 408-23.
[5]Pabla N,Bhatt K,Dong Z. Checkpoint kinase 1(Chk1)-short is a splice variant and endogenous inhibitor of Chk1 that regulates cell cycle and DNA damage checkpoints[J].ProcNatlAcadSciUSA,2012,109(1):197-202.
[6]陆丽峰, 苏波, 姜浩, 等. Chk1/2转基因MGC803细胞系的建立与鉴定[J]. 中南医学科学杂志, 2013,41(2):140-5.
[6]Lu L F, Su B, Jiang H, et al. Construction and identification of transfection of human Chk1/2 gene in gastric cancer MGC803 cells[J].MedSciJCentSChina, 2013, 41(2):140-5.
[7]Chen W, Liu Y, Li M, et al. Anti-tumor effect of α-pinene on human hepatoma cell lines through inducing G2/M cell cycle arrest[J].JPharmacolSci, 2015, 127(3):332-8.
[8]Ma Y C, Su N, Shi X J, et al. Jaridonin-induced G2/M phase arrest in human esophageal cancer cells is caused by reactive oxygen species-dependent CDC2-tyr15 phosphorylation via ATM-Chk1/2-CDC25C pathway[J].ToxicolApplPharmacol, 2015, 282(2):227-36.
[9]Selvarajah J, Elia A, Carroll V A, et al. DNA damage-induced S and G2/M cell cycle arrest requires mTORC2-dependent regulation of Chk1[J].Oncotarget,2015,6(1): 427-40.
[10]Yu C C, Hung S K, Liao H F, et al. RAD001 enhances the radiosensitivity of SCC4 oral cancer cells by inducing cell cycle arrest at the G2/M checkpoint[J].AnticancerRes, 2014, 34(6): 2927-35.
[11]Chen S F, Xia J, Lv Y P, et al. N,N′-di-(m-methylphenyi)-3,6-dimethyl-1,4-dihydro- 1,2,4,5-tetrazine-1,4-dicarboamide(ZGDHu-1) suppresses the proliferation of PANC-1 pancreatic cancer cells via apoptosis and G2/M cell cycle arrest[J].OncolRep, 2015, 33(4): 1915-21.
[12]Xia J, Chen S F, Lv Y P, et al. ZGDHu-1 induces G2/M phase arrest and apoptosis in Kasumi-1 cells[J].MolMedRep, 2015, 11(5):3398-404.
[13]Shi L,Chen J,Wang Y Y,et al. Gossypin induces G2/M arrest in human malignant glioma U251 cells by the activation of Chk1/CDC25C pathway[J].CellMolNeurobiol,2012, 32(2): 289-96.
[14]Furusawa Y,Iizumi T,Fujiwara Y,et al. Inhibition of checkpoint kinase 1 abrogates G2/M checkpoint activation and promotes apoptosis under heat stress[J].Apoptosis, 2012, 17(1): 102-12.
[15]Soule B P,Simone N L,DeGraff W G,et al. Loratadine dysregulates cell cycle progression and enhances the effect of radiation in human tumor cell lines[J].RadiatOncol,2010,5:8.
[16]陆丽峰, 苏波, 姜浩, 等. 二烯丙基二硫对人胃癌MGC803细胞G2/M期检查点Chk1与Chk2的影响[J].中国药理学通报, 2013,29(1):79-84.
[16]Lu L F, Su B, Jiang H, et al. Effect of diallyl disulfide on G2/M checkpoint Chk1 anf Chk2 in human gastric cancer MGC803 cells[J].ChinPharmacolBul, 2013, 29(1):79-84.
[17]Ling H, Wen L, Ji X X, et al. Growth inhibitory effect and Chk1-dependent signaling involved in G2/M arrest on human gastric cancer cells induced by diallyl disulfide[J].BrazJMedBiolRes, 2010, 43(3): 271-8.
[18]Su B, He H, Wang L, et al. Chk1, but not Chk2, is responsible for G2/M phase arrest induced by diallyl disulfide in human gastric cancer BGC823 cells[J].FoodChemToxicol,2014, 68: 61-70.
Overexpression of Chk1/2 gene affects G2/M arrest in MGC803 cells induced by diallyl disulfide
XIA Hong1, XIANG Shu-lin1,2, ZENG Ying1, LU Li-feng1, LIU Fang1, LING Hui1, SU Bo1, SU Qi1
(1.CenterforGastricCancerResearchofHunanProvince,CancerResearchInstitute,KeyLaboratoryofCancerCellularandMolecularPathologyofHunanProvincialUniversity,UniversityofSouthChina,HengyangHunan
421001,China; 2.HuaihuaFirstHospitalAffiliatedtoUniversityofSouthChina,HuaihuaHunan418000,China)
Abstract:AimTo investigate the effects of diallyl disulfide(DADS) on G2/M arrest in Chk1/MGC803 and Chk2/MGC803 cells so as to establish stable human gastric cancer MGC803 cells with overexpression of Chk1/2 gene.MethodsThe colony formation, flow cytometry, RT-PCR and Western blot were used to detect the proliferation, cell cycle, and expression of Chk1/2 mRNA and protein, p-Chk1/2, CDC25C and cyclinB1, respectively.ResultsThe colony formation showed that the colony forming efficiency in Chk1/MGC803 and Chk2/MGC803 cells treated by 30 mg·L-1DADS was lower than in control group and vector group(P<0.05). Flow cytometry demonstrated that 41.3%, 57.4%, 68.9% and 42.9% of G2/M cells in Chk1/MGC803 were increased than in MGC803 and Chk2/MGC803, respectively after treated by DADS in 12,24, 36 and 48 h(P<0.05). At the same time, RT-PCR disclosed that expression of Chk1 and Chk2 mRNA had no marked change. Western blot showed that total proteins of Chk1 and Chk2 and p-Chk2 had invisible change, but expression of p-Chk1 was up-regulated, and CDC25C and cyclinB1 were down-regulated time-dependently in Chk1/MGC803 cells (P<0.05).ConclusionDADS arrests MGC803 cells at G2/M by increasing p-Chk1 expression to cause down-regulation of CDC25C and cyclinB1 simultaneously.
Key words:diallyl disulfide; gastric cancer cell; G2/M; Chk1/2 gene; CDC25C; cyclinB1
文献标志码:A
文章编号:1001-1978(2016)02-0199-06
doi:10.3969/j.issn.1001-1978.2016.02.011
作者简介:夏红(1976-),女,博士生,实验师,研究方向:胃癌防治的分子机制,E-mail: 6970842@qq.com;向姝霖(1979-),女,硕士,主治医师,研究方向:抗肿瘤药物分子机制,并列第一作者,E-mail: 15074566777@163.com;苏琦(1945-),男,教授,博士生导师,研究方向:胃癌发生及防治的分子机制,通讯作者,E-mail: suqi1945@163.com
基金项目:国家自然科学基金资助项目(No 81102854, 81374013);湖南省卫生厅科研课题(No B2015-182)
收稿日期:2015-11-08,修回日期:2015-12-11
网络出版时间:http://www.cnki.net/kcms/detail/34.1086.R.20160125.1557.022.html网络出版地址:2016-1-25 15:57

