与镁、铝及其化合物相关的图象题突破
吉林 赵鑫光
与镁、铝及其化合物相关的图象题突破
吉林 赵鑫光
镁、铝及其化合物是高中化学中重要的无机化合物,其沉淀的生成、转化及其相关计算是高考中的重点也是难点,本文总结了相关知识点和典型图象,并辅以相关习题训练。
一、关于氢氧化铝沉淀的四个基本图象
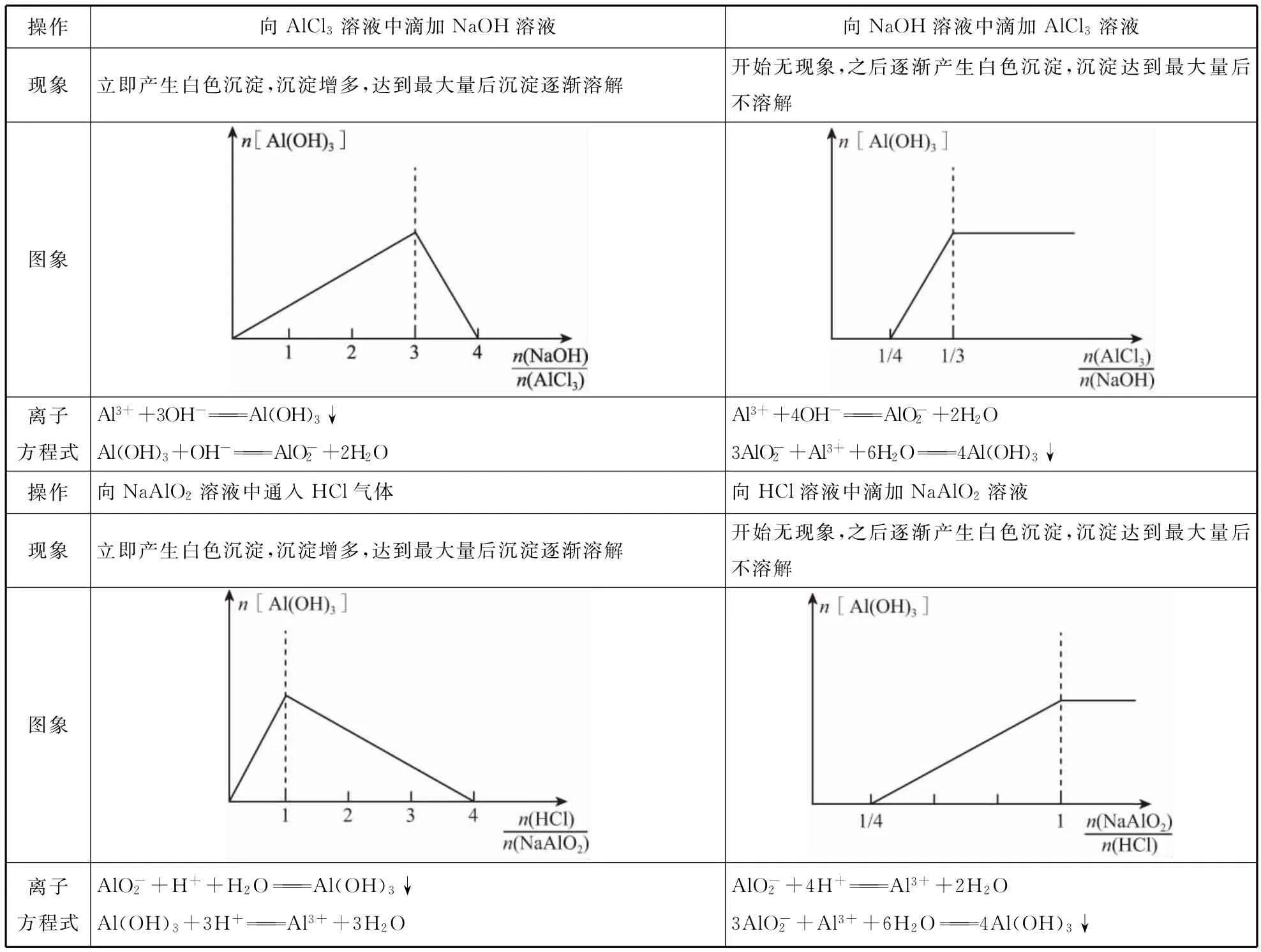
操作向AlCl3溶液中滴加NaOH溶液向NaOH溶液中滴加AlCl3溶液现象立即产生白色沉淀,沉淀增多,达到最大量后沉淀逐渐溶解开始无现象,之后逐渐产生白色沉淀,沉淀达到最大量后不溶解图象离子_方程式Al3++3OH-===Al(OH)3↓Al(OH)3+OH-===AlO-2+2H2O__________________________________ Al3++4OH-===AlO-2+2H2O 3AlO-2+Al3++6H2O ===4Al(OH)3↓___________________操作向NaAlO2溶液中通入HCl气体向HCl溶液中滴加NaAlO2溶液现象立即产生白色沉淀,沉淀增多,达到最大量后沉淀逐渐溶解开始无现象,之后逐渐产生白色沉淀,沉淀达到最大量后不溶解图象离子方程式AlO-2+H++H2O ===Al(OH)3↓Al(OH)3+3H+===Al3++3H2O AlO-2+4H+===Al3++2H2O 3AlO-2+Al3++6H2O ===4Al(OH)3↓
二、关于氢氧化铝沉淀的四个拓展图象

操作向AlCl3溶液中滴加氨水向氨水中滴加AlCl3溶液现象立即产生白色沉淀,沉淀增多,达到最大量后不溶解立即产生白色沉淀,沉淀增多,达到最大量后不溶解图象

续表
三、氢氧化镁和氢氧化铝混合沉淀的图象

操作向MgCl2、AlCl3溶液中逐滴加入NaOH 溶液离子方程式现象立即产生白色沉淀,沉淀增多,达到最大量后部分溶解,最后保持不变图象O~a段∶Al3++3OH-===Al(OH)3↓Mg2++2OH-===Mg(OH)2↓a~b段∶Al(OH)3+OH-===AlO-2+2H2O
四、典型例题
1.向盐酸和AlCl3的混合溶液中逐滴加入NaOH溶液至过量,生成沉淀Al(OH)3的量随着加入NaOH溶液体积的变化关系如图所示,下列说法正确的是( )

A.在a点对应的溶液中,Mg2+、I-、NH4+、NO3-能大量共存
B.图中B→C的过程中,实际发生的离子方程式为Al(OH)3+OH-===AlO2-+2H2O
C.若b、c的纵坐标数值相同,则横坐标数值之比为1∶3
D.原溶液中盐酸和AlCl3物质的量浓度之比为1∶3
【解析】相关反应发生的顺序为NaOH+HCl ===NaCl+H2O,3NaOH+AlCl3===3NaCl+Al(OH)3↓,NaOH+Al(OH)3===NaAlO2+2H2O,a点的溶液为AlCl3、HCl混合溶液,在酸性条件下,NO-3可氧化I-,故A错误;B→C的过程是Al(OH)3溶于NaOH溶液,故B正确;b、c点纵坐标数值相同,但横坐标应为与最高点的差值比例为3∶1,即B~b∶c~B=3∶1,故C错误;由方程式可知原溶液中HCl、AlCl3的物质的量之比为1∶1,故D错误。
2.在200mL含Mg2+、Al3+、NH+4、H+、Cl-等离子的溶液中,逐滴加入5mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示。下列叙述正确的是( )
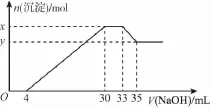
A.原溶液中n(Mg2+)∶n(Al3+)=5∶2
B.原溶液的pH=2
C.x与y的差值为0.01mol
D.原溶液中c(Cl-)=0.75mol/L
【解析】各段发生的反应如下∶0~4mL,H++OH-===H2O;4~30mL,Mg2++2OH-===Mg(OH)2↓和Al3++3OH-===Al(OH)3↓;30~33mL,NH4++OH-===NH3·H2O;33~35mL,Al(OH)3+OH-=== AlO2-+2H2O由n(Al3+)=n[Al(OH)3]=(35-33)× 10-3L×5mol/L=0.01mol,生成沉淀时消耗的n(NaOH)=0.01mol×3=0.03mol,则与Mg2+反应的NaOH的物质的量为(30-4)×10-3L×5mol/L-0.03mol=0.1mol,则n(Mg2+)=0.05mol,原溶液中n(Mg2+)∶n(Al3+)=5∶1,故A错误;由图可知,加入4mL时酸碱中和反应发生完全,则c(H+)=4mL×5mol/L÷200mL=0.1mol/L,pH=1,故B错误;x-y=n[Al(OH)3]=0.01mol,故C正确;加入33mL NaOH溶液时Cl-全部以NaCl形式存在于溶液中,则c(Cl-)=33mL×5mol/L÷200mL=0.825mol/L,故D错误。
3.在1L含0.1mol NaAlO2和0.1mol Ba(OH)2的混合溶液中,逐滴加入浓度为0.1mol/L的H2SO4溶液,下列图象中能表示反应产生沉淀的物质的量与加入硫酸溶液体积之间关系的是( )
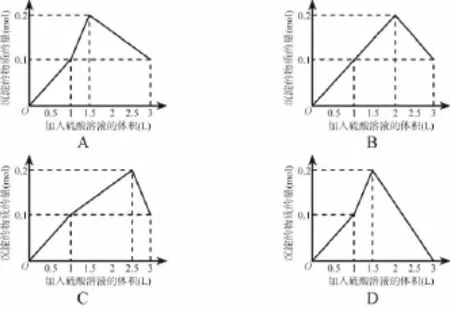
【解析】混合溶液中n(NaAlO2)=n[Ba(OH)2]=0.1mol,加入H2SO4溶液时反应顺序为Ba(OH)2+H2SO4===BaSO4↓+2H2O,AlO2-+H++H2O=== Al(OH)3↓,Al(OH)3+3H+===Al3++3H2O。
第一阶段:生成沉淀n(BaSO4)=0.1mol;消耗硫酸n(H2SO4)=0.1mol,体积为1L。
第二阶段:生成沉淀n[Al(OH)3]=0.1mol;消耗硫酸n(H2SO4)=0.05mol,体积为0.5L。此时总沉淀量为0.2mol,消耗硫酸总体积为1.5L。
第三阶段:0.1mol Al(OH)3完全溶解,消耗硫酸n(H2SO4)=0.15mol,体积为1.5L,此时加入H2SO4的总体积为3L;由此可知A为正确答案。
4.将足量的CO2不断通入KOH、Ba(OH)2、KAlO2混合溶液中,生成沉淀与通入CO2的量的关系可表示为( )
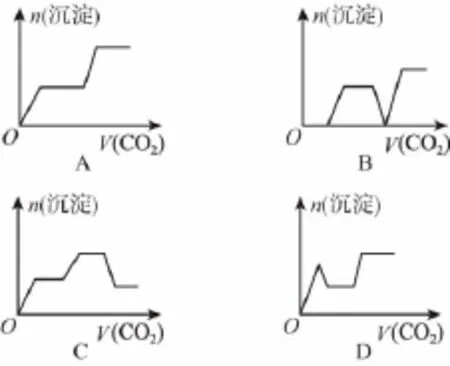
【解析】在通入CO2的过程中,反应的先后顺序是①CO2+Ba(OH)2===BaCO3↓+H2O,开始产生沉淀;②CO2+2KOH ===K2CO3+H2O,沉淀质量不变;③CO2+2KAlO2+3H2O ===2Al(OH)3↓+K2CO3,沉淀质量增加;④K2CO3+CO2+H2O ===2KHCO3,沉淀质量不变;⑤BaCO3+CO2+H2O ===Ba(HCO3)2,沉淀质量减小,最后剩余Al(OH)3沉淀;⑥继续通入CO2,沉淀的量保持不变。因此C选项为正确答案。
5.将一块镁铝合金投入1mol/L的盐酸中,待合金完全溶解后,往溶液中加入1mol/L的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液体积的关系如图所示,求:
(1)盐酸的体积;
(2)a的取值范围;
(3)这块合金中Mg的物质的量的取值范围;
(4)当a值为30时,沉淀最大值为多少。
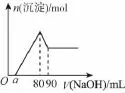
【解析】(1)根据图可知,加入80mL NaOH溶液时沉淀量最大,此时溶液溶质为NaCl,n(HCl)=n(NaCl)=n(NaOH),所以V(HCl)×1mol/L=1mol/L×80mL,即V(HCl)=80mL。
(2)若溶解金属后盐酸不剩余,即酸与合金恰好完全反应,得a=0,若合金中完全是Al时,剩余的酸最多,由80~90mL这段可以求出n(Al)=n[Al(OH)3]=0.01mol,则沉淀Al3+消耗的NaOH溶液的体积为0.01mol×3÷ 1mol/L=0.03L=30mL,则中和过量的酸所消耗的NaOH体积为80mL-30mL=50mL,由于是合金,所以极值是不存在的,得a的取值范围为0≤a<50。
(3)当a=0,n(Mg2+)为最大值,已知与Al3+反应的NaOH为30mL,则与Mg2+反应的NaOH为50mL,n(Mg2+)max=1mol/L×0.05L÷2=0.025mol,得0<n(Mg2+)≤0.025mol。
(4)当a=30时,可得n(Mg2+)=1mol/L×0.02L÷ 2=0.01mol,则沉淀的最大质量为Al(OH)3与Mg(OH)2质量之和,m=0.01mol×58g/mol+0.01mol×78g/mol=1.36g。
(作者单位:长春吉大附中实验学校)

