二十二碳六烯酸对脊髓损伤大鼠神经功能恢复的影响及其机制
蒋春闪,吕游,陈金传,孟祥圣,张剑,刘艺
(1徐州医科大学附属连云港医院,江苏连云港222000;2徐州医科大学)
二十二碳六烯酸对脊髓损伤大鼠神经功能恢复的影响及其机制
蒋春闪1,吕游1,陈金传1,孟祥圣1,张剑2,刘艺1
(1徐州医科大学附属连云港医院,江苏连云港222000;2徐州医科大学)
目的 观察二十二碳六烯酸(DHA)对脊髓损伤大鼠神经功能恢复的影响,并探讨其可能的机制。方法 将60只成年雄性SD大鼠按随机数字表法分为假手术组、模型组和观察组,每组20只。模型组和观察组制备脊髓损伤模型,假手术组只暴露但不损伤脊髓。造模后0.5 h,观察组经尾静脉注射DHA 1 000 nmol/kg,连用3天。各组分别于造模前1天(t0)及造模后1天(t1)、3天(t2)、7天(t3)、21天(t4),记录斜板试验最大角度和脊髓损伤评分(BBB评分);于T1~T4分别取5只大鼠,观察脊髓病理形态,采用免疫组化法检测脊髓神经元核抗原(NeuN)与神经胶质纤维酸性蛋白(GFAP)表达。结果 模型组和观察组T1~T4斜板试验最大角度及BBB评分均明显低于T0和假手术组同时间点,模型组T3、T4斜板试验最大角度及BBB评分均明显低于观察组同时间点(P均<0.05)。与假手术组比较,模型组和观察组T1~T4脊髓形态均发生病理性改变,观察组较模型组病理性改变有所改善。与假手术组比较,模型组和观察组T1~T4脊髓背角和腹角NeuN表达均降低,但模型组降低更明显(P均<0.05)。与假手术组比较,模型组和观察组T1~T4GFAP表达均升高,但模型组T3、T4升高更明显(P均<0.05)。结论 DHA能够减轻脊髓损伤大鼠的病理损伤,促进神经功能的恢复;升高脊髓NeuN表达、降低GFAP表达可能是其作用机制。
脊髓损伤;二十二碳六烯酸;神经元核抗原;神经胶质纤维酸性蛋白;大鼠
脊髓损伤常导致严重伤残,神经修复与再生是脊髓损伤恢复的关键环节。目前其治疗方法主要是手术减压和大剂量甲强龙冲击治疗,但疗效尚存在争议[1~3]。n-3多不饱和脂肪酸(n-3 PUFAs)主要包含二十二碳六烯酸(DHA)、二十碳五烯酸(EPA)和α-亚麻酸(ALA),其中DHA广泛存在于中枢神经系统(CNS)细胞膜上,其含量占n-3 PUFAs的50%以上,对神经修复与再生具有关键作用[4,5]。2015年3~10月,我们观察了DHA对脊髓损伤大鼠神经功能恢复的影响,并探讨其相关机制。
1 材料与方法
1.1 材料 成年雄性SD大鼠60只,健康清洁级,6~7周龄,体质量200~250 g,购于徐州医科大学动物实验中心。试剂及仪器:DHA(Sigma公司,美国),Anti-NeuN试剂盒(Abcam公司,英国),Anti-GFAP试剂盒(武汉博士德生物工程有限公司);BX41光学显微镜(Olympus公司,日本)。
1.2 模型制备及分组处理 将60只成年雄性SD大鼠按随机数字表法分为假手术组、模型组和观察组,每组20只。模型组和观察组采用改良Allen打击法[6]制备脊髓损伤模型:两组均以10%水合氯醛(3 mL/kg)腹腔注射麻醉,固定于动物实验台上,剪去术野背毛,常规消毒铺巾。以胸椎T10为中心,取后正中切口约4 cm逐层切开,剥离椎板两旁肌肉,充分暴露T9~T11椎板及棘突;小心去除T9、T10椎板,充分显露T10节段脊髓(约1.0 cm×0.6 cm)。在脊髓上置一块薄明胶垫,以10 g打击棒自10 cm处垂直自然下落,精确致伤明胶垫处脊髓,致伤能量约100 gcf(gram cm force),打击棒停留1 min后移开。清洗、止血、缝合,肌注2.5万U/(kg·d)青霉素预防感染,连用3天。假手术组只暴露但不损伤脊髓。模型组和观察组均出现双下肢躯体回缩样扑动,尾巴出现痉挛性摆动,证实造模成功。各组术后每日早中晚按摩膀胱辅助排尿3次,直至恢复自主排尿。造模后0.5 h,观察组参照Lim等[7]的方法经尾静脉注射DHA 1 000 nmol/kg,连用3天。
1.3 相关指标观察
1.3.1 神经功能 各组分别于造模前1天(t0)及造模后1天d(t1)、3 天(t2)、7天(t3)、21天(t4)行斜板试验和脊髓损伤评分(BBB评分)。①斜板试验:将大鼠置于一长方形带横纹胶垫木制斜板上,保持大鼠身体纵线与斜板纵轴垂直放置,逐渐升高斜板高度,记录大鼠在斜板上停留5 s的最大角度,重复5次,取平均值。②BBB评分:将大鼠置于宽阔活动场地自由活动5 min,观察其后肢运动、躯干位置及稳定性、步态、协调性、爪的置放及尾巴的位置,对左右下肢分别评分并取平均值,满分为21分。斜板试验和BBB评分均由两位熟悉评分标准但不参与实验分组的人员进行操作,斜板试验最大角度越大、BBB评分越高,说明神经功能越好。
1.3.2 脊髓病理形态 各组于t1~t4分别取5只大鼠,取仰卧位。经左心房插管至主动脉内固定,剪开右心耳,用生理盐水灌注至右心耳流出澄清液体,再以4%多聚甲醛先快后慢灌注至大鼠四肢抽搐,尾巴僵直。取损伤中心上下约2 cm的脊髓,置于10%多聚甲醛中保存24 h,常规石蜡包埋。损伤中心连续横断切片10张,片厚约为5 μm。随机选取3张脊髓横断面切片行HE染色,光学显微镜下观察脊髓病理形态。
1.3.3 脊髓神经元核抗原(NeuN)和神经胶质纤维酸性蛋白(GFAP)表达 取各组t1~t4的脊髓横断面切片,采用免疫组化SP法检测NeuN和GFAP表达,严格按照试剂盒说明书操作。以神经细胞染成棕黄色定义为阳性,每张切片随机选取脊髓腹角与背角各3个不重叠的高倍视野,采用Image-Pro Plus 6.0软件检测脊髓背角与腹角NeuN、GFAP阳性颗粒平均分光光密度值(OD值),取平均值。

2 结果
2.1 三组神经功能比较 模型组和观察组t1~t4斜板试验最大角度及BBB评分均明显低于同组t0和假手术组同时间点,模型组t3、t4斜板试验最大角度及BBB评分均明显低于观察组同时间点(P均<0.05)。见表1。
2.2 三组脊髓病理形态比较 假手术组各时间点脊髓形态完整,灰白质分界清楚,神经细胞呈典型多极神经元,尼氏体分布均匀,白质纤维走形正常。模型组t1可见弥漫性出血,神经元明显减少,灰白质分界不清,白质空泡明显;t2出血相对减少,可见灰质碎解,结构消失,有胶质细胞聚集;t3出血基本消失,神经元固缩变形,核偏移,可见小空洞形成;t4神经元减少,部分嗜酸性变,反应性胶质细胞增多,白质纤维走形紊乱,有形成胶质瘢痕的趋势。与模型组比较,观察组相同时间点出血明显减少,灰白质结构相对清晰,可见神经元水肿变性及白质空泡;随着时间推移,观察组神经细胞逐渐恢复为典型的多极神经元形态,白质空泡减少,结构近乎正常。

表1 三组不同时间点斜板试验最大角度和 BBB评分比较
注:与同组t0比较,*P<0.05;与假手术组同时间点比较,#P<0.05;与模型组同时间点比较,△P<0.05。
2.3 三组脊髓NeuN和GFAP表达比较 与假手术组比较,模型组和观察组t1~t4脊髓背角和腹角NeuN表达均降低,但模型组降低更明显(P均<0.05)。与假手术组比较,模型组和观察组t1~t4GFAP表达均升高,但模型组t3、t4升高更明显(P均<0.05)。见表2。
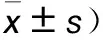
表2 三组脊髓NeuN和GFAP表达比较(OD值,
注:与假手术组同时间点比较,#P<0.05;与模型组同时间点比较,△P<0.05。
3 讨论
脊髓损伤包括神经元及血管破坏引起的原发性损伤和一系列生化机制改变引起的继发性损伤,二者共同导致神经元的退变、坏死和胶质细胞活化等病理反应[8]。研究表明,DHA可以通过多种抗炎机制减少损伤后神经元的丢失,促进神经修复与再生[9,10]。DHA属于n-3多不饱和脂肪酸的一种,有“脑黄金”之美誉,主要从深海鱼油和藻类中提炼,是中枢神经系统多不饱和脂肪酸的主要成分,可促进婴儿大脑发育[11]。DHA具有高度不饱和性,可以增加神经元细胞膜的流动性,在神经元的生化反应中具有重要作用。Pu等[12]研究发现,n-3 PUFAs 可改变脑损伤小鼠神经细胞膜上的脂筏结构,与花生四烯酸竞争代谢,减轻炎症介质的释放,抑制胶质细胞活化与兴奋性神经毒性,减少神经元的丢失与脱髓鞘变化。本研究观察组神经功能较模型组明显提高,说明DHA可以促进大鼠神经功能恢复; 观察组脊髓组织出血、水肿及渗出、坏死情况较模型组有明显改善,说明DHA可减轻脊髓损伤后的炎症反应,抑制脊髓继发性损害。
脊髓损伤后成熟神经元的数量可直接反映神经功能状态。NeuN是成熟神经元的特异性标记物,有46、48 kD两个亚型,分别在细胞核和细胞质表达[13]。脊髓损伤后即可发生神经元的变性、坏死和凋亡,NeuN蛋白可反映神经元存活状态。打击伤可对直接打击侧(背角)与间接打击侧(腹角)均造成损伤,因此本研究采用NeuN蛋白评价神经元的损伤程度。结果显示,与模型组比较,观察组脊髓背角与腹角NeuN蛋白表达均显著增高,说明DHA可促进神经元的修复与再生。
GFAP是活化星形胶质细胞标志物,其表达水平可反映星形胶质细胞的功能状态。虽然星形胶质细胞是形成胶质瘢痕的主要因素,但其活化后聚集于损伤组织周围,可以分泌一系列细胞因子,改善损伤组织的微环境,有利于损伤区域神经元的修复与再生[14]。GFAP在脊髓损伤后广泛分布,区域性分布并不显著。因此,本研究未分别观察脊髓背角与腹角GFAP表达。本研究结果显示,与模型组各时间点比较,观察组GFAP表达均降低,且t3、t4降低更明显。考虑到模型组早期神经元大量变性坏死,相对于观察组应有大量星形胶质细胞活化聚集,但本研究结果显示模型组早期星形胶质细胞活化程度并不明显强于观察组。我们猜测虽然DHA可以减少GFAP表达,在一定程度上抑制星形胶质细胞活化,但在早期可能对其活化有一定的促进作用。但是目前尚无研究报道证实,有待于进一步研究。
综上所述,DHA能促进脊髓损伤大鼠的神经功能恢复,其机制可能与升高脊髓NeuN表达、降低GFAP表达有关。
[1] Hurlbert RJ, Hamilton MG. Methylprednisolone for acute spinal cord injury: 5-year practice reversal[J]. Can J Neurol Sci, 2008,35(1):41-45.
[2] La Rosa G, Conti A, Cardali S, et al. Does early decompression improve neurological outcome of spinal cord injured patients? Appraisal of the literature using a meta-analytical approach[J]. Spinal Cord, 2004,42(9):503-512.
[3] 胥少汀,刘树清.合理治疗脊髓损伤[J].中华外科杂志,2007,45(6):361-362.
[4] Williams JJ, Mayurasakorn K, Vannucci SJ, et al. N-3 fatty acid rich triglyceride emulsions are neuroprotective after cerebral hypoxic-ischemic injury in neonatal mice[J]. PLoS One, 2013,8(2):e56233-56242.
[5] Begum G, Yan HQ, Li L, et al. Docosahexaenoic acid reduces ER stress and abnormal protein accumulation and improves neuronal function following traumatic brain injury[J]. J Neurosci, 2014,34(10):3743-3755.
[6] 李一帆,陈东,张大威,等.急性大鼠脊髓损伤Allen′s法模型的改良及电生理评价[J].中国实验诊断学,2010,14(8):1169-1172.
[7] Lim SN, Huang W, Hall JC, et al. Improved outcome after spinal cord compression injury in mice treated with docosahexaenoic acid[J]. Exp Neurol, 2013(239):13-27.
[8] Priyanka LS, Agarwal N, James CB, et al. Current therapeutic strategies for inflammation following traumatic spinal cord injury[J]. Neural Regen Res, 2012,7(23):1812-1827.
[9] Paterniti I, Impellizzeri D, Di PR, et al. Docosahexaenoic acid attenuates the early inflammatory response following spinal cord injury in mice: in-vivo and in-vitro studies[J]. J Neuroinflammation, 2014,11(6):1186-1194.
[10] Bazan NG. Neuroprotectin D1 (NPD1): a DHA-derived mediator that protects brain and retina against cell injury-induced oxidative stress[J]. Brain Pathol, 2005,15(2):159-166.
[11] 扶志敏,王正.ω-3多不饱和脂肪酸抗炎机制研究进展[J].医药导报,2009,28(9):1174-1176.
[12] Pu H, Guo Y, Zhang W, et al. Omega-3 polyunsaturated fatty acid supplementation improves neurologic recovery and attenuates white matter injury after experimental traumatic brain injury[J]. J Cereb Blood Flow Metab, 2013,33(9):1474-1484.
[13] 张雨平,黄其林,赵聪敏,等.大鼠不同发育期脑神经元核抗原的表达研究[J].重庆医学,2010,39(21):2901-2903.
[14] Liem RK, Messing A. Dysfunctions of neuronal and glial intermediate filaments in disease[J]. J Clin Invest, 2009,119(7):1814-1824.
刘艺(E-mail: 80600026@qq.com)
10.3969/j.issn.1002-266X.2016.32.010
R651.2
A
1002-266X(2016)32-0032-03
2015-11-22)

