不同流体剪切力对牙周膜成纤维细胞分泌COX-2的影响*
吴 忧, 张军梅*
(贵州医科大学附院 口腔科, 贵州 贵阳 550004)
不同流体剪切力对牙周膜成纤维细胞分泌COX-2的影响*
吴忧**, 张军梅***
(贵州医科大学附院 口腔科, 贵州 贵阳550004)
[摘要]目的: 研究流体剪切力(FSS)对体外培养人牙周膜成纤维细胞(HPDLCs)分泌环氧合酶2(COX-2)蛋白的影响。方法: 体外培养的HPDLCs置于体外FSS加载装置系统,分别加载0、5、8、12及15 r/min的FSS 1、2及6 h,免疫组织化学染色方法检测细胞分泌的COX-2蛋白量,分析蛋白量的灰度值。结果: HPDLCs在FSS的作用下COX-2蛋白表达增强,加载力为12 r/min及加载时间2 h 时,COX-2蛋白的表达达峰值。结论: 体外加载FSS可影响人HPDLCs分泌COX-2蛋白。
[关键词]流体剪切力; 环氧合酶2; 牙周膜; 成纤维细胞
合适的正畸力不仅仅可以使得牙齿快速移动,同时还能够刺激牙槽骨、颌面部等软硬组织发生不同程度的改建[2]。人牙周膜成纤维细胞(human periodontal ligament fibroblast,HPDLCs)对机械力的适应性改建是牙齿移动的生物学基础[1]。研究表明,在正畸过程中,HPDLCs是最先感受到正畸力的细胞,在骨改建的过程中起到了重要的调控作用[3-4]。当机械力引起牙周膜内部液体环境流动产生流体剪切力(fluid shear stress,FSS)后,机械力学信号转换为生物力学信号,从而使得HPDLCs开始增殖及分化[5]。环氧合酶2(cyclooxygenase 2,COX-2)是前列腺素E2的限速酶,参与了是前列腺素E2的激活,进而介导细胞力信号作用后骨改建的发生。本研究通过使用平板腔室系统,对体外培养的HPDLCs施加FSS,观察不同加载力值、不同时间对HPDLCs分泌COX-2的影响,为研究正畸力作用下骨组织改建提供实验依据。
1材料及方法
1.1主要试剂及器材
DMEM低糖培养基购自美国Gibco公司,胎牛血清( FBS)、100 U/mL青霉素和100 U/mL链霉素购自美国Hyclone公司,Ⅰ型胶原酶购自美国Sigma公司,兔抗人波形蛋白和鼠抗人角蛋白购自北京中杉金桥公司,28RS低温高速离心机和3180FCO2培养箱购自德国Heraus公司,DMIRB倒置相差显微镜购自德国Leica公司,细胞粒度分析及计数仪购自美国Beck-man Coulter公司。
1.2HPDLCs的培养、纯化及鉴定
取口腔门诊12~16岁患者正畸前磨牙牙冠立即放入预冷的DMEM低糖培养基(含100 U/mL青霉素和100 U/mL链霉素)中快速移至超净台,将牙冠取出放入75%乙醇浸泡约1 min,用PBS液反复冲洗离体牙根面去除污物及乙醇,用预先配置的含10% FBS及双抗的DMEM低糖培养基润湿根面,刮取根中1/3牙周膜,剪成长、宽、高各约为1 mm的组织块放入15 mL的离心管中,并加入0.2%Ⅰ型胶原酶2 mL,放入CO2培养箱,每5 min取出摇匀,15 min后800 r/min离心3 min,将消化的组织块接种于60 mm的培养皿中,加入DMEM低糖培养基(含100 U/mL青霉素和100 U/mL链霉素)1~2 mL,于CO2培养箱中培养4 h后,再加入上述培养基4 mL继续原代培养,每3 d换液1次。使用倒置显微镜观察细胞,待组织块周围的细胞达到融合状态时,使用探针将组织块勾除,向培养皿中加入0.25%胰蛋白酶(含0.02% EDTA)4 mL,于37 ℃培养箱中消化4~5 min后加入双倍的完全培养基终止消化,移液枪吹打皿底使细胞脱落后收集于15 mL的离心管中,1 000 r/min离心5 min,弃上清液,加入含15% FBS完全培养基5 mL,将细胞吹打至重悬后接种于培养瓶中继续培养及纯化,每4~5 d换液1次。取第4代细胞通过免疫组化检查进行细胞鉴定。
1.3绘制HPDLCs生长曲线
取生长至第4代的HPDLCs,使用0.25%的胰蛋白酶消化,离心后弃去上清液,加入含20% FBS的培养基后重悬细胞,以2×105个/mL的量接种于24孔板中,放入培养箱,每2 d对细胞进行1次换液,后每24 h消化3孔对细胞进行计数,取3孔细胞计数的平均值进行计数,连续计数7 d,根据得到的细胞计数绘制细胞生长曲线图。
1.4体外加载FSS
取培养至第5代的HPDLCs接种于载玻片上,放于加力装置流动腔室的预备槽中,通过调节蠕动泵上的流速对细胞施加不同的FSS(0、5、8、12及15 r/min),加载时间分别为1、2及6 h。
1.5检测HPDLCs中COX-2
取出载玻片,PBS振洗,依次予4%多聚甲醛固定30 min、3% H2O2去离子水孵育、滴加封闭血清孵育、滴加稀释的COX-2一抗工作液、4 ℃过夜,SP1000通用型二抗,室温孵育4 h,滴加新鲜配置的DAB显色剂(DAB底物液1 mL加DAB浓缩液50 μL,混合均匀),在室温下置暗处,自来水冲洗,苏木素复染,冲洗。酒精逐级脱水,充分干燥,树胶封片,倒置显微镜下观察COX-2蛋白颗粒染色情况,选取较为清晰的视角使用成像设备拍照用于分析其灰度值。
1.6统计学方法
免疫组化标本经image-pro Plus 6.0图像分析软件进行分析,每个标本随机选取10个高倍视野测定其灰度值,灰度值<250为阳性。数据采用SPSS10.5软件包进行统计分析,两两比较采用单因素方差分析中最小显著差异法(LSD)及单因素多水平方差分析(SNK),以P<0.05有统计学意义。
2结果
2.1细胞鉴定
对第4代培养HPDLCs细胞进行免疫组化染色显示,抗波形蛋白呈阳性(细胞内可见大量棕黄色颗粒)及抗角蛋白呈阴性(细胞内未见颗粒,苏木素染色呈淡蓝),可鉴定为HPDLCs。见图1。
2.2HPDLCs生长曲线
以细胞计数作为纵轴,细胞培养时间为横轴绘制HPDLCs生长曲线。从第3天开始,HPDLCs细胞的增殖速度明显加快,进入到对数生长期,到第7天HPDLCs细胞的数量达到顶峰。见图2。
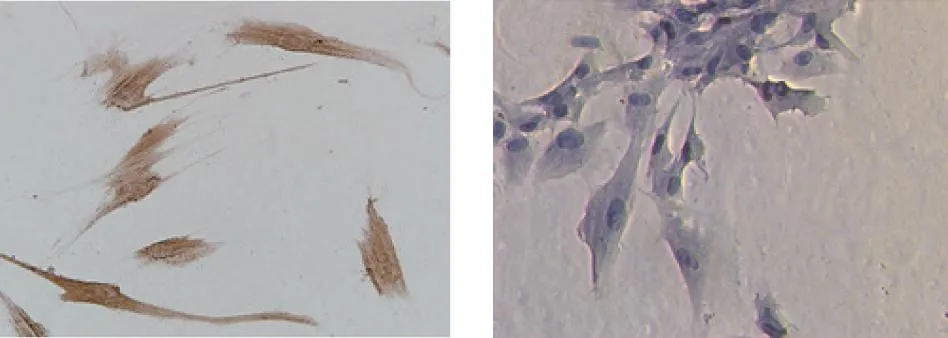
波形蛋白(免疫组化) 角蛋白(苏木素)图1 牙周膜HPDLCs细胞中波形蛋白及角蛋白表达Fig.1 Vimentin and learatin expression in HPDLCs
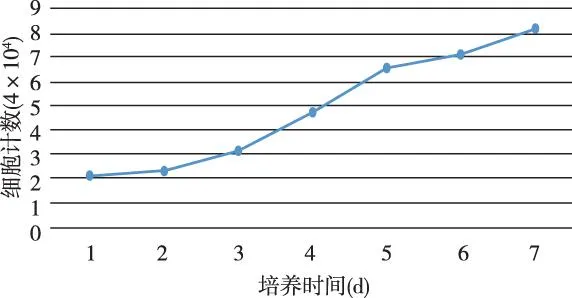
图2 牙周膜HPDLCs生长曲线图 Fig.2 Grouth curre of HPDLCs
2.3HPDLCs中COX-2表达
HPDLCs的COX-2表达因加力的大小与时间不同而不同,未加力组HPDLCs染色后无阳性颗粒显色,而加力组均呈现不同程度的阳性反应,镜下可见COX-2均分布于 HPDLCs胞质中,呈棕黄色颗粒存在。4组加力组(5、8、12及15 r/min)加力1 h后,均可见细胞中有少许阳性颗粒出现;加力2 h后,细胞中的棕色颗粒逐渐加深,数量也在增多,其中12 r/min组中阳性率较高,染色颗粒呈深棕色;当加力到6 h后,阳性颗粒较2 h时浅且呈降低态势,其中15 r/min组的细胞因加力时间过长、力值过大,使得细胞形态发生变化,由正常的长梭形皱缩成偏圆形,见图3。不同加载力及不同时间 HPDLCs的COX-2灰度值明显不同,加载1 h时,加载力8 r/min的灰度值最高,其次为15 r/min和5 r/min,12 r/min的灰度值最低;加载2 h时,5 r/min的灰度值最高,其次为15 r/min和8 r/min,12 r/min的灰度值最低;加载6 h时,8 r/min和15 r/min的灰度值为最高值,5 r/min的灰度值表达最低。见表1。
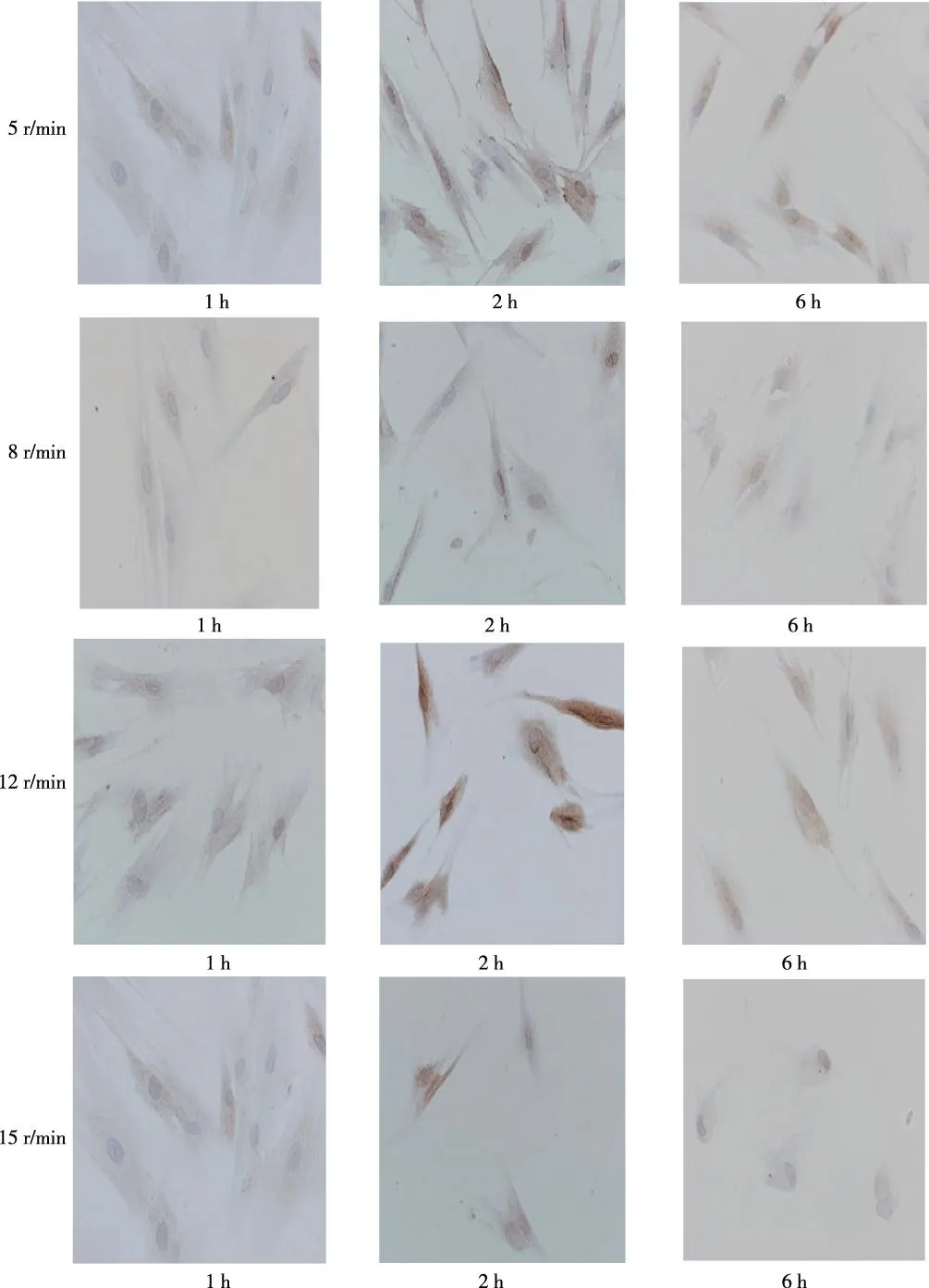
图3 不同程度加力及时间HPDLCs胞质中COX-2表达Fig.3 The expression of COX-2 in different stress and time in the cytoplasm of HPDLCs
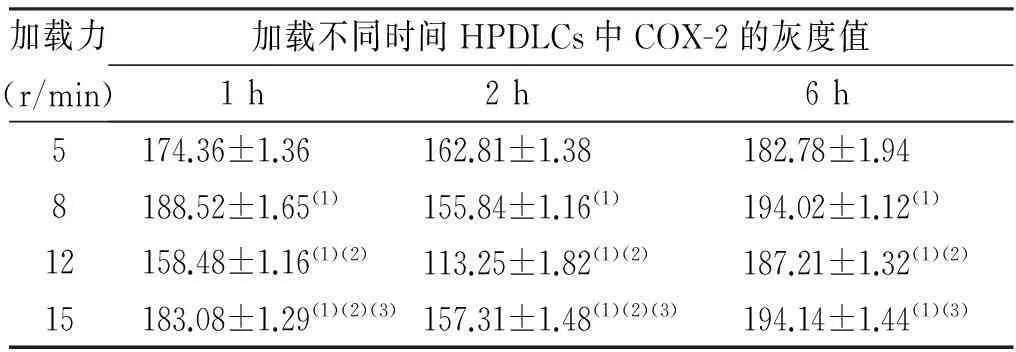
加载力(r/min)加载不同时间HPDLCs中COX-2的灰度值1h2h6h5174.36±1.36 162.81±1.38182.78±1.948188.52±1.65(1)155.84±1.16(1)194.02±1.12(1)12158.48±1.16(1)(2)113.25±1.82(1)(2)187.21±1.32(1)(2)15183.08±1.29(1)(2)(3)157.31±1.48(1)(2)(3)194.14±1.44(1)(3)
(1)与5 r/min比较、(2)与8 r/min比较及(3)与12 r/min比较,P<0.01
3讨论
在错颌畸形矫治的过程中,牙齿移动的基础是牙周组织的重塑与改建,HPDLCs位于牙周膜中,介于牙齿与牙槽骨之间,在正畸过程中是最先感受到力的细胞[4],通过一些生物化学信号的传递开始骨改建。在机械力的刺激下,HPDLCs做出相应的应答,李晓彤等[6]的研究表明,体外对HPDLCs施加机械力,可以检测出成骨样细胞蛋白的表达,提示HPDLCs在机械力诱导下向成骨样细胞分化成熟,从而在正畸力介导的骨改建中发挥作用,调控牙槽骨的形成或吸收。本研究以HPDLCs作为研究对象,检测其在受到机械应力时的增殖、分化以及主要参与骨改建蛋白的变化,为力学信号在牙周膜中传导机制及骨改建提供参考。有实验证明,当正畸力通过牙齿传导到牙周组织上时,牙周组织会释放出各种大分子蛋白、酶参加骨改建,已知的有前列腺素E2、IL-1等[7-8]。前列腺素E2是一种非饱和脂肪酸,它可以通过自分泌和旁分泌的方式,与牙周膜细胞进行相互作用,在其不同浓度的情况下,促进破骨过程或成骨过程,使两种状态达到一个动态平衡,从而参与牙槽骨的改建。COX-2是花生四烯酸(AA)合成前列腺素E2的限速酶,参与了前列腺素E2的激活,进而介导了细胞力信号作用后骨改建的发生。研究证明,COX-2和前列腺素E2是机械应力刺激骨改建所必需的,选择性抑制COX-2表达,可以阻断机械应力诱导的体内骨的形成;在生理过程中,HPDLCs不分泌COX-2,而对体外培养的HPDLCs施加FSS,可以促使HPDLCs分泌COX-2[9]。
体外培养细胞的力学实验根据不同的施加方式,可分为:压力载荷法、机械拉伸法、流体剪切法和离心力培养法等[10-14]。Schwarz[15]认为牙周膜组织是个连续的液态环境,组织液即细胞物质交换的媒体又是传递和缓冲应力的介质。当牙齿受力发生位移时,必然挤压牙周膜引起组织液的液压迅速改变。有学者认为,细胞对FSS的反应比对压力及牵张力的反应敏感得多,细胞对外力的反应是因为外力导致组织间液流动改变,从而被细胞感知[16]。FSS具有明确而恒定的方向性,使得受力的细胞发生相应的排列改变[17]。静压力由于没有明显的方向性,所以不能改变细胞的排列方向。周期性牵张力的动态效果也造成细胞贴壁不牢,细胞骨架收缩,细胞体积变小[18]。就牙周的应力环境来看,体外施加FSS更能模拟整个牙移动时牙周膜所受到的机械力。本研究使用的流体剪切力加力装置通过精密的计算,可将加载的流体转算转换成离体细胞所受到的具体力值大小。通过对体外培养的HPDLCs施加不同大小和不同加载时间的FSS,检测HPDLCs中COX-2蛋白的表达变化,以寻找诱导HPDLCs在牙移动的整个骨改建过程中发挥作用的最佳作用力值和产生作用时间,加载力为12 r/min、加载时间2 h时,COX-2蛋白的表达最高,通过公式平均剪切力τ= 6ηQ/h2w计算得出FSS为46.00 g。46.00 g,2 h 的加载条件有利于研究HPDLCs在正畸牙移动的整个骨改建过程中的作用,为研究正畸力作用下骨组织改建提供实验依据。
4参考文献
[1] Pro P,Pmer P.The molecular mechanism behind bone remodeling a review[J]. Clin Oral Investing, 2009(4):355-362.
[2] Xie R, Kuijpers-Japtman AM, Maltha JC. Osteodast differentation and recruitment during early stages of experimental tooth movement in rats[J].Oral Sd, 2001(117):43-50.
[3] 杜红江,陈学鹏,严洪海.丹参对人牙周膜成纤维细胞骨保护素表达的影响[J].上海口腔医学, 2010(5):530-534.
[4] 贾莹, 陈波, 廖健, 等.间歇性张应力对牙周膜成纤维细胞蛋白合成功能的影响[J].贵阳医学院学报, 2005(1):30-33.
[5] 张广道,洪岩松,艾红军.纤维粘连蛋白与流体剪切力对体外培养的牙周膜成纤维细胞COX-2表达的影响[J].上海口腔医学, 2007(3):290-295.
[6] 李晓彤,张丁,傅民魁,等.机械牵张力对牙周膜成纤维细胞成骨样细胞功能的影响[J].中华口腔医学杂志, 2002(2):135-138
[7] Rosenberg N.The role ofthe eytoskeleton in mechanotransduction in hum osteoblast-like cells[J].HuIll Exp Toxicol, 2003(22):271-274.
[8] 袁琳,周伟东.力增强影响大鼠牙周组织前列腺素(PGE2)表达变化的研究[J].临床口腔医学杂志, 2008(3):133-135.
[9] 骆泉丰,王兴.PGE2在骨生成和骨改建中的作用[J].现代口腔医学杂志, 2005(9):518-521.
[10]魏志刚.口腔正畸过程生物力学建模仿真研究[J].中国生物医学工程学报, 2009(28):226-230.
[11]Von den Hoff JW.Efiects of mechanical tension on matrix degradation by human periodontal ligament ceils cultured in collagen gels[J].Periodontal Res, 2003(5):449-457.
[12]Yamaguchi M,Shimizu N,Ozawa Y,et al.Effect of tension-force on plasminogen activator activity from human periodontal ligament cells[J]. Periodontal Res, 1997(32):308-314.
[13]Redlich M,Asher Roos H,Reichenberg E,et al.Expression of tropoelastin in human periodontal ligament fibroblasts after simulation of orthodontic force[J].Arch Oral Bi, 2004(49):119-124.
[14]Bolcato-BeIlemin AL,Elkaim R,Abehsera A,et al.Expression of mRNAs encoding for alpha and beta integrinsubunits,MMPs,and TIMPs in stretched human periodontal ligament and gingival fibroblasts[J].Dent Res, 2000(79):1712-1718.
[15]Qu Q,Perala-Heape M,Kapanen A,et al.Estrogen enhances differentiation of osteoblasts in mouse bone marrow culture[J].Bone, 1998(209):201-209.
[16]Chandrasekharan NV,Dai H,Roos KL,et al.COX-3,a cyclooxygenase-1 variant inhibited by acetaminophen and other analgesic/antipyretic drugs: cloning, structure, and expression[J].Proc Natl Acad Sci USA, 2002(21):13926-13931.
[17]杨美祥.不同应力对人牙周膜成纤维细胞细胞骨架影响的体外研究[J].中国临床康复, 2005(23):3162-3164.
[18]韩文利,陈新民.机械拉伸下人牙周膜成纤维细胞增殖动力学变化的研究[J].华西医科大学学报, 2000(31):149-151.
(2016-01-15收稿,2016-03-28修回)
中文编辑: 戚璐; 英文编辑: 刘华
Effect of Different Fluid Shear Stress on Protein Expression of COX-2 Secreted by HPDLCs
WU You, ZHANG Junmei
(DepartmentofStomatology,theAffiliatedHospitalofGuizhouMedicalUniversity,Guiyang550004,Guizhou,China)
[Abstract]Objective: To explore the effect of fluid shear stress (FSS) on the cyclooxygenase2 (COX-2) secreted by human periodontal ligament fibroblast (HPDLC) cultured in vitro. Methods: The HPDLCs cultured in vitro were placed in flow chamber system of fluid shear stress (FSS) and 0, 5, 8, 12 and 15 r/min of fluid shear stress were applied to HPDLCs for 0 h, 1 h, 2 h and 6 h, respectively. The immunohistochemistry was used to detect the expression level of COX-2 protein secreted by HPDLCs, and gray value of protein quantity was analyzed. Results: Under the action of fluid shear stress (FSS), expression of COX-2 protein in human periodontal ligament fibroblast (HPDLF) was enhanced. And when 12 r/min was applied for 2 h, the expression level of COX-2 protein reached the peak. Conclusion: The application of fluid shear stress (FSS) in vitro can affect the expression of COX-2 protein secreted by human periodontal ligament fibroblast (HPDLF).
[Key words]fluid shear stress; cyclooxygenase 2; periodontal ligament; fibroblast
[中图分类号]R783.5
[文献标识码]A
[文章编号]1000-2707(2016)04-0441-05
*[基金项目]贵阳市科技局基金[筑科合同(20151001)]
**贵州医科大学2013级硕士研究生
***通信作者 E-mail:zjm46688@126.com
网络出版时间:2016-04-20网络出版地址:http://www.cnki.net/kcms/detail/52.5012.R.20160420.1834.040.html

