PEG胁迫对木薯叶片形态、生理及根系解剖结构的影响
魏云霞 王晓庆 黄洁


摘 要 为探讨木薯的干旱响应,采用0(CK)、10%、20%、30% PEG模拟法,研究干旱对木薯叶片形态、生理,以及根系解剖结构等的影响。结果表明,与CK相比,在30% PEG处理下,木薯叶片均萎蔫、下垂。除SC205游离脯氨酸含量在30% PEG处理下降外,3份种质叶片的O2-产生速率、游离脯氨酸含量均随PEG浓度提高而明显提高。在PEG胁迫下,Rayong9叶片的可溶性蛋白含量无明显变化,CMR35-22-196的显著提高,SC205的明显降低。3份种质在20% PEG和30% PEG处理下,均出现表皮或薄壁细胞残缺、根冠脱落现象;且Rayong9在30% PEG处理下,根系出现细胞程序性死亡,SC205、CMR35-22-196在20%和30% PEG处理下,根系出现细胞程序性死亡、表皮细胞栓化。可见,干旱胁迫对木薯生长不利,胁迫越强,危害越大。
关键词 木薯;种质;干旱胁迫;聚乙二醇;形态;生理;解剖结构
中图分类号 S533 文献标识码 A
Influence of PEG Stress on the Morphology and Physiology of
Leaf and Anatomical Structure of Root of Cassava
WEI Yunxia, WANG Xiaoqing, HUANG Jie*
Tropical Crops Genetic Resources Institute, Chinese Academy of Tropical Agricultural Sciences / Key Laboratory of
Conservation and Utilization of Cassava Genetic Resources, Minstry of Agriculture, Danzhou, Hainan 571737, China
Abstract The purpose of this study was to investigate the variation of different cassava germplasms responding to drought stress. The leaf morphology, leaf physiology and root anatomical structure of three cassava germplasms, namely Rayong9, SC205 and CMR35-22-196, were evaluated, under drought stress using 0(CK), 10%, 20% and 30% of PEG solutions. The results showed that the leaves of the three germplasms became wilting and drooping at the 30% PEG. The O2- production rate and the free proline contents of the three germplasms increased with the increasing of PEG, except for the free proline content of SC205 decreased at the 30% PEG. When compared with the 0 PEG, PEG stress affected slightly the soluble proteins content of Rayong9, while, those of SC205 and CMR35-22-196 were decreased and increased dramatically, respectively. The epidermis or parenchyma cells of root of the three germplasms, were incomplete and the root cap came off at the 20% and 30% PEG, when compared with the 0 PEG. Simultaneously, the programmed death cells in root were appeared for Rayong9 at the 30% PEG, while, the programmed death cells and suberisated epidermis were both appeared for SC205 and CMR35-22-196 at the 20% and the 30% PEG. In short, drought stress was bad for the growth of cassava, and the damage was getting worse with the aggravating drought stress.
Key words Cassava;Germplasms;Drought stress;Polyethylene glycol;Morphology;Physiology;Anatomical structure
doi 10.3969/j.issn.1000-2561.2016.02.013
木薯(Manihot esculenta Crantz.)是世界热带农业的重点发展对象,又是中国重要的热带作物。发展木薯产业,对中国饲料、粮食、淀粉、能源方面有着重要的意义[1]。然而,在中国,木薯苗期易受干旱影响,从而导致木薯大幅减产[2-3],不利于木薯产业的发展和扩大。
干旱胁迫下,作物形态结构、生理特性、器官解剖结构等会发生变化,以阻止、降低或修复胁迫造成的损伤[4-7]。植物根系首先感受到胁迫,是研究抗旱性、耐旱性的重要部位[8]。而不同的作物种类、品种,甚至同一品种的不同生育时期,都可能表现出不同的抗旱响应和机制[9-11]。于晓玲等[4]指出,干旱胁迫引起木薯叶片萎蔫,直至脱落;单忠英等[12]研究表明,‘新选048木薯的脯氨酸及可溶性蛋白质含量随干旱胁迫强度增加而增加;刘艳等[13]发现,干旱胁迫下,甘草(Glycyrrhiza uralensis Fisch.)根系细胞核发生变形,染色质凝聚并边缘化分布。目前,关于干旱胁迫对木薯叶片形态、生理特性的影响已有一些报道[4,12,14],然而,国内未见不同木薯种质对干旱胁迫响应的比较,以及干旱胁迫对木薯根系解剖结构影响的研究报道。
聚乙二醇(PEG-6000)有很强的亲水性,是模拟土壤干旱较为理想的渗透调节剂[15],因其模拟干旱胁迫与土壤控水的结果较为一致[16],而被广泛用于植物的抗旱性研究[5,15]。本研究以木薯Rayong9、SC205、CMR35-22-196为研究对象,采用0、10%、20%及30%PEG-6000模拟干旱,研究干旱胁迫下木薯叶片形态、生理及根系解剖结构的变化;以期为木薯抗旱研究提供参考和依据。
1 材料与方法
1.1 材料
为研究干旱胁迫对木薯的影响,于2011年8~10月在位于海南省儋州市的中国热带农业科学院热带作物品种资源研究所(品资所)木薯基地采用盆栽试验进行了干旱胁迫模拟研究。通过在品资所木薯种质圃田间评价,并结合反复干旱-复水初步筛选,选取不同抗旱类型的Rayong9、SC205、CMR35-22-196,3份种质参试。2011年8月1日,每份种质培育50盆,每盆直插1条种茎,种茎长度为(15.0±0.5)cm。塑料盆直径13.0 cm、高度12.0 cm,每盆装入0.8 kg混合基质(V河泥 ∶ V腐熟椰糠=1∶3)。1个月后,每份种质选取其中生长健康、长势、株高基本一致的幼苗36盆,用纯水小心冲去花盆中基质,至完整取出幼苗,小心洗净根系后,将其置于直径8.5 cm、高度14.0 cm的水杯中,种茎基部离杯底5 cm,每杯固定1株苗,并装入200 mL Hoagland营养液,放入人工气候培养箱内恢复培养14 d。
1.2 试验设计
恢复培养结束后,用Hoagland营养液配制浓度为0%(CK)、10%、20%、30%的 PEG-6000溶液,对3份种质进行为期72 h的模拟干旱胁迫处理。每份种质的4个处理均设3次重复,每重复3株。每12 h更换1次相应浓度的PEG-6000溶液,以减少浓度误差。
1.3 测定项目及方法
形态观察:胁迫结束时,观察、记载各处理幼苗叶片是否萎蔫、下垂。
生理指标:形态观察结束后,分别取各重复的3株幼苗顶部4片展开叶,用蒸馏水冲洗除去表面污物,并用吸水纸吸干叶片表面水分,混合叶片后进行生理指标测定。其中,O2-产生速率采用羟胺氧化反应法测定[17],可溶性蛋白含量采用考马斯亮蓝G-250染色法测定[18],游离脯氨酸含量采用茚三酮显色法测定[18]。
根系解剖结构:采集各重复叶片的同时,剪取各重复的3株幼苗新生白色根尖,用于制备横切、纵切石蜡切片,每株幼苗均需制备1张完整横切片和1张完整纵切片,以观察根系结构。石蜡切片采用蒋道松[19]的方法,经FAA固定、梯度乙醇脱水、正丁醇透明、石蜡包埋。用切片机(Leica RM2245,德国)切片,切片经二甲苯脱蜡、固绿染色、乙醇梯度脱水、中性树胶封片后,在显微镜(Nikon 正置显微镜 eclipse CI,日本)下观察,并采集照片。
1.4 数据处理与统计分析
采用Excel 2013进行数据整理及制图,SPSS 20.0软件进行方差分析。
2 结果与分析
2.1 对叶片形态的影响
与CK相比,在10%PEG、20%PEG处理下,3份种质的叶片形态无明显变化;在30%PEG处理下,均出现叶片萎蔫、下垂症状,下部叶片尤为严重,并出现黄化现象。
2.2 对叶片生理指标的影响
2.2.1 对叶片O2-产生速率的影响 由图1可知,与CK相比,PEG浓度越高,3份种质的O2-产生速率及O2-产生速率增幅越大,Rayong9、SC205、CMR35-22-196的O2-产生速率增幅范围分别为506.92%~5069.18%、77.11%~333.00%、13.55%~216.76%。在CK处理下,3份种质的O2-产生速率高低表现为CMR35-22-196≈SC205>Rayong9;在10%PEG和20%PEG处理下表现为SC205>Rayong9>CMR35-22-196,在30%PEG处理下,表现为Rayong9>SC205>CMR35-22-196。在相同浓度PEG处理下,3份种质的O2-产生速率增幅均表现为Rayong9>SC205>CMR35-22-196。
2.2.2 对叶片可溶性蛋白含量的影响 由图2可知,与CK相比,在PEG胁迫处理下,3份种质的可溶性蛋白含量变化规律不同,其中,Rayong9可溶性蛋白含量无明显变化;SC205可溶性蛋白含量降低13.94%~24.97%;CMR35-22-196可溶性蛋白含量随PEG浓度增加而提高,增幅达8.20%~75.57%。在相同浓度PEG处理下,Rayong9可溶性蛋白含量均明显高于SC205、CMR35-22-196。
2.2.3 对叶片游离脯氨酸含量的影响 由图3可知,与CK相比,在PEG胁迫处理下,3份种质的游离脯氨酸含量均明显提高,除SC205游离脯氨酸含量在30 %PEG处理下降外,3份种质的游离脯氨酸含量均随PEG浓度增加而增加。在CK、10% PEG、20% PEG处理下,3份种质的游离脯氨酸含量高低排序为SC205>CMR35-22-196>Rayong9,30% PEG处理下为Rayong9>CMR35-22-196>SC205。与CK相比,在10%PEG处理下,3份种质的游离脯氨酸含量增幅高低排序为CMR35-22-196>SC205>Rayong9;在20%PEG、30%PEG处理下,3份种质的游离脯氨酸含量增幅高低排序与相应PEG处理下游离脯氨酸含量高低排序一致。
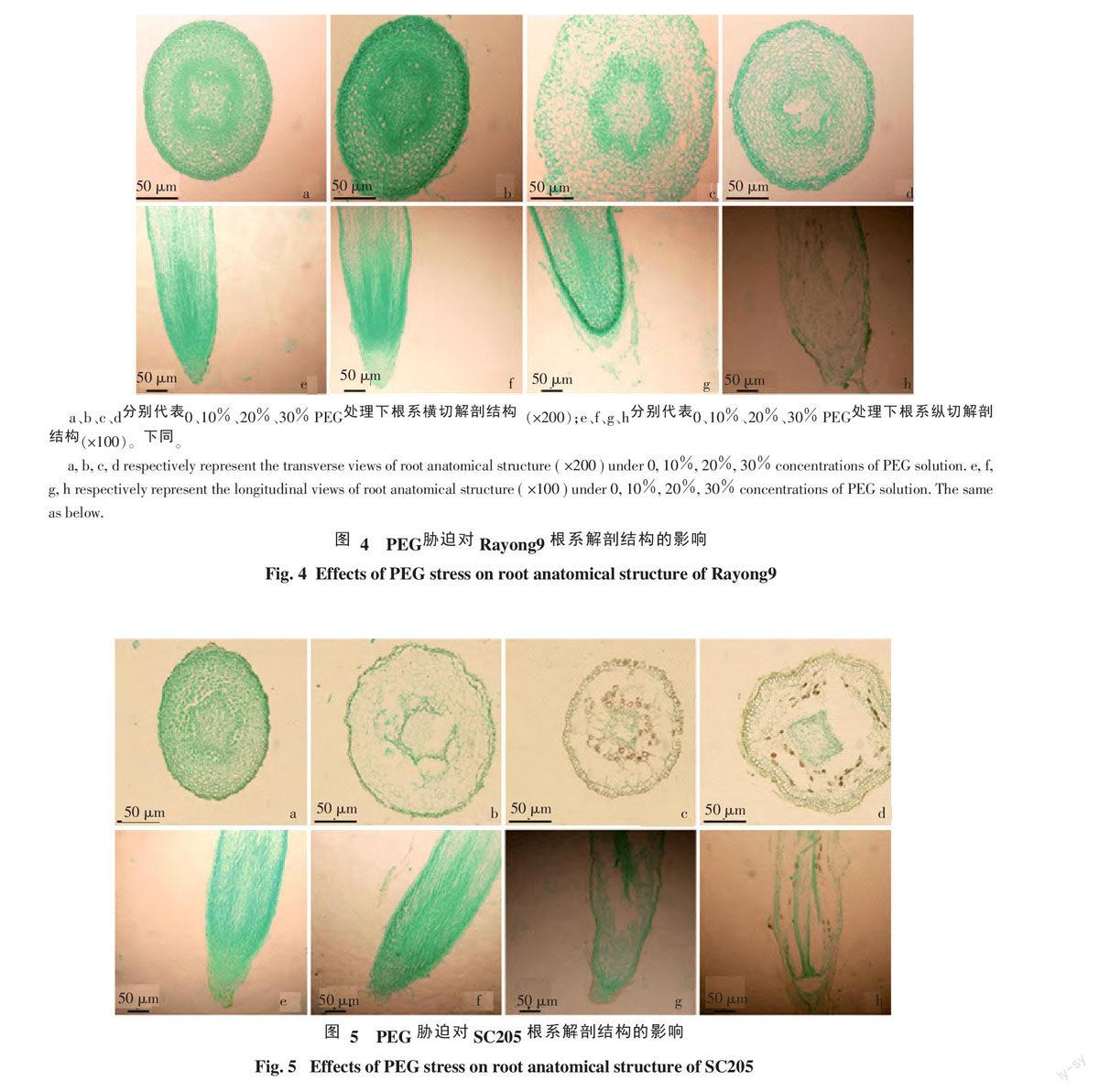
2.3 对根系解剖结构的影响
与CK相比,10% PEG处理下(图4~6的b、图4~6的f),3份种质的根系解剖结构均无明显变化;但在20% PEG、30% PEG处理下,3份种质的根系解剖结构有不同变化趋势。Rayong9在20% PEG处理下(图4-c、图4-g),根系部分薄壁细胞残缺、根冠脱落;在30% PEG处理下(图4-d、图4-h),根冠脱落、染色质凝聚并边缘化分布。SC205和CMR35-22-196在20% PEG(图5~6的c、图5~6的g)、30% PEG处理下(图5~6的d、图5~6的h),染色质凝聚并边缘化分布、表皮细胞栓化、栓化程度随PEG浓度增加而加强。此外,SC205在20% PEG处理下(图5-g)根冠细胞残缺,在30% PEG处理下(图5-d、图5-h)根系薄壁细胞及伸长区表皮细胞残缺,而CMR35-22-196在20% PEG(图6-c、图6-g)、30% PEG(图6-d、图6-h)处理下整个根系表皮细胞残缺。在相同浓度PEG处理下,SC205、CMR35-22-196根系解剖结构的变化程度强于Rayong9根系解剖结构的变化程度。
3 讨论与结论
3.1 叶片生理指标对干旱胁迫的响应
O2-的增加能引起膜损伤和脂质过氧化,当其积累超过一定程度,将会影响到植物的正常生长[20];且抗旱性强的品种O2-含量增加较慢,增幅较小,抗旱性弱的品种则相反[21]。干旱胁迫下,维持正常的可溶性蛋白浓度或产生新的蛋白、增加脯氨酸含量等是植物适应干旱胁迫的重要机制[9,22]。本研究中,PEG胁迫下,3份木薯种质的O2-产生速率及其增幅均随PEG浓度增加而显著提高,与干旱胁迫对诸葛菜(Orgchophragmus violaceus)[23]、夏腊梅(Calycanthus chinensis)O2-产生速率的影响研究一致[24];Rayong9可溶性蛋白含量维持稳定,CMR35-22-196的明显提高,而SC205的明显降低;3份种质的游离脯氨酸含量明显提高,与干旱胁迫显著提高诸葛菜[23]、花生(Arachis hypogaea Linn.)[25]游离脯氨酸含量的结果一致,且除SC205游离脯氨酸含量在30% PEG处理下降外,3份种质的游离脯氨酸含量均随PEG浓度增加而增加,这与重度胁迫下脯氨酸积累可能下降[26-27]的结果吻合。针对3项生理指标运用模糊数学隶属函数值法[28]对3份种质抗旱性强弱进行综合评价可知,10%和20% PEG胁迫下,3份种质抗旱性强弱排序为CM35-22-196>SC205>Rayong9;30%PEG胁迫下则为CM35-22-196>Rayong9>SC205。
3.2 根系解剖结构对干旱胁迫的响应
栓化的细胞可以保护植物内部细胞,有效防止水分散失,保护根系免受干旱的伤害[6-7];且干旱等逆境下植物细胞会发生程序性死亡,以抵御逆境[29]。本研究中,干旱胁迫下,3份木薯种质的根系结构均出现表皮或薄壁细胞残缺、根冠脱落现象,与水曲柳(Fraxinus mandshurica Rupr.)根系在干旱胁迫下的表现现象相似[30];在相同浓度PEG处理下,SC205、CMR35-22-196根系解剖结构的变化程度都大于Rayong9,推测干旱胁迫对SC205、CMR35-22-196根系结构的影响程度可能大于Rayong9。干旱胁迫下,Rayong9根系出现细胞程序性死亡;而SC205、CMR35-22-196不仅根系出现细胞程序性死亡,还出现根系表皮细胞栓化。这可能是3份种质通过根系结构变化应对干旱胁迫的机制存在一定的差异。在PEG胁迫下,木薯种质通过根系细胞程序性死亡应对干旱的机制与甘草[13]、 苹果(Malus sieversii(Ledeb)Roem.)[31]等应对干旱的机制相似;而SC205、 CMR35-22-196通过根系表皮细胞栓化抵御干旱的机制与水稻(Oryza sativa L.)[6]应对干旱的机制又有相似之处。
3.3 其他
从本研究可以看出,与CK相比,当木薯种质叶片形态、叶片生理指标、根系解剖结构出现明显变化时,其起始PEG浓度是不同的。木薯种质在30% PEG胁迫下,叶片形态出现明显变化;自10% PEG胁迫起,叶片生理生化特性出现明显变化;自20% PEG胁迫起,根系解剖结构发生明显变化。孙彩霞等[32]认为,水分胁迫下,植物在生理、细胞结构发生适应改变后,最终在植株形态上有所表现。推测,木薯的形态、生理、解剖结构对抗旱响应的敏感性不同,敏感性强弱顺序为生理>解剖结构>形态。
综上所述,干旱胁迫对木薯生长不利,胁迫程度越强,危害越大。木薯形态、生理指标、根系解剖结构等都会对干旱胁迫做出响应。
参考文献
[1] 濮文辉. 世界木薯业发展与研究[J]. 世界热带农业信息, 2007(10): 1-5.
[2] 李一萍, 黄 洁, 许瑞丽, 等. 干旱胁迫下水杨酸和油菜素内酯对木薯苗生理特性的影响[J]. 热带农业科学, 2013, 33(10): 6-11, 15.
[3] 黄 洁, 叶剑秋, 李开绵, 等. 木薯苗期淋水试验初报[J]. 广西热带农业, 2005(4): 18-19.
[4] 于晓玲, 王 淦, 阮孟斌, 等. 水分胁迫对不同木薯品种叶片生理生化的影响[J]. 中国农学通报, 2012, 28(33): 60-64.
[5] 冯惠芳, 薛 立, 任向荣, 等. 4种阔叶幼苗对PEG模拟干旱的生理响应[J]. 生态学报, 2011, 31(2): 371-382.
[6] 孔 妤, 王 忠, 熊 飞, 等. PEG胁迫下水稻根外皮层厚壁细胞的解剖学研究[J]. 扬州大学学报, 2008, 29(1): 61-65.
[7] 杨朝东, 张 霞, 刘国锋, 等. 植物根中质外体屏障结构和生理功能研究进展[J]. 植物研究, 2013, 33(1): 114-119.
[8] 景蕊莲, 胡荣海. 作物抗旱性的根系研究[J]. 麦类作物学报, 1995(3): 37-39.
[9] 康俊梅, 杨青川, 樊奋成. 干旱对苜蓿叶片可溶性蛋白的影响[J]. 草地学报, 2005, 13(3): 199-202.
[10] Fukai S, Pantuwan G, Jongdee B, et al. Screening for drought resistance in rainfed lowland rice[J]. Field Crops Research, 1999, 64(1): 61-74.
[11] 杨永杰, 张彩霞, 宋 建, 等. 花期干旱胁迫对籼稻近等基因系水分和光合生理的影响[J]. 中国农业科学, 2013, 46(7): 1 481-1 491.
[12] 单忠英, 罗兴录, 樊吴静, 等. 干旱胁迫对木薯生理特性影响研究[J]. 热带作物学报, 2015, 36(2): 339-343.
[13] 刘 艳, 岳 鑫, 陈贵林. 水分胁迫对甘草叶片和根系细胞超微结构与膜脂过氧化的影响[J]. 草业学报, 2010, 19(6): 79-86.
[14] 周 芳, 刘恩世, 孙海彦, 等. 前期干旱锻炼对木薯根系内源激素及可溶性糖含量的影响[J]. 热带作物学报, 2013, 34(3): 486-494.
[15] 德 英, 赵来喜, 穆怀彬. PEG-6000渗透胁迫下应用电导法对披碱草属种质幼苗抗旱性初步研究[J]. 中国农学通报, 2010, 26(24): 173-178.
[16] Lawlor D W. Absorption of polyethylene glycol by plants and their effects on plant growth[J]. New Phytologist, 1970, 69(2): 501-513.
[17] 王爱国, 罗广华. 植物的超氧自由基与羟胺反应的定量关系[J]. 植物生理学通讯, 1990(4): 62-65.
[18] 李合生. 植物生理生化实验原理及技术[M]. 北京: 高等教育出版社, 2000: 184-185, 258-260.
[19] 蒋道松, 周朴华. 植物学实验指导[M]. 长沙: 湖南农业大学植物科学实验教学中心, 2007: 49-58.
[20] Souza R P, Machado E C, Silva J A B, et al. Photosynthetic gas exchange, chlorophyll fluorescence and some associated metabolic changes in cowpea(Vigna unguiculata)during water stress and recovery[J], Environmental and Experimental Botany, 2004, 51(1): 45-56.
[21] 王贺正, 马 均, 李旭毅, 等. 水分胁迫对水稻结实期活性氧产生和保护系统的影响[J]. 中国农业科学, 2007, 40(7): 1379-1387.
[22] 王 赞, 李 源, 高洪文, 等. 鸭茅苗期抗旱性综合评价[J]. 干旱地区农业研究, 2007, 25(6): 31-36.
[23] 李 莉, 钟章成. 诸葛菜对水分胁迫的生理生化反应和调节适应能力[J]. 西南师范大学学报(自然科学版), 2000, 25(1): 33-37.
[24] 柯世省, 金则新. 干旱胁迫对夏腊梅叶片脂质过氧化及抗氧化系统的影响[J]. 林业科学, 2007, 43(10): 28-33.
[25] 贺鸿雁, 孙存华, 杜 伟, 等. PEG 6000胁迫对花生幼苗渗透调节物质的影响[J]. 中国油料作物学报, 2006, 28(1): 76-78.
[26] 卫 星, 王政权, 张国珍, 等. 水曲柳苗木不同根序对干旱胁迫的生理生化反应[J]. 林业科学, 2009, 45(6): 16-21.
[27] Patakas A, Nikolaou N, Zioziou E, et al. The role of organic solute and ion accumulation in osmotic adjustment in drought-stressed grapevines[J], Plant Science, 2002, 163(2): 361-367.
[28] 郭改改, 封 斌, 麻保林, 等. 不同区域长柄扁桃叶片解剖结构及其抗旱性分析[J]. 西北植物学报, 20013, 33(4): 720-728.
[29] Jones A M. Programmed cell death in development and defense[J]. Plant Physiology, 2001, 125(1): 94-97.
[30] 卫 星. 干旱胁迫对水曲柳苗木细根衰老的影响[D]. 哈尔滨: 东北林业大学, 2008: 25-31, 50-61.
[31] 谭冬梅, 许雪锋, 李天忠, 等. 干旱胁迫诱导新疆野苹果细胞程序性死亡的细胞形态学研究[J]. 华北农学报, 2007, 22(1): 50-55.
[32] 孙彩霞, 沈秀瑛. 作物抗旱性鉴定指标及数量分析方法的研究进展[J]. 中国农学通报, 2002, 18(1): 49-51.

