对产胞内脂肪酶的发酵性丝孢酵母超声波透性化处理的条件优化
孙 珍, 刘雅文, 王 迪, 孙玉梅
大连工业大学 生物工程学院, 辽宁 大连 116034
对产胞内脂肪酶的发酵性丝孢酵母超声波透性化处理的条件优化
孙珍,刘雅文,王迪,孙玉梅*
大连工业大学 生物工程学院, 辽宁 大连 116034
摘要:发酵性丝孢酵母产胞内脂肪酶,为了把细胞整体作为脂肪酶催化剂,需对细胞进行透性化处理。利用超声波进行细胞透性化的适宜条件为:超声波输出功率180 W,每次辐射时间2 s(间歇时间5 s),工作总时间1.2 min,菌体浓度40 g/L,此条件下细胞通透性可明显改善,透性化细胞脂肪酶表现出较高活力。
关键词:发酵性丝孢酵母; 脂肪酶; 超声波; 细胞透性
脂肪酶是重要的工业酶制剂品种之一,能够在非水相系统中催化酯化、转酯、醇解和胺解等反应,催化效率高而副反应少,反应安全无毒,不需要辅助因子,这些优点使得脂肪酶被广泛应用在油脂加工、食品、医药、日化等领域[1-4]。发酵性丝孢酵母常用于发酵产油脂研究[5],其胞内产脂肪酶。细胞透性化技术是指不造成细胞裂解,在不破坏细胞内部有机结构的情况下改变细胞膜的通透性,使小分子量物质和一些较大分子物质能够自由进出细胞的技术。经过透性化处理的细胞称为透性化细胞,其在保持细胞整体结构完整的情况下提高了细胞的通透性,从而可使胞内酶在原位较好地发挥催化作用,又因胞内酶有一定保护作用,可延长酶的使用寿命[6,7]。细胞透性化处理包括化学法,生物法和物理法。
为了使发酵性丝孢酵母的胞内脂肪酶在不提取的情况下直接催化转酯化反应,我们使用物理法中的超声法对细胞进行透性化处理,以脂肪酶活力为考察指标,应用单因素实验以及正交实验进行透性化处理条件的优化。
1材料与方法
1.1材料与仪器
722-型分光光度计,上海精密科学仪器有限公司; PHS-3C精密pH计,上海雷磁仪器厂;78-1型磁力加热搅拌器,江苏金坛国华仪器厂;超声波破碎仪(JY99-2D),宁波新芝科器研究所。
实验用发酵性丝孢酵母菌种(CICC1368)来自中国食品发酵工业研究院。
1.2试验方法
1.2.1培养基配制
1.2.1.1固体斜面培养基(g/L)
葡萄糖20,酵母浸粉10,蛋白胨10,琼脂20,pH自然。于0.1 MPa灭菌15 min。
1.2.1.2种子培养基(g/L)
葡萄糖100,蛋白胨5.3,酵母浸粉2,尿素2,MgSO4·7H2O 0.5,pH自然。除尿素外的其余成分于0.08 MPa 灭菌20 min,尿素在0.05 MPa 灭菌15 min。
1.2.1.3发酵培养基(g/L)
葡萄糖100,蛋白胨1.8,酵母浸粉0.5,KH2PO42,植物油8.5,吐温-80 4.6,pH自然。于0.08 MPa 灭菌20 min。
1.2.2细胞的培养与处理
将4℃保存的菌种接种于固体斜面培养基上,于30 ℃培养48 h。取两环斜面培养的菌丝接入种子培养基中,于30 ℃、160 r/min 摇床培养24 h。向发酵培养基中接入10% (v/v)的液体种子,于30 ℃、160 r/min摇床发酵60 h,所得发酵液于4 ℃、10 000 r/min离心10 min,收集菌体,用0.067 mol/L、pH 6.8的磷酸盐缓冲液洗涤菌体3次,离心收集菌体。
1.2.3超声波法细胞透性化条件的研究
1.2.3.1透性化细胞的制备
按“1.2.2”所述方法,收集菌体,再与磷酸盐缓冲液混合,制得20 g/L的菌悬液。于冰水浴中,在设定条件下进行超声处理,温度设置4 ℃,10 000 r/min离心10 min,收集上清液。用磷酸盐缓冲液洗涤菌体沉淀2次,即为透性化细胞。
1.2.3.2超声波输出功率对细胞透性化的影响
设置超声波辐射时间为2 s、间隙时间为5 s、工作总时间为2 min,考察超声波输出功率分别为80 W、120 W、160 W、200 W和240 W的条件下进行透性化处理的效果。离心洗涤后得到上清液和透性化细胞,分别测定上清液和透性化细胞脂肪酶活力。
1.2.3.3超声波每次辐射时间对细胞透性化的影响
设置超声波输出功率为160 W、间隙时间为5 s,工作总时间为2 min,考察超声辐射时间分别为1 s、1.5 s、2 s、2.5 s和3 s的条件下进行透性化处理的效果。离心洗涤后得到上清液和透性化细胞,分别测定上清液和透性化细胞脂肪酶活力。
1.2.3.4超声波工作总时间对细胞透性化的影响
设置超声波输出功率为160 W、超声波每次辐射时间为2 s,间隙时间为5 s,考察超声工作总时间分别为0.2 min、0.5 min、1 min、2 min和3 min的条件下进行透性化处理的效果,离心洗涤后得到上清液和透性化细胞,分别测定上清液和透性化细胞脂肪酶活力。
1.2.3.5菌体浓度对细胞透性化的影响
按“1.2.2”所述方法,称取5份不同克数的菌体分别与25 mL磷酸盐缓冲液混合,制成菌体浓度为20 g/L、25 g/L、30 g/L、50 g/L和100 g/L的菌悬液,置于冰水浴中,在超声输出功率为160 W、辐射时间为2 s,间隙时间为5 s,工作总时间为1 min的条件下进行透性化处理,离心洗涤后得到上清液和透性化细胞,分别测定上清液和透性化细胞脂肪酶活力。
1.2.3.6细胞透性化正交试验
在单因素试验的基础上,以透性化细胞脂肪酶活性大小为考察指标,采用L9(34)正交表,进行4因素3水平的正交试验[8]。
1.2.4测定方法
1.2.4.1脂肪酶活力测定
(1) 反应底物(PVA)的制备:40 g聚乙烯醇(PVA)加热溶解在800 mL水中,冷却后定容至1 000 mL。用干净的双层纱布过滤。量取上述滤液150 mL,加入50 mL橄榄油,用高速匀浆机处理6 min(分两次处理,间隔5 min,每次3 min),即得乳白色PVA乳化液。该溶液现用现配[9]。
(2) 脂肪酶活力测定:采用酸碱滴定法定量测定。取两个100 mL三角瓶,分别于空白瓶(A)和样品瓶(B)中加入4 mL PVA橄榄油乳化液和5 mL磷酸盐缓冲液(0.067 mol/L,pH 6.8),再于A瓶中加入95%乙醇15 mL,于38 ℃水浴中预热5 min,然后于A、B瓶中各加入1 mL待测酶液,立即混匀,反应10 min,于B瓶中加15 mL 95%乙醇终止反应。于空白和样品溶液中各加两滴酚酞指示剂,用0.01 mol/L NaOH溶液滴定水解产生的脂肪酸[10]。
(3) 脂肪酶活力定义:在38 ℃、pH 6.8的反应条件下,将每分钟脂肪酶催化橄榄油水解产生1 μmol脂肪酸所需酶量,即被定义为一个脂肪酶活力单位[11]。
2结果与讨论
2.1细胞透性化单因素试验
2.1.1超声波输出功率对细胞透性化的影响
如图1可见,超声波输出功率对细胞透性化的影响较大。随着输出功率的增加,透性化细胞脂肪酶活力先升高后降低,在160 W达到极大值。输出功率反映了超声波能量的大小,输出功率的增加,有利于改善细胞通透性;但是输出功率过大,则会引起细胞破碎,导致细胞内脂肪酶释放到胞外,从而降低了透性化细胞的脂肪酶活力[12]。因此,选定超声波透性化的输出功率为160 W。
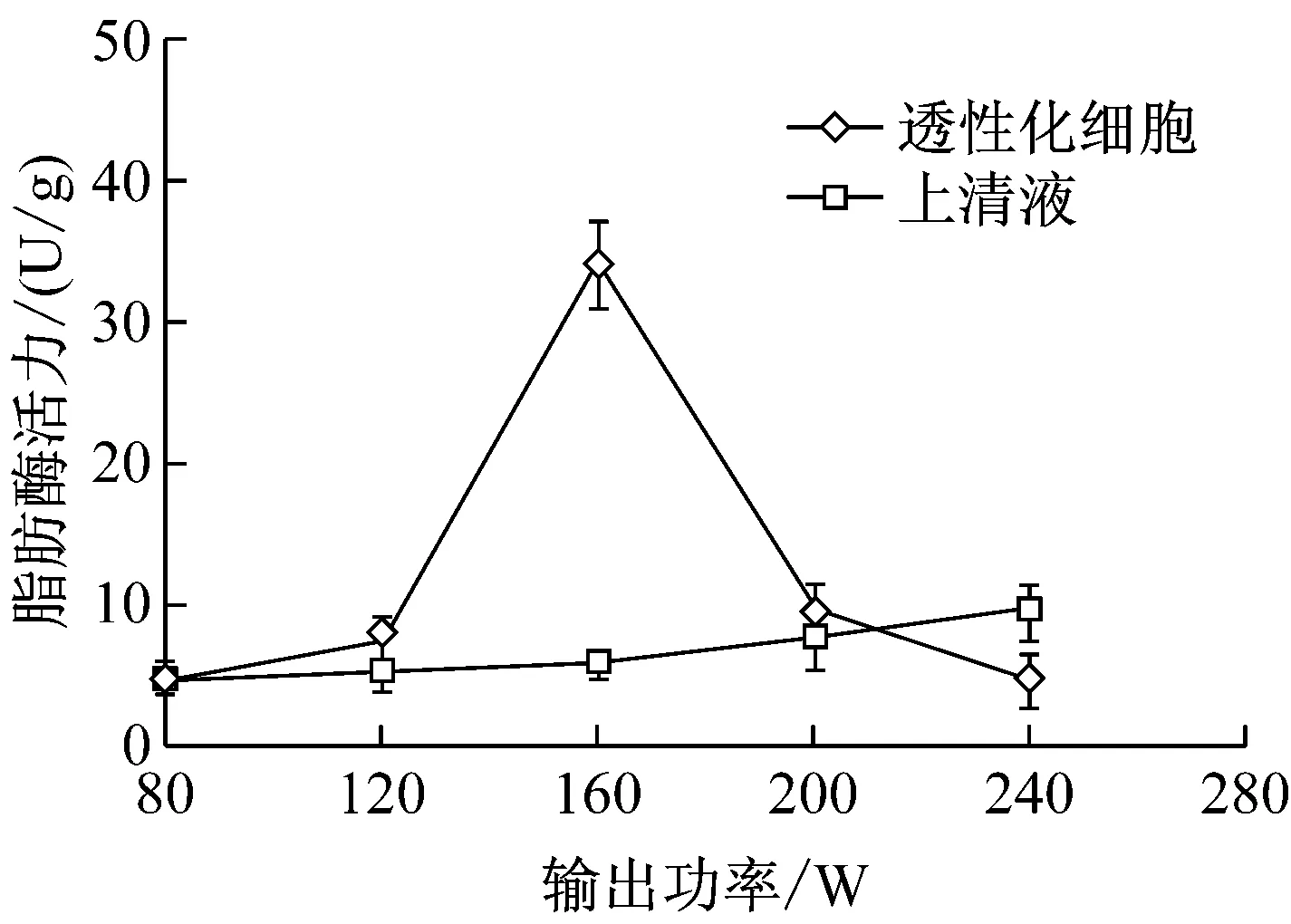
图1 超声波输出功率对透性化细胞脂肪
2.1.2超声波每次辐射时间对细胞透性化的影响
如图2所示,透性化细胞脂肪酶活性随每次辐射时间的增加呈现先升高后降低的趋势,每次辐射时间为2 s的透性化效果最好。每次辐射时间太短,空化效应起不到透性化作用;但辐射时间过长,空化效应增加细胞破碎,使细胞内的脂肪酶释放到胞外,降低了透性化细胞的脂肪酶活力[13]。因此,选定超声波透性化的每次辐射时间为2 s。
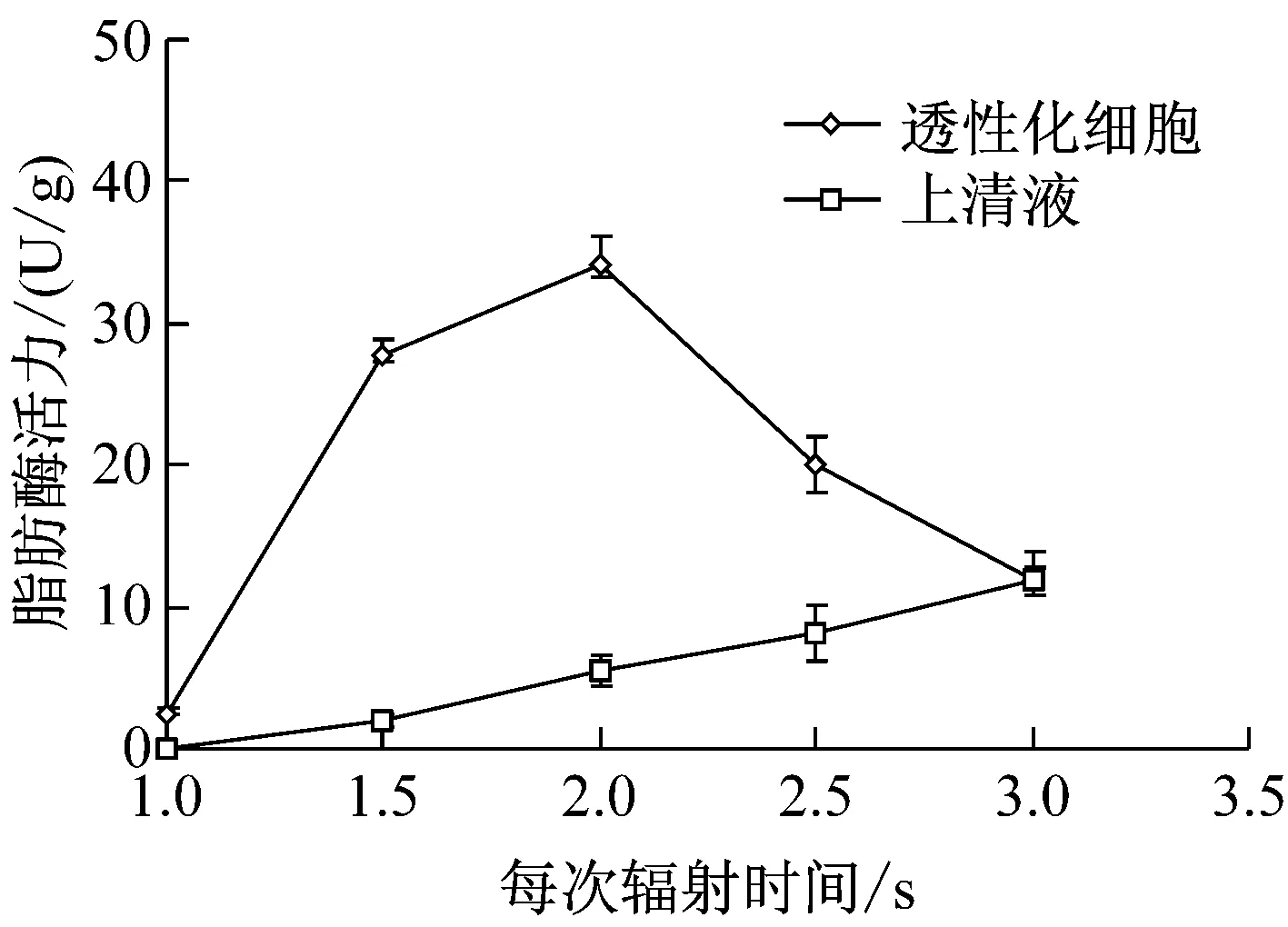
图2 超声波每次辐射时间对透性化细胞脂肪
2.1.3超声波工作总时间对细胞透性化的影响
由图3可见,透性化细胞脂肪酶活性随工作总时间的增加而增加,工作总时间为1 min的脂肪酶表现出最大活力,透性化效果最好。进一步提高工作总时间,透性化细胞脂肪酶活力则显著下降[12]。因此,选定超声波透性化的工作总时间为1 min。
2.1.4菌体浓度对细胞透性化的影响
由图4可知,透性化细胞脂肪酶活性随菌体浓度的增加先升高后降低,菌体浓度为50 g/L的酶活力最大。这是因为菌体浓度较低时,总蛋白量较小,并且超声波在水中传递的损失较大,透性化效果相应较差;菌体浓度的提高使液体总蛋白质的量增大,在超声波作用后透性化细胞蛋白质的量也就增大。但菌液浓度过高时,液体粘稠度的增加,不利于空化作用,导致透性化效果较差[14]。因此,选定超声波透性化的菌体浓度为50 g/L。

图3 超声波工作总时间对透性化细胞脂肪
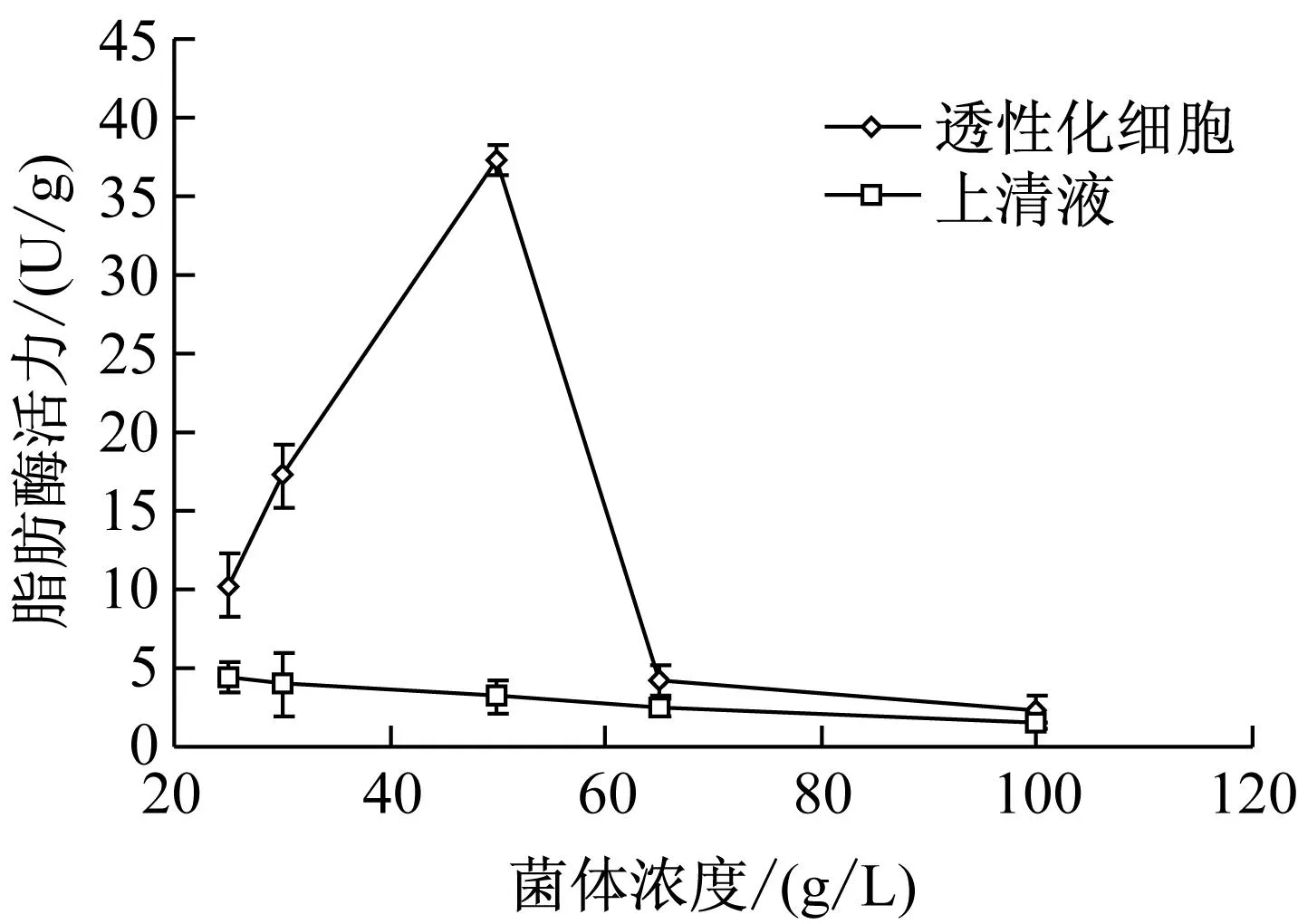
图4 菌体浓度对透性化细胞脂肪酶活性的影响
2.2细胞透性化正交试验结果
2.2.1细胞透性化正交试验
在单因素试验的基础上,以透性化细胞脂肪酶活性大小为考察指标,采用L9(34)正交表,进行4因素3水平的正交试验。试验设计见表1,正交试验设计与结果见表2。
对试验结果进行数据分析,根据表3的方差分析可以看出,C的平方和非常小,则用其作为误差估计项。在所设计的水平范围内,A和B对透性化细胞酶活有显著的影响(p < 0.05)。各因素对酶活的影响程度依次为D > A > B > C,综合表2的K值并直接比较可知,最佳工艺参数为D3A3B2C3,即菌体浓度为40 g/L,超声波输出功率为180 W,每次辐射时间2 s(间歇时间5 s),工作总时间1.2 min时透性化效果最好。
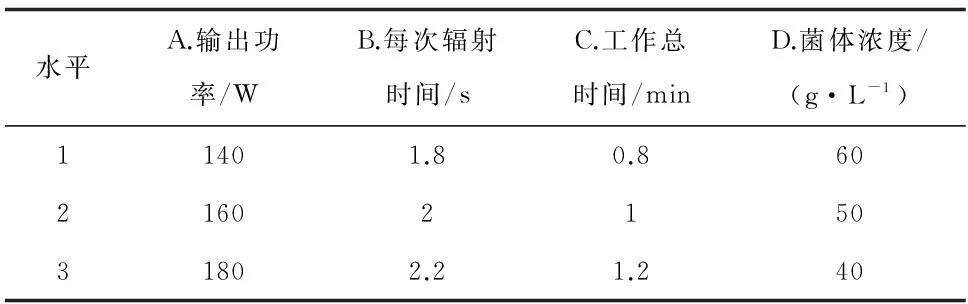
表1 细胞透性化L9(34)正交因素设计水平表
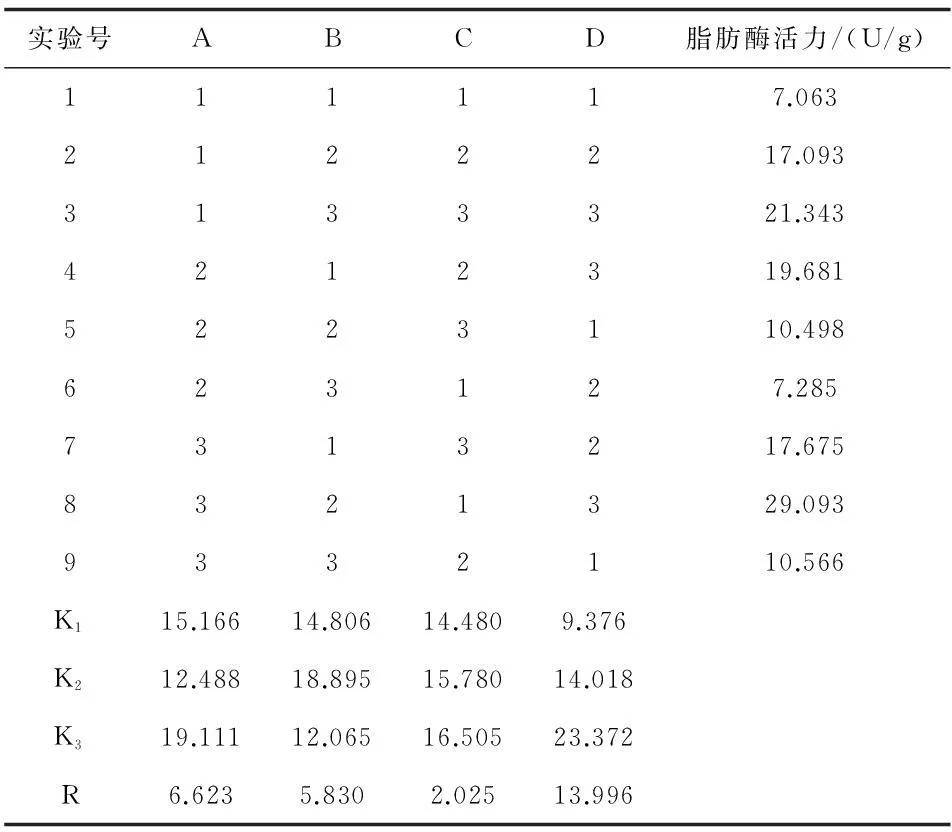
表2 细胞透性化正交试验的设计与结果

表3 细胞透性化正交试验的方差分析
2.2.1细胞透性化验证试验
按正交试验确定的最佳透性化条件D3A3B2C3,以透性化细胞脂肪酶活性为指标,进行验证试验。在此最优条件下三次测得酶活的平均值为30.12 U/g,高于正交试验结果的最大值,因此认为正交试验得出的最优水平是可靠的。在这里要说明一下,因为单因素试验和正交试验所用非同一批次细胞,不同批次细胞的生长状态存在差异,因此细胞经透性化处理后的脂肪酶活力也会有差异,从而导致单因素试验中透性化细胞的脂肪酶活力较正交试验的还要高的现象。
3结论
发酵性丝孢酵母产胞内脂肪酶,本实验利用超声波技术对细胞进行透性化处理,通过单因素实验以及正交实验确定了利用超声波进行细胞透性化的适宜条件为:超声波输出功率180 W,每次辐射时间2 s(间歇时间5 s),工作总时间1.2 min,菌体浓度40 g/L,在上述工艺条件下可以使发酵性丝孢酵母透性化并使其中的脂肪酶活力较高。
参考文献
[1]Trimukhe KD, Mahadik ND, Gokhale DV,etal. Environment friendly crosslinked chitosan as a matrix for selective adsorption and purification of lipase ofAspergillusniger[J]. International Journal of Biological Macromolecules, 2008, 43(5): 422-425.
[2]Bussamara R, Fuentefria AM, Oliveira ES,etal. Isolation of a lipase-secreting yeast for enzyme production in a pilot-plant scale batch fermentation[J]. Bioresource Technology, 2010, 101(1): 268-275.
[3]Wang X, Yu XW, Xu Y. Homologous expression, purification and characterization of a novel high-alkaline and thermal stable lipase fromBurkholderiacepaciaATCC 25416[J]. Enzyme and Microbial Technology, 2009, 45(2): 94-102.
[4]Demir BS., Tükel SS. Purification and characterization of lipase fromSpirulinaplatensis[J]. Journal of Molecular Catalysis B: Enzymatic, 2010, 64(s 3-4): 123-128.
[5]王莉,孙玉梅,刘英新等.发酵性丝孢酵母(Trichosporonfermentans)发酵产油脂的研究[J]. 工业微生物,2007,37(1):39-42.
[6]王舒,毛相朝,张鲁嘉等.应用细胞透性化技术快速提取氧化葡萄糖杆菌胞内右旋糖酐糊精酶[J].生物加工过程, 2010, 8(3): 35-39.
[7]周帅,王凤山.细胞透性化技术及其应用[J].生命的化学, 2008, 28(4): 481-484.
[8]张荆,童群义.超声波破碎提取D-甘露糖异构酶条件的研究[J].食品工业科技, 2009, 30(10): 247-249.
[10]Sundaram J, Mellein BR, Mitragotri S. An experimental and theoretical analysis of ultrasound-induced permeabilization of cell membranes[J]. Biophysical Journal, 2003, 84(5): 3087-3101.
[11]中国轻工业联合会. GB/T 23535-2009.脂肪酶制剂.北京:张蔚等, 2009-04-27 发布.
[12]姚咏嫦.插入式超声对酵母细胞膜通透性影响的研究[J].广东化工, 2006, 33(1): 42-44.
[13]卢群,刘晓艳,丘泰球等.超声对酵母细胞膜通透性的影响[J].食品与发酵工业, 2005, 31 (9): 14-17.
[14]Gaete-Garretón L, Vargas-Hernández Y, Cares-Pacheco MG,etal. Ultrasonically enhanced extraction of bioactive principles from Quillaja Saponaria Molina[J]. Ultrasonics, 2011, 51(5): 581-585.
Optimization of conditions of ultrasonic permeabilization for intracellular lipase-producingTrichosporonfermentans
SUN Zhen, LIU Ya-wen, WANG Di, SUN Yu-mei
School of Biological Engineering, Dalian Polytechnic University, Dalian 116034, China
AbstractThe lipase from Trichosporon fermentans was intracellular enzyme. The permeability of Trichosporon fermentans cell was improved by treating cells with ultrasonication. The intracellular lipase activity after permeabilization was enhanced under the optimal treating conditions: output power 180 W, irradiation duration 2 s per each time (with a 5 s interval), total irradiation time 1.2 min, cell concentration 40 g/L.
Key wordsTrichosporon fermentans; lipase; ultrasonication; cell permeabilization
基金项目:国家自然科学基金(31401681),辽宁省教育厅科学研究一般项目(L2015049)。
作者简介:孙珍(1986~),女,博士,讲师。E-mail: sunzhen@dlpu.edu.cn。 *通讯作者:孙玉梅(1962~),女,博士,教授。电话:0411-86318692,E-mail: sunyumei62@163.com。

