不同质粒电转三种乳酸菌的比较研究
王巧惠, 王光强, 宋 馨, 夏永军, 曹利瑞, 艾连中
上海理工大学医疗器械与食品学院, 上海 200093
不同质粒电转三种乳酸菌的比较研究
王巧惠,王光强,宋馨,夏永军,曹利瑞,艾连中*
上海理工大学医疗器械与食品学院, 上海 200093
摘要:为比较研究不同质粒针对不同乳酸菌的电转效率的差异,分别以乳酸乳球菌NZ9000、干酪乳杆菌LC2W和植物乳杆菌WCFS1三种乳酸菌为受体,以七种不同质粒为载体,进行电转实验。结果表明在乳酸乳球菌NZ9000中,转化效率最高的是pIB184质粒,达到了1.53×107 cfg/μgDNA,在干酪乳杆菌LC2W中,pSIP403质粒的电转化效率最高,达到了6.42×105 cfg/μgDNA,在植物乳杆菌WCFS1的电转化中,是 pNZ44质粒达到8.68×105 cfg/μgDNA的最高转化效率。其中质粒pIB184和pNZ44在三种菌株中均有较高的电转化效率,超过了103 cfg/μgDNA,另一方面T-pAMS100、pSIP403、pSIP409三个质粒在干酪乳杆菌与植物乳杆菌中的电转化效率明显高于乳酸乳球菌。不同质粒针对不同乳酸菌的转化效率为乳酸菌的高效电转和表达载体的选择与构建提供了可行依据。
关键词:乳酸乳球菌; 干酪乳杆菌; 植物乳杆菌; 电转化; 质粒
乳酸菌在净化肠道、改善机体营养和维护宿主健康方面起到重要的作用,被公认为是安全的,是食品级(food-grade)微生物,是优良的载体微生物,早在20世纪90年代,国内外学者就开始致力于乳酸菌分子生物学及作用机制的研究[1-2]。通过对乳酸菌的生物学性质和代谢途径的分子机制的研究,将外源基因转入乳酸菌中,在分子水平上改善其发酵特性,乳酸菌作为安全性良好的宿主菌,在这方面已显示出很大发展潜力[3]。随着对乳酸菌表达调控元件了解的逐步深入,相继出现了一批适用于乳酸菌的克隆载体、表达载体和整合载体,乳酸菌食品级高效表达系统的构建及其应用已成为当今研究的热点之一[4-6]。
另一方面由于乳酸菌属于革兰氏阳性菌,细胞壁较厚并具有刚性,对DNA分子进入细胞有明显的阻碍作用,采用经典的热激方法不能使外源DNA有效导入受体细胞,因而多采用电转化方法。而乳酸菌电转化方法受很多因素的影响,例如细胞弱化剂、细胞生长状态、电击条件、质粒浓度、质粒本身等等。目前已有的研究多是在细胞弱化剂、细胞生长状态、电击条件等方面研究一种或者多种菌株的电转化方法的优化,例如郭红敏[7]等的对德氏乳杆菌保加利亚亚种的电转化方法的研究,范璟[8]等对植物乳杆菌 G63 电转化方法的优化,格日勒图[9]等对干酪乳杆菌电转方法的研究等,而并没有对质粒本身对乳酸菌电转化效率的影响作出比较分析。
目前,乳酸菌在细菌分类学上划分为23个属[10],其中乳杆菌属和乳球菌属在生物分子上应用广泛。因此本文以乳酸乳球菌NZ9000、干酪乳杆菌LC2W和植物乳杆菌WCFS1为乳酸菌代表,以七种不同质粒为载体,在确定3种乳酸菌电转化方法的基础上研究不同质粒电转不同菌株电转化效率的差异性,为乳酸菌电转化载体的选择与构建,食品级基因工程菌的选择以及为乳酸菌分子生物学研究和基因工程技术发展,提供可行依据。
1材料与方法
1.1材料
1.1.1菌株与质粒
实验所用的菌株与质粒如表1所示。

表1 菌株与质粒
1.1.2培养基
GM17培养基:用于乳酸乳球菌的活化、培养和活菌计数;MRS培养基:用于乳杆菌的活化、培养和活菌计数; SGM17培养基:含0.5 mol/L蔗糖,2.5% 甘氨酸的GM17培养基,用于乳酸乳球菌的感受态细胞制备;含1% 甘氨酸的MRS培养基,用于干酪乳杆菌的感受态细胞制备;SMRS培养基:含0.3 mol/L的蔗糖,3%甘氨酸MRS培养基,用于植物乳杆菌感受态细胞培养;GM17MC恢复培养基:含有 2 mmol/L CaCl2,20 mmol/L MgCl2的 GM17培养基,用于乳酸乳球菌感受态细胞电转化后的复苏培养;SMRSMC恢复培养基:含0.5 mol/L的蔗糖、2 mmol/L CaCl2、20 mmol/L MgCl2的MRS培养基,用于干酪乳杆菌感受态细胞电转化后的复苏培养;SMRS培养基:含0.3 mol/L的蔗糖的MRS培养基,用于植物乳杆菌感受态细胞电转化后的复苏培养。
1.1.3缓冲液
溶液Ⅰ:0.5 mol/L蔗糖,10%甘油,用于重悬和洗涤乳酸乳球菌;溶液Ⅱ:0.5 mol/L蔗糖,10%甘油,0.05 mol/L EDTA,用于重悬和洗涤乳酸乳球菌;细胞预处理液:100 mmol/L乙酸锂二水,10 mmol/L DTT,0.6 mol/L蔗糖,1 mL 1 mol/L的Tris-HCl母液,调节pH至7.5。用于乳酸乳球菌感受态细胞的预处理;10%甘油:用于重悬和洗涤干酪乳杆菌的感受态细胞;PEB缓冲液:0.4 mol/L蔗糖,1 mmol/L MgCl2,5 mmol/L KH2PO4,调节pH至7.3~7.4,用于重悬和洗涤植物乳杆菌。以上缓冲液均用双蒸水配制。
1.1.4试剂与仪器
质粒提取采用上海生工生物SanPre柱式质粒DNA小量抽提试剂盒;电转化仪MicroPulse、电泳仪Powerpac basic、电泳槽、凝胶成像仪GelDocXR,均购自Bio-Rad公司;冷冻离心机,购自SiGMA公司;厌氧培养箱购自RUSKINN公司。
1.2方法
1.2.1感受态细胞的制备
1) 划线培养活化菌株,乳酸乳球菌NZ9000是用GM17平板,30 ℃培养,干酪乳杆菌LC2W和植物乳杆菌WCFS1是用MRS平板,37 ℃培养,后续培养均参照上述温度,在厌氧培养箱中静置培养,待菌落生长至直径1~2 mm大小。
2) 挑取划线培养出的正常菌落,接种于各自液体培养基中,按各自培养温度静置培养12 h。
3) 取上述活化好的菌液按一定比例接种于各自液体培养液中,乳酸乳球菌NZ9000和干酪乳杆菌LC2W是按5%的比例,植物乳杆菌WCFS1是以2%比例,静置培养12 h。
4) 取上述培养液,乳酸乳球菌NZ9000以5%比例转接于含2.5%甘氨酸的SGM17培养液中,30 ℃静置培养至菌液OD600=0.3~0.4;干酪乳杆菌LC2W以相同比例将培养液接种于含1%甘氨酸的MRS液体培养基中,37 ℃静置培养至菌液OD600=0.7~0.8;植物乳杆菌WCFS1是以2%比例接种于含3%甘氨酸的SMRS液体培养基中,37 ℃静置培养至菌液OD600=0.3~0.4。
5) 上述菌液冰浴20 min,离心,弃上清,其中乳酸乳球菌109细胞用8 mL细胞预处理液重悬,室温静置30 min,离心,弃上清。
6) 三种菌分别用各自预冷的电转缓冲液重悬洗涤三次,其中乳酸乳球菌NZ9000是先用溶液Ⅰ洗涤,再用溶液Ⅱ洗涤,最后再用溶液Ⅰ洗涤。
7) 用各自预冷的电转缓冲液充分重悬菌体,按每管80 μL分装于1.5 mL离心管中,-70 ℃超低温冰箱保存。此处乳酸乳球菌NZ9000是用溶液Ⅰ重悬菌体。
注:以上所有离心条件均为4 ℃,5 000 r/min,10 min。
1.2.2电转化及转化效率的计算
1) 从超低温冷冻箱中取出感受态细胞,置于冰上解冻10 min。
2) 每管感受态细胞中加入质粒,轻柔混匀,转移至冰上预冷的电击杯中,轻敲电击杯,确保混合物进入电击杯底部。
3) 调节电转化参数(乳酸乳球菌NZ9000和干酪乳杆菌LC2W是2.0 KV,植物乳杆菌WCFS1是2.0 KV,4.0 ms),电击电转化杯。
4) 迅速向电转化杯中加入1 ml预冷的恢复培养基,混匀后转移1.5 mL离心管中,于厌氧培养箱中静置复苏培养(乳酸乳球菌NZ9000是30 ℃,2 h;干酪乳杆菌LC2W和植物乳杆菌WCFS1是37 ℃,3 h)。
5) 取适量菌液涂布抗性平板,于厌氧培养箱中倒置培养24 h ~48 h。
以上感受态细胞的电转化效率计算:
电转化效率(cfg/μgDNA)=稀释倍数×菌落数/质粒DNA数量
2结果与讨论
2.1转化子验证
分别随机挑取三种菌株抗性平板上的单菌落,扩大培养提质粒,酶切后进行核酸凝胶电泳鉴定。结果如图1。
为验证电击转化后的转化子,文章对所有质粒转化三种乳酸菌的转化子都进行了筛选鉴定。电泳结果显示,三种菌株电转后的转化子条带与各自的原始质粒一致(图1),可见所有质粒都成功转入到了三种乳酸菌中。
2.2电转化效率的分析
质粒电转化3个乳酸菌的电转化效率如图2所示。
实验用7种质粒电转3种乳酸菌,由图2可知,所有质粒都成功转入了三种菌株中,可见这三种菌株的电转化方法都是成功的。在乳酸乳球菌NZ9000的电转化中,转化效率最高的分别是pIB184、pIAβ3,各自达到了1.53×107cfg/μgDNA和2.52×106cfg/μgDNA,转化效率最低的是T-pAMS100、pSIP403、pSIP409,低于101数量级,最高转化效率和最低转化效率相差高达106倍。
在干酪乳杆菌LC2W的电转化中,转化效率均较高,pMG36e、pIAβ3达到103cfg/μgDNA,其余均超过或者位于105cfg/μgDNA附近。
在植物乳杆菌WCFS1的电转化中,所有质粒的转化效率均达到了103cfg/μgDNA,其中转化效率最高的是pNZ44,达到8.68×105cfg/μgDNA,转化效率最低的是pMG36e,达到1.28×103cfg/μgDNA。
对各个质粒电转三种菌株的电转化效率进行比较,质粒pIB184是最优的适用于这三种菌株的电转化质粒,其次则是pNZ44。质粒T-pAMS100、pSIP403、pSIP409三者均在乳酸乳球菌NZ9000的电转化中,效率低下,而在干酪乳杆菌LC2W和植物乳杆菌WCFS1的电转化中,效率均超过104cfg/μgDNA,由此可以推测三种质粒更适合于乳杆菌的电转化。另一方面pSIP403和pSIP409为同一系列质粒,两者在三种菌株的电转化中,电转化效率相近,且pSIP403质粒的电转化效率始终高于pSIP409质粒。
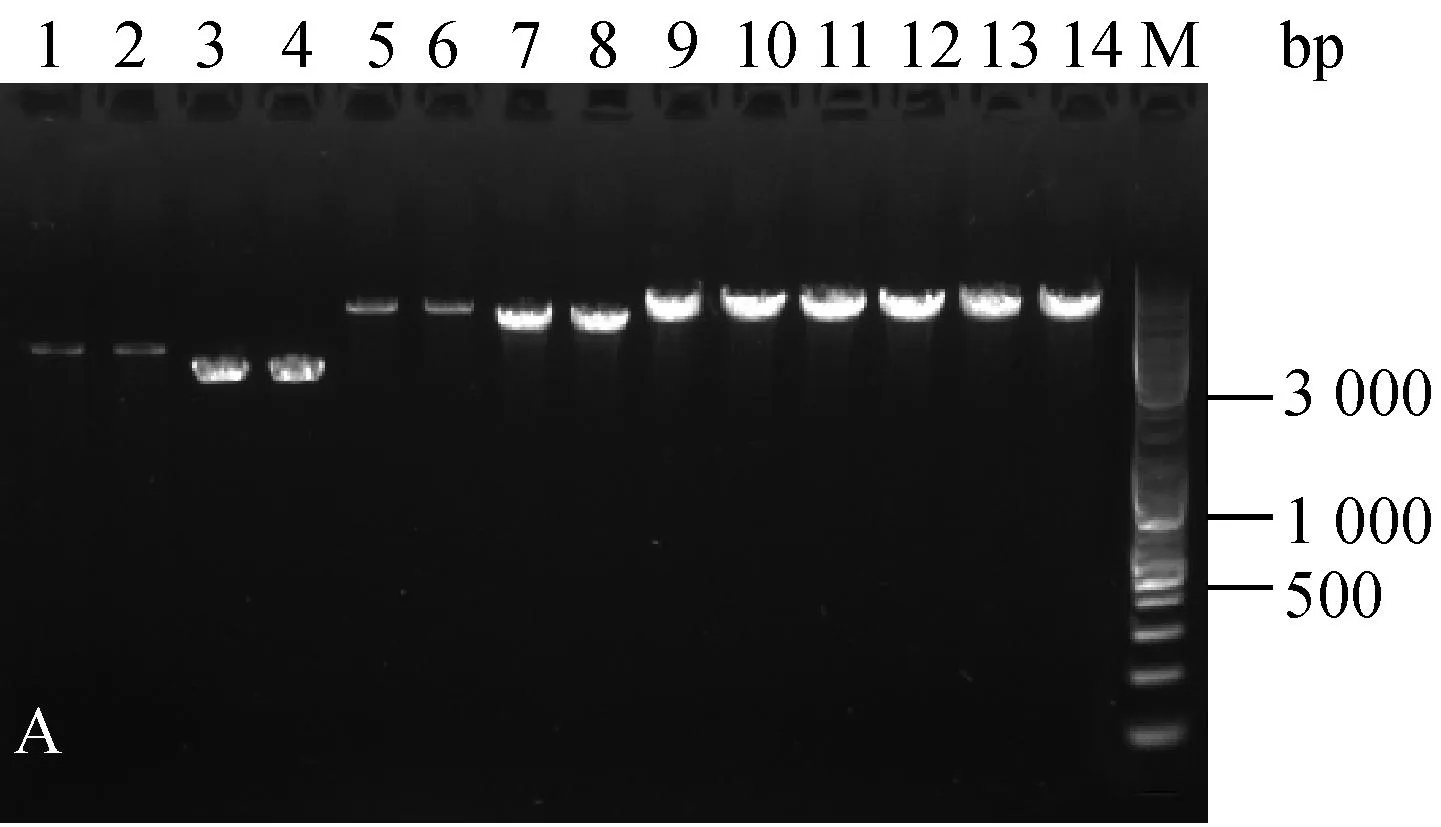
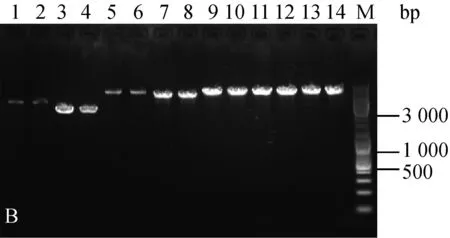
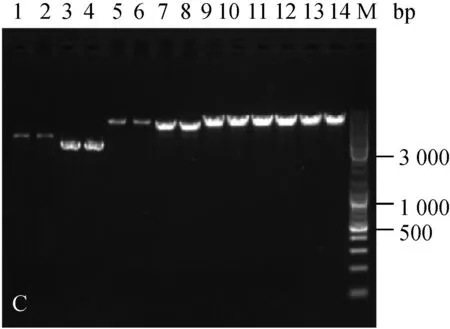
A:乳酸乳球菌转化子鉴定图;B:干酪乳杆菌转化子鉴定图;C:植物乳杆菌转化子鉴定图;1.原始pMG36e质粒EcoRⅠ酶切;2. 电转后提取pMG36e质粒EcoRⅠ酶切;3. 原始pNZ44质粒SacⅠ酶切;4. 电转后提取pNZ44质粒SacⅠ酶切;5. 原始pIAβ3质粒EcoRⅠ酶切;6. 电转后提取pIAβ3质粒EcoRⅠ酶切;7. 原始pIB184质粒EcoRⅠ酶切;8. 电转后提取pIB184质粒EcoRⅠ酶切9. 原始T-pAMS100质粒EcoRⅠ酶切;10. 电转后提取T-pAMS100质粒EcoRⅠ酶切;11原始pSIP403质粒NcoⅠ酶切;12. 电转后提取pSIP403质粒NcoⅠ酶切;13. 原始pSIP409质粒NcoⅠ酶切;14. 电转后提取pSIP409质粒NcoⅠ酶切;M.Marker。
图1三种菌的转化子验证
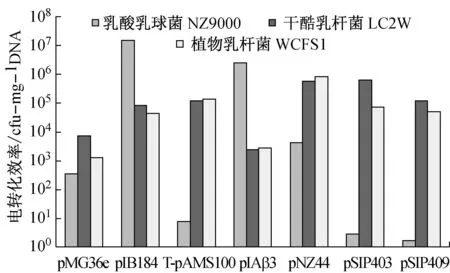
图2 质粒电转化效率
本文乳酸乳球菌的电转化方法是在任大勇[11]等方法的基础上进行了修改,借鉴Maria Papagianni[12]等人的细胞预处理方法,最后得出的最高电转化效率达到107cfg/μgDNA。而任大勇[11]等的乳酸乳球菌电转化方法最高电转化效率仅为104cfg/μgDNA,两者相差103cfg/μgDNA,由此可见Maria Papagianni[12]等人的细胞预处理方法对提高乳酸乳球菌的电转化效率是可行的。文章采用的干酪乳杆菌的电转化方法是在任婧[13]、Nan Li[14]等人的方法的基础上进行了修改,采用的植物乳杆菌的电转化方法是借鉴参考了Pascale Serror[15]、Plearnpis Luxananil[16]、 Sheng Yin[17]等人的电转方法,二者最高电转效率均高达105cfg/μgDNA。
质粒的电转化效率受到很多因素的影响,菌体的生物生理状况、培养基组分、电击参数、质粒大小、质粒浓度等等,除此外宿主与质粒本身的特异性在电转化效率中也具有着重要作用。以相同质粒DNA电转化不同乳酸菌或以不同质粒电转相同乳酸菌,其能否实现成功转化的结果不尽相同,不同种类的乳酸菌其转化效率相差甚远,如图2中每种质粒电转3种菌株得到的电转化效率是不相同的,另一方面7种质粒电转同一菌株,转化效率也相差甚远,这表明宿主与质粒都存在着各自的特异性。另一方面这种不稳定性也许是因为外源质粒与内源质粒的不相容,或者是宿主的不同限制修饰系统,再或者是质粒本身来源、复制方式的不同。
文中所用的宿主菌为乳酸乳球菌NZ9000、干酪乳杆菌LC2W、植物乳杆菌WCFS1均为乳酸菌。考虑到质粒来源是影响转化效率的重要因素。大量研究表明相同条件下,用不同来源的质粒转化效率差别很大,选择适宜的质粒是转化成功与否的关键因素,如质粒来自近缘种,其转化效率通常较高,而异源质粒的转化效率较低。文中所用的7种质粒均来源于乳酸菌种,pMG36e质粒为pWV01复制子,pIB184、pIAβ3、T-pAMS100质粒是pAMβ1复制子,pNZ44质粒是pNZ系列质粒,pSIP403、pSIP409质粒是pSIP系列质粒。其中pNZ系列质粒和pSIP系列质粒是乳杆菌穿梭质粒,如图2中,pNZ44、pSIP403、pSIP409三个质粒在乳酸乳球菌NZ9000中的电转效率均明显低于在干酪乳杆菌LC2W和植物乳杆菌WCFS1中的电转化效率。其中pSIP403、pSIP409质粒在乳酸乳球菌NZ9000中的电转效率低于101数量级,对Elisabeth S[18]等人的文献进行了论证,证实了pSIP403和pSIP409质粒为乳杆菌穿梭质粒。另一方面7种质粒中,pMG36e、pIB184、pNZ44是组成型表达载体,而pSIP403、pSIP409质粒是诱导型表达载体。针对不同载体与不同宿主菌之间的电转化效率的研究,为后期乳酸菌载体的选择与构建、宿主菌的选择提供了参考依据。
3结论
乳酸菌载体本身对乳酸菌的电转化效率有很大的影响,不同的载体针对不同的乳酸菌有着不同的电转化效率。实验在成功确定了三种菌株的电转化方法基础上,以7个质粒为载体,以乳酸乳球菌NZ9000、干酪乳杆菌LC2W和植物乳杆菌WCFS1为受体,进行电转实验,成功确定了3个菌株各自的较佳载体以及通用型载体,为3种菌株的进一步的生物学性质与代谢途径的研究打下基础,为不同乳酸菌的载体的选择与构建,为进一步选择与构建乳酸菌通用型表达系统提供了可行的依据。
参考文献
[1]王璠,元冬娟,江黎明. 乳酸菌在基因工程领域的应用[J].生命的化学,2008,28(3):354-357.
[2]胡学智. 益生元—双歧杆菌生长促进因子[J]. 工业微生物,2005,35(2):50-60.
[3]Elmer HM, Jame LS. Applied dairy microbiology [M]. New York: Marcel Dekker Inc, 2001: 243-299.
[4]Brian JBW, Philip JW. Genetics of Lactic Acid Bacteria [M]. New York: Kluwer Academic/Plenum Publishers, 2003.
[5]Liu CQ, Su P, Khunajakr N,etal. Development of food-grade cloning and expression vectors for Lactococcus lactis[J].Journal of Applied Microbiology,2005,98(1):127-135.
[6]Platteeuw C, Van A I, Van SS,etal. Food-grade cloning and expression system for Lactococcus lactis[J].Applied and environmental microbiology, 1996,62(3):1008-1013.
[7]郭红敏, 谷新晰, 张玉兰等. 利用组成型表达载体pMG36e电转化德式乳杆菌保加利亚亚种的研究[J]. 中国食品学报,2011,11(2):8-16.
[8]范璟,席雪冬,黄彦等.植物乳杆菌 G63 电转化方法的优化[J].食品科学,2015.
[9]格日勒图,王艳霞,包秋华等.电转化方法将外源性质粒导入干酪乳杆菌的研究[J].中国乳品工业,2009,37(2):9-13.
[10]凌代文,东秀珠. 乳酸菌细菌分类鉴定及试验方法[M]. 北京:中国轻工业出版社,1999.
[11]任大勇,李昌,秦艳青等. 乳酸乳球菌高效电转化方法的建立[J].中国兽药杂志,2012,46(1):5-9.
[12]Maria P, Nicholaos A, George F. High efficiency electrotransformation ofLactococcuslactisspp. Lactis cells pretreated with lithium acetate and dithiothreitol [J] BioMed Central Biotechnology,2007.
[13]任婧,李楠,陈臣等.干酪乳杆菌LC2W最优电转化条件的建立[J].食品安全质量检测学报,2014,5(4):1028-1032.
[14]Nan L, Yuan LW, Ping Z,etal. Improvement of exopolysaccharide production inLactobacilluscaseiLC2W by overexpression of NADH oxidase gene [J]. Microbiological Research, 2015, 171:73-77.
[15]Pascale S,Takashi S,Dusko E,etal. Electrotransformation ofLactobacillusdelbrueckiisubsp.bulgaricusandL.delbrueckiisubsp.lactiswith Various Plasmids [J].Applied and Environmental Microbiology, 2002, 68(1):46-52.
[16]Plearnpis L, Ruangurai P, Srianant W,etal. MonitoringLactobacillusplantarumBCC 9546 starter culture during fermentation of Nham,a traditional Thai pork sausage [J]. International Journal of Food Microbiology, 2009, 129(3):312-315.
[17]Sheng Y,Yan LH, Zheng YZ,etal. Functional analysis of the plasmid pM4 replicon fromLactobacillusplantarumM4: Determination of the minimal replicon and functionality identification of the putativesso[J].Plasmid, 2009, 62(3):166-171.
[18]Elisabeth S, Geir M, Kristine N,etal. High-level,inducible gene expression inLactobacillussakeiandLactobacillusplantarumusing versatile expression vectors [J]. Microbiology, 2005, 151:2439-2449.
Comparative studies on electricity transformation of three kinds of lactic acid bacteria using different plasmids
WANG Qiao-hui, WANG Guang-qiang, SONG Xin, XIA Yong-jun, CAO Li-rui, AI Lian-zhong
School of Medical Instrument and Food Engnieering, University of Shanghai for Science and Technology, Shanghai 200093, China
AbstractIn order to compare the electricity transformation efficiencies of different lactic acid bacterias using different plasmids, the Lactococcus lactis NZ9000, Lactobacillus casei LC2W and lactobacillus plantarum WCFS1 were chosen as the hosts, and seven kinds of plasmids as the vectors, to compare the difference in electricity transformation efficiency of different plasmids and different bacterial strains. The results showed that the pIB184 plasmid reached the maximum electricity transformation efficiency of 1.53×107 cfg/μgDNA in Lactococcus lactis NZ9000. The pSIP403 plasmid reached the maximum electricity transformation efficiency of 6.42×105 cfg/μgDNA in Lactobacillus casei LC2W. The pNZ44 plasmid reached the maximum electricity transformation efficiency of 8.68×105 cfg/μg DNA in lactobacillus plantarum WCFS1. Both plasmid pIB184 and pNZ44 had high efficiency of electricity transformation in the three strains and all of them were more than 103 cfg/μg DNA. On the other hand, three plasmids, T-pAMS100, pSIP403 and pSIP409 had higher efficiency of electricity transformation in Lactobacillus casei and lactobacillus plantarum than in Lactococcus lactis. These results provided foundation for selecting more efficient electricity transformation system and expression system.
Key wordsLactococcus lactis; Lactobacillus casei; lactobacillus plantarum; electricity transformation; plasmid
基金项目:国家自然科学基金资助项目(31371809,31401670)。
作者简介:王巧惠(1990~),女,研究生。E-mail:w1234098098@163.com。 *通讯作者: 艾连中(1976~),男,教授,博士,食品生物技术。E-mail:ailianzhong@163.com。

