TGF-β1、Smad2在胆道闭锁肝纤维化中的作用
丁美云,詹江华,赵丽,赵林胜,张爱华
TGF-β1、Smad2在胆道闭锁肝纤维化中的作用
丁美云1,詹江华2△,赵丽2,赵林胜2,张爱华2
摘要:目的研究转化生长因子(TGF)-β1与Smad2蛋白在胆道闭锁(BA)肝组织中的表达情况及在肝纤维化进程中的作用。方法选取2010年1月—2014年7月尸检(患儿死于非肝胆疾病,正常对照组)5例,胆管扩张症肝活检(胆扩组)10例,BA肝活检(早期肝纤维化组)19例,BA晚期进行肝移植患者自体肝活检(晚期肝硬化组)11例,采用HE染色观察并评价肝标本纤维化程度,免疫组化染色检测TGF-β1与Smad2蛋白在肝组织中的表达,实时荧光定量聚合酶链式反应(qRT-PCR)方法检测肝组织中TGF-β1与Smad2基因表达情况。结果 (1)HE。正常对照组肝组织无胶原纤维增生,胆扩组有轻度纤维细胞增生,早期肝纤维化组胶原纤维增生、桥接纤维化现象显著,而晚期肝硬化组假小叶显著。(2)免疫组化。TGF-β1蛋白平均光密度值在早期肝纤维化组表达最高(P<0.05);Smad2蛋白在4组间表达差异无统计学意义。(3)qRT-PCR。胆扩组、早期肝纤维化组和晚期肝硬化组3组肝内TGF-β1、Smad2 mRNA含量比较早期肝纤维化组均最高(P<0.017)。结论BA肝纤维化早期TGF-β1、Smad2促进纤维化至门管区-门管区(P-P)、门管区-中央静脉(P-C)型桥样结构形成;随着纤维化程度加重,TGF-β1、Smad2表达促纤维化作用逐渐减弱。
关键词:胆道闭锁;肝硬化;转化生长因子β1;Smad2蛋白质;肝纤维化
基金项目:国家自然科学基金资助项目(81570471);天津市卫生行业重点攻关项目(14KG129);天津市卫生局科技基金资助项目(2014KR09)
作者单位:1天津医科大学研究生院(邮编300070);2天津市儿童医院
作者简介:丁美云(1988),女,硕士在读,主要从事小儿普通外科、胆道闭锁方面研究
△
通讯作者E-mail:zhanjianghuatj@163.com
胆道闭锁(biliary atresia,BA)是危及婴幼儿生命的肝胆系统疾病,发病率为1/8 000~1/5 000,以胆道闭塞、进行性肝纤维化为特征,最终进展为肝硬化、肝衰竭,是婴幼儿时期肝移植的主要指征[1-2]。转化生长因子(TGF)-β1蛋白能够调节机体细胞生长、分化、凋亡,Smad2蛋白是TGF-β1/Smads促纤维化通路的重要因子,TGF-β1/Smads促纤维化通路在BA肝纤维化进程中起重要作用[3]。宋亭亭等[4]证明BA患儿肝内TGF-β1蛋白含量在肝门-空肠吻合术(Kasai手术)时期高于肝移植期。但这两种蛋白在BA肝纤维化进展中的作用尚不明确,本研究通过检测TGF-β1、Smad2蛋白和基因水平的表达,探讨两者在BA肝纤维化进展中的作用和临床意义。
1 资料与方法
1.1标本来源与分组肝组织标本来自天津市儿童医院2010年1月—2014年7月间尸检5例,病例死于非肝胆疾病,为正常对照组;胆管扩张患儿10例(胆扩组);BA患儿19例,为Kasai术时所取肝活检组织,患儿肝内纤维组织增生、门管区增宽最终形成大量门管区-门管区(P-P)、门管区-中央静脉(P-C)型纤维间隔,无明确假小叶出现,将其定为早期肝纤维化组;天津市第一中心医院2013年1月—2014年1月BA晚期肝硬化行肝移植患者自体肝活检组织11例,患儿肝内出现假小叶、间质内纤维瘢痕逐渐严重,定为晚期肝硬化组;患儿基本情况见表1。本研究经天津市儿童医院及天津市第一中心医院伦理委员会审查通过。

Tab.1 General condition in four groups of patients表1 各组患儿一般情况
1.2主要试剂与仪器兔抗人TGF-β1一抗(1∶100),兔抗人Smad2一抗(1∶200),二抗为辣根酶标记的羊抗兔聚合物,均购自北京博奥生物技术有限公司。实时荧光定量聚合酶链式反应(qRT-PCR)引物由北京奥科生物技术有限公司设计合成,见表2。主要仪器:IQ5实时定量PCR仪(美国Bio⁃Rad公司),手执式组织匀浆机(德国IKA公司)。FastQuant RT Kit(With gDNase)、TRIzol(天根生化公司),SuperReal PreMix Plus(SYBR Green)。
1.3方法
1.3.1标本处理术中取各组患儿肝右叶前缘为活检标本,部分置无菌EP管中储存在-80℃冰箱,用于qRT-PCR检测;部分用10%福尔马林溶液固定8~24 h后经石蜡包埋储存,所有过程均处于同一实验条件。正常对照组没有肝活检组织,未进行TGF-β1、Smad2的qRT-PCR检测。

Tab.2 The base sequences of primers for qRT-PCR about TGF-β1 and Smad2表2TGF-β1、Smad2引物序列
1.3.2HE及免疫组化染色将已包埋肝脏蜡块切成4 μm厚切片分别经HE、免疫组化染色(采用S-P两步法),由经验丰富的病理科医生在100倍、400倍光学显微镜下观察肝组织细胞发育、肝纤维化程度。免疫组化阳性标准[5]:(1)定性分析,根据染色强度分为无棕黄色(阴性)、淡棕黄色(弱阳性)、棕黄色(阳性)、棕褐色(强阳性)。(2)半定量分析,根据肝组织切片内阳性细胞总光密度值/阳性细胞所占面积求得平均光密度值(AOD)。每张切片内读取任意5张视野,用同一计算机成像系统留取相同倍数显微镜下图片,图像分析软件IPP 6.0分析每张图片,计算TGF-β1、Smad2蛋白的AOD。
1.3.3qRT-PCR取肝组织按照 TRIzol法研磨提取总RNA,经反转录后合成cDNA。PCR反应体系为20 μL,包括10 μL 2×SuperReal PreMix,上、下游引物各0.5 μL,cDNA模板1 μL,无酶水补足到20 μL。95℃预变性15 min,95℃变性10 s,58℃退火20 s,72℃延伸20 s,扩增40个循环。分别测定样本内参(GAPDH)、TGF-β1、Smad2基因扩增的Ct值,重复3次,取3次结果平均值为最终Ct值;ΔCt=每个基因Ct值-内参Ct;样本基因相对定量=2-ΔCt。
1.4统计学方法采用SPSS 15.0统计软件包分析,正态分布的计量资料用±s表示,组间比较采用方差分析,多重比较用Bonferroni法;非正态分布的计量资料用中位数及四分位数间距[M(Q)]表示,组间比较使用Kruskal-Wallis H检验,多重比较用Bonferroni法进行显著性水平校正。相关性分析进行Spearman秩相关分析。P<0.05为差异有统计学意义。
2 结果
2.1各组肝纤维化程度正常对照组肝组织内细胞胞质清亮、排列紧密,纤维细胞少见,无纤维组织增生。胆扩组肝内细胞胞质微着色,门管区少许纤维组织增粗。早期肝纤维化组肝内细胞变性,胞质着色较重,炎细胞、纤维细胞大量增生,纤维组织大量增粗、桥接纤维化。晚期肝硬化组HE染色见肝内细胞坏死、再生,假小叶明显,见图1。
2.2肝内TGF-β1、Smad2蛋白表达水平比较免疫组化染色结果显示TGF-β1蛋白在早期肝纤维化组表达高于其他3组(P<0.05),4组Smad2蛋白半定量结果比较差异无统计学意义,见表3。
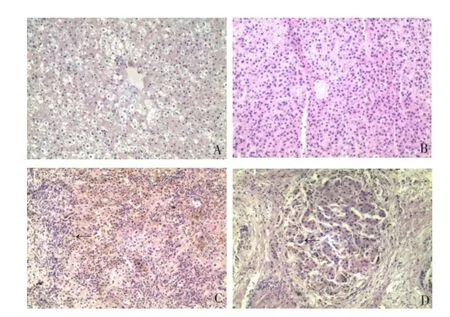
A:正常对照组;B:胆扩组;C:早期肝纤维化组;D:晚期肝硬化组;箭头所指为纤维组织Fig.1 Comparison of hepatic fibrosis between four groups图1 各组肝纤维化程度比较(HE,×100)
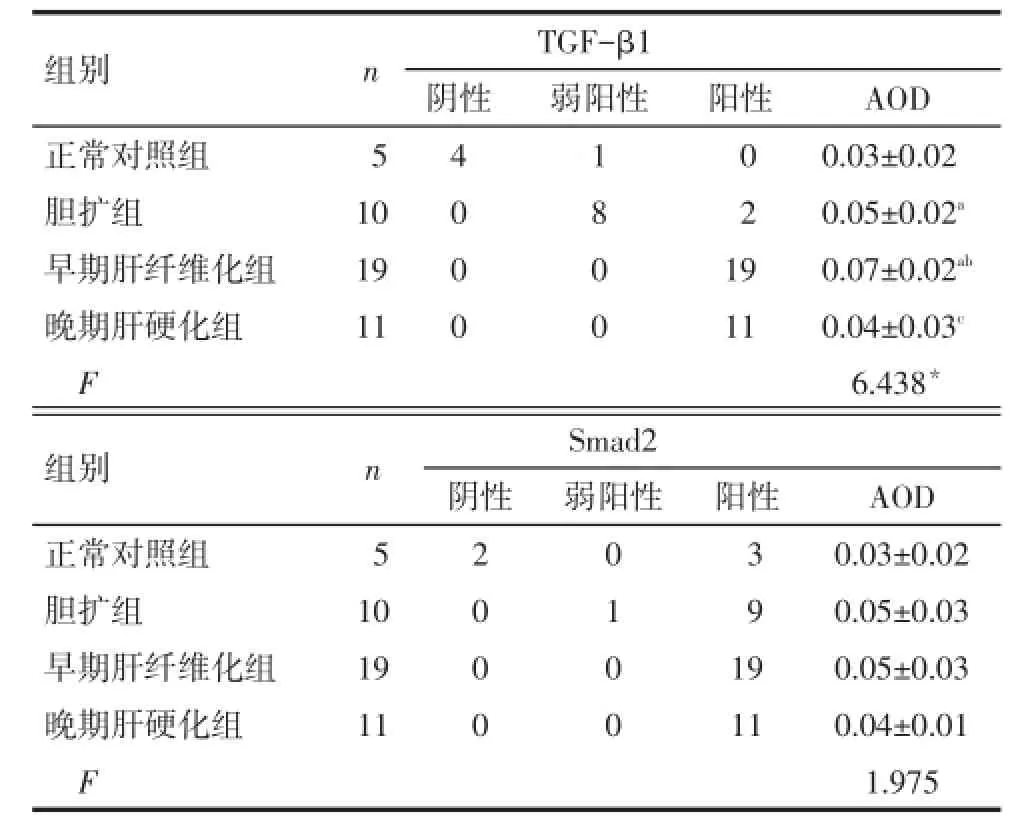
Tab.3 The IHC result showing expressions of TGF-β1 and Smad2 in different groups表3 各组肝组织TGF-β1、Smad2免疫组化染色结果
2.3肝内TGF-β1、Smad2 mRNA表达水平比较早期肝纤维化组TGF-β1、Smad2 mRNA相对表达水平高于胆扩组和晚期肝硬化组(P<0.017),见表4。早期肝纤维化组TGF-β1、Smad2 mRNA相对表达水平呈正相关(rs=0.71,P<0.05)。
3 讨论
BA患儿常因肝内各级胆管增生、梗阻伴随进行性肝纤维化最终形成肝硬化而危及生命,Kasai手术可以解决肝门部胆管暂时性通畅,但是无法终止肝脏纤维化[6]。国外研究认为TGF-β1促纤维化通路是促进BA肝纤维化进展的重要因素,TGF-β1、 Smad2是促纤维化通路蛋白,在BA肝纤维化进展中起到一定的作用,但其作用机制尚不十分清晰[7]。本研究通过检测TGF-β1、Smad2在BA肝内表达情况,探讨其与BA肝纤维化进展的关系。

Tab.4 Comparison of expression levels of TGF-β1 mRNA and Smad2 mRNA between three groups表4各组TGF-β1、Smad2 mRNA相对含量比较
3.1TGF-β1、Smad2促进BA早期肝纤维化本研究HE镜下可见BA早期肝纤维化组肝内门管区扩大、纤维组织增生形成纤维间隔,纤维化逐渐加重至P-P、P-C型桥接纤维化,同时早期肝纤维化组TGF-β1 mRNA表达水平高于胆扩组和晚期肝硬化组,高表达的TGF-β1 mRNA促进TGF-β1蛋白的产生与分泌,导致TGF-β1蛋白表达明显升高,Smad2 mRNA同样在早期肝纤维化组含量最高,与TGF-β1 mRNA有较高相关性,然而Smad2蛋白表达水平在各组间无明显差异。Gaarenstroom等[8-10]研究认为Smad2蛋白以单体形式存在于细胞质中,在TGF-β1蛋白激活下发生磷酸化,磷酸化的Smad2形成特定络合物向细胞核移动,在细胞核内启动细胞外基质(ECM)蛋白等相关基因转录、调节促纤维化基因转录速度,继而磷酸化的Smad2发生去磷酸化作用返回细胞质,在胞质与胞核之间穿梭传递促纤维化信号,最终促进细胞外基质蛋白生成,激活肝星形细胞、活化肌成纤维化细胞,从而促进肝纤维化。BA肝内伴随TGF-β1蛋白增多,Smad2蛋白在胞质与胞核之间“磷酸化与非磷酸化”循环效率升高导致转录速度的加快,可能是Smad2蛋白促纤维化的方式。Vrljicak等[11]研究TGF-β1/Smads在肾纤维化中作用时发现,肾小球内Smad2蛋白表达情况与其mRNA含量不一致,Smad2 mRNA表型特征影响Smad2 mRNA翻译为Smad2蛋白。这可能也是BA肝内Smad2 mRNA高表达而Smad2蛋白无明显增高现象的一个原因,需要进一步研究。在BA肝纤维化早期,TGF-β1、Smad2 mRNA共同升高,升高的TGF-β1 mRNA调控TGF-β1蛋白含量增多,TGF-β1蛋白加快Smad2蛋白磷酸化从而加快促纤维化信号传递,促进ECM等生成从而加重BA肝纤维化。
3.2TGF-β1、Smad2在BA晚期肝硬化时表达减弱本研究HE镜下可见BA晚期肝硬化时假小叶遍布、肝细胞不断增生,而肝内TGF-β1蛋白平均光密度值及其mRNA含量不断下降,这表明BA肝硬化期TGF-β1 mRNA的转录受到抑制,其含量减少、促纤维化作用减弱。Smad2蛋白含量在肝纤维化进程中没有变化,在晚期肝硬化时期伴随TGF-β1蛋白减少其磷酸化速率减慢、促纤维化作用减弱。宋亭亭等[4]认为BA患儿肝硬化时期由于肝内纤维组织增生、血运紊乱等导致TGF-β1蛋白大量减少,与本实验结果相符。
综上所述,TGF-β1、Smad2协同促进BA早期肝纤维化至P-P、P-C型桥接结构形成;到了晚期肝硬化时TGF-β1、Smad2 mRNA表达减少导致TGF-β1蛋白表达减弱,两者促纤维化作用减轻。同时,本研究推测Smad2蛋白通过“磷酸化-去磷酸化”循环效率影响BA肝内TGF-β1通路的促纤维化作用,这需要建立BA小鼠模型进行体外抑制实验验证,干扰Smad2磷酸化过程可能在BA肝纤维化早期阻断TGF-β1促纤维化通路,从而终止肝纤维化进程。
参考文献
[1]Salzedas-Netto AA,Chinen E,de Oliveira DF,et al.Grade IV fibrosis interferes in biliary drainage after kasai procedure[J].Transplant Proc,2014,46(6):1781-1783.doi:10.1016/j.transproceed.2014.05.045.
[2]Zhan JH,Chen YJ.How to evaluate the diagnosis and management of biliary atresia in the era of liver transplantation[J].Chin J Pediat Surg,2014,35(4):245-247.[詹江华,陈亚军.肝移植时代如何看待胆道闭锁的诊治[J].中华小儿外科杂志,2014,35(4):245-247].doi:10.3760/cma.j.issn.0253-3006.2014.04.003.
[3]Iordanskaia T,Hubal MJ,Koeck E,et al.Dysregulation of upstream and downstream transforming growth factor-β transcripts in livers of children with biliary atresia and fibrogenic gene signatures[J].J Pediatr Surg,2013,48(10):2047-2053.doi:10.1016/j. jpedsurg.2013.03.047.
[4]Song TT,Zhan JH,Gao W,et al.Expression of CD14,CD34 and transforming growth factor-β1 in the liver biopsy of biliary atresia [J].Chin J Pediat Surg,2015,36(1):24-28.[宋亭亭,詹江华,高伟,等.胆道闭锁肝组织CD14、CD34、TGF-β1表达研究[J].中华小儿外科杂志,2015,36(1):24-28].doi:10.3760/cma.j. issn.0253-3006.2015.01.015.
[5]Jiang Y,Jin XM,Tu K.A primary study using the method of average positive stained area percentage to measure the immunohistochemistry results[J].Journal of Biomedical Engineering,2007,24(3):650-653.[姜洋,金小明,屠康.平均阳性染色面积百分比法分析免疫组化结果初探[J].生物医学工程学杂志,2007,24(3):650-653].doi:10.3321/j.issn:1001-5515.2007.03.039.
[6]Zhan JH.The early screening and counter measures of biliary atresia [J].Tianjin Med J,2015,43(1):1-3.[詹江华.胆道闭锁早期筛查现状及对策[J].天津医药,2015,43(1):1-3].doi:10.3969/j. issn:0253-9896.2015.01.001.
[7]Kamato D,Burch ML,Piva TJ,et al.Transforming growth factor-β signalling:role and consequences of Smad linker region phosphory⁃lation[J].Cell Signa,2013,25(10):2017-2024.doi:10.1016/j. cellsig.2013.06.001.
[8]Gaarenstroom T,Hill CS.TGF-β signaling to chromatin:how Smads regulate transcription during self-renewal and differentiation [J].Semin Cell Dev Biol,2014,32(1):107-118.doi:10.1016/j. semcdb.2014.01.009.
[9]Lee JH,Lee H,Joung YK,et al.The use of low molecular weight heparin-pluronic nanogels to impede liver fibrosis by inhibition the TGF-β/Smad signaling pathway[J].Biomaterials,2011,32 (5):1438-1445.doi:10.1016/j.biomaterials.2010.10.023.
[10]Iordanskaia T,Koeck E,Rossi C,et al.Integrin β-8,But Not β-5 or-6,protein expression is increased in livers of children with bili⁃ary atresia[J].J Pediatr Gastroenterol Nutr,2014,59(6):679-683.doi:10.1097/MPG.0000000000000518.
[11]Vrljicak P,Myburgh D,Ryan AK,et al.Smad expression during kidney development[J].Am J Physiol Renal Physiol,2004,286(4):625-633.
(2015-10-19收稿2016-01-18修回)
(本文编辑李国琪)
中图分类号:R726.574
文献标志码:A
DOI:10.11958/20150242
The effects of TGF-β1 and Smad2 on liver fibrosis of biliary atresia
DING Meiyun1,ZHAN Jianghua2△,ZHAO Li2,ZHAO Linsheng2,ZHANG Aihua2
1 The Graduate School of Tianjin Medical University,Tianjin 300070,China;2 Tianjin Children’s Hospital△Corresponding AuthorE-mail:zhanjianghuatj@163.com
Abstract:ObjectiveTo investigate the expression and function of transforming growth factor(TGF)-β1 and Smad2 in liver fibrosis of biliary atresia(BA).MethodsLiver biopsy specimens were collected from autopsy(normal group,n=5), congenital biliary dilatation(CBD group,n=10),BA patients underwent Kasai procedure(early hepatic fibrosis group,n=19) and liver transplantation(transplantation group,n=11).The first three groups were collected from January 2010 to July 2014 in Tianjin Children’s Hospital,and the last group was collected from January 2013 to January 2014 in Tianjin First Central Hospital.The hematoxylin and eosin(HE)stain were used to observe the degree of liver fibrosis of four groups. Immunohistochemistry(IHC)was used to observe expressions of TGF-β1 and Smad2 in liver tissues of these samples. Quantitative real-time polymerase chain reaction(qRT-PCR)was used to test the quantitative mRNA of TGF-β1 and Smad2 in these samples.ResultsResults of HE showed that no fibrosis in autopsy group,mild fiber cell hyperplasia in CBD group,severe fibrosis in Kasai group and significant pseudolobule in transplantation group.Results of IHC showed that TGF-β1 was expressed in the cytoplasm of hepatocytes,bile duct cells,lymphocytes and neutrophils.The average optical density of TGF-β1 was the highest in Kasai group compared with that of other three groups(P<0.05).There was no significant difference in Smad2 expression in cytoplasm of hepatocytes,bile duct cells and lymphocytes between four groups (P>0.05).Results of qRT-PCR showed that both TGF-β1 mRNA and Smad2 mRNA were the highest in early hepatic fibrosis group than those of CBD group and transplantation group(P<0.017).ConclusionIn early stage of BA,TGF-β1 and Smad2 promote liver fibrosis until the formation of P-P,P-C desmosome structure.However,with BA fibrosis becomes more serious,the pro-fibrogenic function of TGF-β1 and Smad2 becomes less.
Key words:biliary atresia;liver cirrhosis;transforming growth factor beta1;Smad 2 protein;liver fibrosis

