Rho激酶在氢气保护LPS诱导的Caco-2细胞上皮屏障功能障碍中的机制研究
马小叶,于洋,张红涛,谢克亮,2,于泳浩,2△
细胞与分子生物学
Rho激酶在氢气保护LPS诱导的Caco-2细胞上皮屏障功能障碍中的机制研究
马小叶1,于洋1,张红涛1,谢克亮1,2,于泳浩1,2△
摘要:目的探讨Rho激酶(ROCK)在氢气改善离体脓毒症肠屏障功能中的作用。方法常规培养人结肠上皮细胞Caco-2,分为6组(n=3):对照组(C组)、富氢培养基组(H组)、脂多糖(LPS)处理组(L组)、富氢培养基+LPS组(HL组)、Rho激酶抑制剂Y-27632组(Y组)、Y-27632+LPS组(YL组)。H组给予0.6 mmol/L富氢培养基;LPS和Y-27632的处理浓度分别为50 mg/L、25 μmol/L。建立Transwell小室模型,定期检测跨上皮电阻值(TEER值),当TEER值达到800 Ω·cm2后给予处理,于6、12、24 h检测TEER值,24 h时检测FITC-右旋糖酐通过率。细胞接种于6孔板,融合达80%~90%后给予处理,实时聚合酶链式反应技术检测闭锁小带蛋白1(ZO-1)mRNA和ROCK mRNA表达情况;蛋白免疫印迹技术检测ZO-1蛋白和ROCK蛋白表达水平。结果与C组比较,H组12、24 h TEER值升高(P<0.05),FITC-右旋糖酐通过率、ZO-1蛋白和ROCK蛋白表达水平差异无统计学意义;Y组6、12、24 h TEER值升高(P<0.05),FITC-右旋糖酐通过率差异无统计学意义,ZO-1 mRNA表达增加,ROCK mRNA表达减少(均P<0.05);L组6、12、24 h TEER值降低,FITC-右旋糖酐通过率增高,ZO-1 mRNA和蛋白表达均下降,ROCK mRNA和蛋白表达均增加(P<0.05)。与L组比较,6、12、24 h YL组TEER值增高,FITC-右旋糖酐通过率降低,ZO-1 mRNA表达增加,ROCK mRNA表达降低(均P<0.05)。与L组比较,HL组6、12、24 h TEER值增高,FITC-右旋糖酐通过率降低,各时间点ZO-1蛋白表达上升,ROCK蛋白表达下降(均P<0.05)。结论氢气可保护脓毒症肠屏障功能,改善肠上皮屏障完整性和通透性,增加肠细胞间紧密连接蛋白表达,这些保护机制可能与氢气抑制LPS诱导的ROCK过度表达有关。
关键词:rho相关激酶类;氢;脂多糖类;脓毒症;Caco-2细胞;肠上皮屏障功能
基金项目:国家自然科学基金资助项目(81071533,81372033);天津市应用基础及前沿技术研究计划(13JCQNJC11400)
作者单位:1天津医科大学总医院麻醉科(邮编300052);2天津市麻醉学研究所
作者简介:马小叶(1989),女,硕士在读,主要从事氢气对脓毒症器官功能保护方面的研究
△
通讯作者E-mail:yuyonghao@126.com
1 材料与方法
1.1主要试剂及仪器胎牛血清(BioInd公司,以色列);DMEM高糖培养基(Hyclone公司,美国);GCH300高纯氢气发生器(天津同普分析仪器科技有限公司);Transwell小室(Corning公司,美国);EVOM细胞电阻仪(WPI公司,美国);FITC-右旋糖酐、大肠杆菌脂多糖(LPS)、Rho激酶抑制剂Y-27632(Sigma公司,美国);热启动荧光定量PCR试剂盒(上海生工生物工程有限公司);小鼠单克隆抗闭锁小带蛋白1 (zonula occludens-1,ZO-1)抗体、兔单克隆抗ROCK抗体(Abcam,英国);小鼠单克隆抗β-actin抗体、HRP标记山羊抗小鼠抗体、HRP标记山羊抗兔抗体(杭州华安生物技术有限公司)。
1.2Caco-2细胞培养人结肠上皮Caco-2细胞购自上海中科院细胞库,以含20%胎牛血清的高糖DMEM培养基培养,培养基中加入1%青霉素-链霉素双抗。生长状态良好的细胞,用0.25%胰蛋白酶-EDTA消化,1∶2传代,于37℃,5%CO2培养箱中贴壁培养,传代24 h后更换培养基,以后每隔1 d更换1次培养基,5~6 d传代1次。
1.3富氢培养基制备通过高纯氢气发生器将高纯度氢气(纯度>99.999 9%)加压充入DMEM高糖培养基中。富氢培养基现用现配,以氢电极检测氢气浓度为0.6 mmol/L,过滤消毒后留作细胞处理。
1.4分组及处理
1.4.1实验分组取状态良好,处于生长对数期的Caco-2细胞进行实验。实验分为对照组(C组)、富氢培养基组(H组)、LPS处理组(L组)、富氢培养基+LPS组(HL组)、ROCK抑制剂Y-27632组(Y组)、ROCK抑制剂Y-27632+LPS组(YL组)。C组与H组分别加入等容量DMEM高糖培养基和0.6 mmol/L富氢培养基。LPS处理浓度为50 mg/L,Y-27632处理浓度为25 μmol/L。
1.4.2Caco-2细胞单层模型的建立和模型完整性检验取生长状态良好的Caco-2细胞以5.5×105个/mL的密度接种于Transwell小室内(500 μL/孔),外室内加培养基600 μL/孔。接种24 h后换培养基,接种后第1周隔1 d换1次培养基,之后每天更换培养基。每天在显微镜下观察小室内细胞生长情况,定期用EVOM细胞电阻仪检测小室底层细胞跨上皮电阻值(TEER),具体操作方法参照仪器说明书。当TEER值达到800 Ω·cm2后分别给予细胞6组不同处理(n=3),于37℃温箱中无菌孵育,分别于处理前(0 h),处理后6、12、24 h检测TEER值。若TEER值降低则表明模型的完整性降低。
1.4.3Caco-2细胞单层模型通透性的检测同上述建立Caco-2细胞小室模型,TEER值达800 Ω·cm2后分别给予6组不同处理(n=3),于37℃温箱中孵育至24 h。小心吸出内室及外室的培养基,无菌PBS清洗3次,向内室中加入1 g/L FITC-右旋糖酐,外室中加入无菌PBS。避光置于37℃温箱中,2 h后在外室取样100 μL于黑色96孔板中,荧光分光光度计检测FITC的荧光强度。
1.4.4实时聚合酶链式反应(RT-PCR)检测ZO-1和ROCK mRNA表达将培养的Caco-2细胞制成单细胞悬液,细胞计数后以1×106/mL密度均匀接种于6孔板,2 mL/孔。细胞融合达80%~90%时,分别给予细胞C组、L组、Y组和YL组4种处理(n=3),培养24 h后用Trizol试剂法提取细胞总RNA。用逆转录试剂盒逆转录合成cDNA(2步法),SYBR GreenⅠ法进行RT-PCR检测。引物序列为:GAPDH引物上游 5′-TTGGCATCGTTGAGGGTCT-3′,下游 5′-CAGT⁃GGGAACACGGAAAGC-3′;ZO-1引物上游5′-AAAGTGCT⁃GGCTTGGTCTGT-3′,下 游 5′-TAGGTGACGCTGGGT⁃GATAG-3′;ROCK引物上游5′-TCCTCTGCTAAGTCTC⁃CATCG-3′,下游5′-GACAGCCTCACTCTCCCATT-3′,扩增片段长度分别为206、105、103 bp。94℃预变性4 min;94℃变性30 s,57℃退火30 s,72℃延伸60 s,30个循环后72℃延伸7 min,每个循环在72℃时采集荧光,所得Ct值用2-ΔΔCt法计算目的基因相对表达量。
1.4.5蛋白免疫印迹技术(Western blot)检测ZO-1及ROCK蛋白表达6孔板培养细胞至细胞融合达80%~90%时,给予C组、H组、L组、HL组4种处理(n=3),分别于6、12、24 h用细胞裂解液提取细胞蛋白,BCA法检测蛋白浓度。蛋白经6%SDS-PAGE凝胶电泳后转移至PVDF膜,5%脱脂牛奶封闭2 h后分别孵以小鼠抗ZO-1抗体(1∶200)、兔抗ROCK抗体(1∶500)、小鼠抗β-actin抗体(1∶2 000)4℃过夜。TBST洗膜后,分别孵育辣根过氧化酶(HRP)标记的山羊抗鼠或山羊抗兔抗体,室温下置于摇床上1 h。TBST清洗后于暗室中滴加显影液显影。Bio-Rad图像分析系统分析条带灰度值,计算目的蛋白与内参蛋白灰度值比值得到目的蛋白相对表达量。
1.5统计学方法应用SPSS 18.0统计学软件,计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析,多重比较行LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1显微镜下观察各组处理后细胞形态改变倒置显微镜下观察可见C组、H组、Y组细胞生长状态良好,细胞连接紧密,呈鹅卵石状,形态饱满,折光性好。L组细胞数目显著减少,细胞生长分散稀疏,相邻细胞间彼此脱离,细胞形态改变,呈不规则状,折光性减弱;随时间延长,这些改变更加明显。HL组和YL组与L组相比细胞数量增多,生长更紧密,折光性增强。
2.2Caco-2细胞小室模型TEER值和小室FITC-右旋糖酐通过率的改变与C组相比,H组12、24 h TEER值升高;Y组6、12、24 h TEER值升高(P<0.05);L组、HL组和YL组细胞6、12、24 h TEER值均降低(P<0.05)。与L组相比,HL组和YL组6、12、24 h TEER值增高(P<0.05)。处理24 h后,与C组相比,L组、HL组和YL组小室模型FITC-右旋糖酐通过率升高(P<0.05),与L组相比,HL组和YL组小室FITC-右旋糖酐通过率降低(P<0.05);H组和Y组小室FITC-右旋糖酐通过率与C组相比差异无统计学意义。见表1。
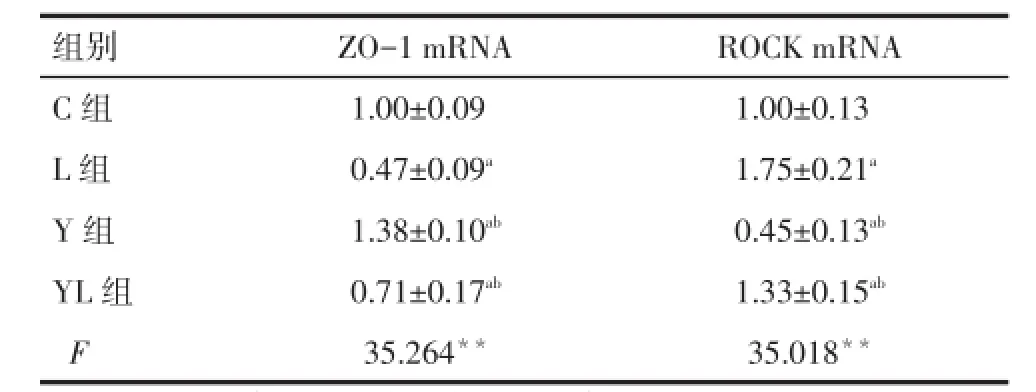
2.3Caco-2细胞ZO-1 mRNA与ROCK mRNA表达与C组相比,Y组ZO-1 mRNA表达显著增多,L组和YL组ZO-1 mRNA表达减少;YL组比L组表达量增多,差异均有统计学意义(均P<0.05)。与C组相比,Y组ROCK mRNA表达显著减少,L组和YL组显著增加;与L组相比,YL组ROCK mRNA表达减少,差异均有统计学意义(均P<0.05),见表2。
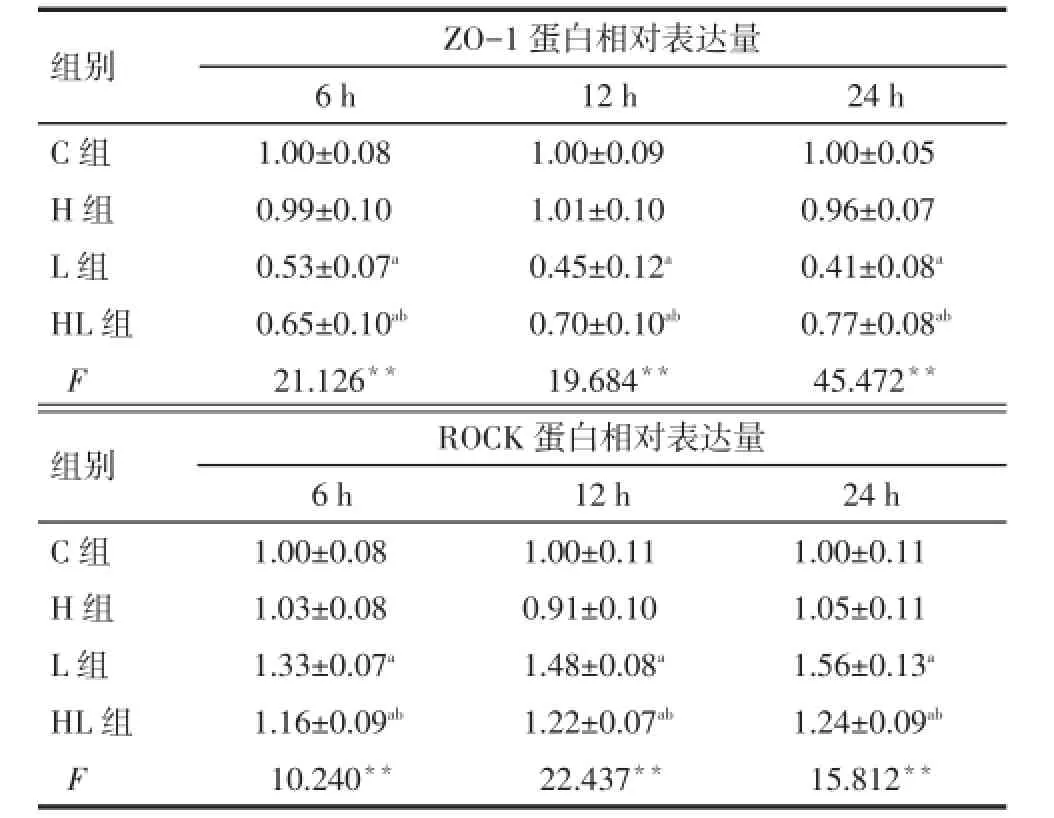
2.4Caco-2细胞ZO-1蛋白和ROCK蛋白表达量与C组比较,3个时间点处L组ZO-1蛋白表达均有下降(均P<0.05);与L组相比,HL组ZO-1蛋白表达均升高(均P<0.05)。与C组相比,3个时间点L组ROCK蛋白表达均增加,与L组相比,HL 组ROCK蛋白表达下降,随时间延长下降幅度增加,但仍高于C组(均P<0.05)。各个时间点H组与C组ZO-1蛋白和ROCK蛋白表达差异均无统计学意义。见图1、表3。
Tab.1 Effects of different treatments on TEER value and FITC-dextran permeability of Caco-2 cell chamber model表1 不同处理对Caco-2细胞小室模型TEER值和FITC-右旋糖酐通过率的影响 (n=3,±s)

Tab.1 Effects of different treatments on TEER value and FITC-dextran permeability of Caco-2 cell chamber model表1 不同处理对Caco-2细胞小室模型TEER值和FITC-右旋糖酐通过率的影响 (n=3,±s)
**P<0.01;a与C组比较,b与L组比较,P<0.05
组别C组H组L组HL组Y组YL组F TEER相对值(%)0 h 100.00±2.38 101.00±2.82 100.60±3.41 100.24±2.80 100.84±2.71 101.20±2.50 0.082 6 h 101.61±2.07 103.13±2.41 78.30±3.14a90.61±3.04ab105.72±3.03ab93.70±2.80ab40.642**12 h 103.50±2.02 108.30±2.02a74.72±2.48a91.30±2.32ab107.60±2.12ab88.84±2.64ab100.272**24 h 103.94±2.17 110.74±2.25a71.57±2.44a94.70±2.98ab108.12±2.27ab87.95±2.54ab108.416**FITC-右旋糖酐通过率(24 h)1.00±0.19 0.86±0.18 2.27±0.21a1.47±0.21ab0.89±0.20b1.54±0.19ab22.477**
Tab.2 The effects of Y-27632 on ZO-1 mRNA and ROCK mRNA expressions in LPS-induced Caco-2 cells 表2Y-27632对LPS诱导Caco-2细胞ZO-1 mRNA和ROCK mRNA表达改变的影响 (n=3,±s)
Tab.2 The effects of Y-27632 on ZO-1 mRNA and ROCK mRNA expressions in LPS-induced Caco-2 cells 表2Y-27632对LPS诱导Caco-2细胞ZO-1 mRNA和ROCK mRNA表达改变的影响 (n=3,±s)
**P<0.01;a与C组比较,b与L组比较,P<0.05
组别C 组L 组Y 组Y L 组F Z O -1 m R N A 1 . 0 0 ± 0 . 0 9 0 . 4 7 ± 0 . 0 9a1 . 3 8 ± 0 . 1 0ab0 . 7 1 ± 0 . 1 7ab3 5 . 2 6 4**R O C K m R N A 1 . 0 0 ± 0 . 1 3 1 . 7 5 ± 0 . 2 1a0 . 4 5 ± 0 . 1 3ab1 . 3 3 ± 0 . 1 5ab3 5 . 0 1 8**
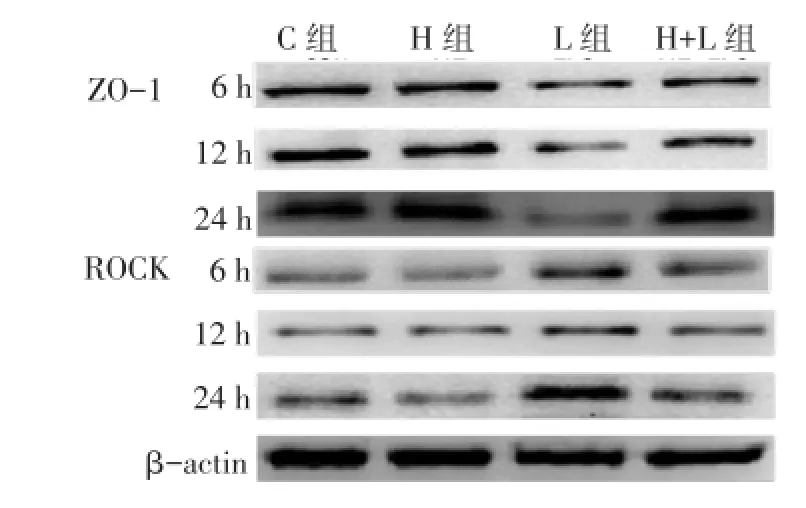
Fig.1 The relative protein expressions of ZO-1 and ROCK in Caco-2 cells图1 Caco-2细胞ZO-1蛋白和ROCK蛋白相对表达量
Tab.3 The relative protein expression levels of ZO-1 and ROCK at different time points in Caco-2 cells表3不同时间点Caco-2细胞ZO-1蛋白和ROCK蛋白相对表达量 (n=3,±s)
Tab.3 The relative protein expression levels of ZO-1 and ROCK at different time points in Caco-2 cells表3不同时间点Caco-2细胞ZO-1蛋白和ROCK蛋白相对表达量 (n=3,±s)
**P<0.01;a与C组比较,b与L组比较,P<0.05
组别C组H组L组HL组F ZO-1蛋白相对表达量6 h 1.00±0.08 0.99±0.10 0.53±0.07a0.65±0.10ab21.126**12 h 1.00±0.09 1.01±0.10 0.45±0.12a0.70±0.10ab19.684**24 h 1.00±0.05 0.96±0.07 0.41±0.08a0.77±0.08ab45.472**组别C组H组L组HL组F ROCK蛋白相对表达量6 h 1.00±0.08 1.03±0.08 1.33±0.07a1.16±0.09ab10.240**12 h 1.00±0.11 0.91±0.10 1.48±0.08a1.22±0.07ab22.437**24 h 1.00±0.11 1.05±0.11 1.56±0.13a1.24±0.09ab15.812**
3 讨论
TEER和FITC-右旋糖酐通过率是常用的检测Caco-2细胞单层屏障功能变化的敏感指标,TEER值主要反映了肠屏障模型离子通透性的改变,而FITC-右旋糖酐通过率则反映了大分子物质透过肠屏障模型的能力。不同实验条件和不同克隆Caco-2细胞测得的TEER值差别较大,可从500~1 500 Ω·cm2不等[6]。本实验中建立的Caco-2细胞单层模型TEER值均达到800 Ω·cm2,可完全满足实验的要求。
相邻肠上皮细胞间紧密连接蛋白相互连接,在细胞的顶端形成环状带,控制物质从细胞旁途径跨越肠上皮的移动。ZO-1是第一个被分离出来的紧密连接蛋白,其连接于其他紧密连接蛋白和细胞骨架蛋白之间,调节细胞间连接和细胞旁通透性[7]。ROCK于20世纪90年代被分离出来,广泛分布于各组织器官,有2种亚型:ROCK1和ROCK2。ROCK主要通过调节细胞骨架影响细胞的生命活动[4]。Y-27632是ROCK的特异性抑制剂,对ROCK1和ROCK2均有抑制作用。有文献报道,ZO-1蛋白与细胞中的肌动蛋白丝相连[7],而ROCK也可通过调节细胞内肌动蛋白丝的聚集与解离使细胞骨架重组,连接旁肌动球蛋白环(perijunctional actomyosin ring,PAMR)收缩,增加肠上皮的通透性[8]。Van Itallie等[9]发现ROCK可通过影响ZO-1蛋白改变肠屏障的功能状态。Mirza等[10]认为ROCK通过使致病性酵母菌诱导的Caco-2细胞的肌动蛋白细胞骨架重组和ZO-1蛋白丢失,进而增加肠上皮通透性。本实验结果表明,LPS可诱导Caco-2细胞ROCK mRNA表达增高,ROCK蛋白表达上调,降低ZO-1 mRNA和蛋白的表达水平。而ROCK抑制剂Y-27632可有效改善Caco-2单层细胞脓毒症模型的完整性和通透性,缓解LPS引起的Caco-2细胞ZO-1 mRNA表达下调,与本课题组的在体研究结果一致[11]。因此本实验表明,ROCK参与了LPS诱导的Caco-2细胞脓毒症模型中ZO-1蛋白的表达改变,抑制ROCK过度表达可改善离体肠屏障模型的功能状态。
氢气是一种选择性抗氧化剂,对多种疾病具有治疗作用[12],但其治疗机制尚不清楚;由于其安全温和、易透过生物膜等优点[13],在临床上有广阔的应用前景。本课题组前期研究发现,氢气能有效改善脓毒症肠屏障功能障碍[3]。本实验研究显示氢气可改善Caco-2细胞脓毒症肠屏障模型的完整性和通透性,抑制细胞内ROCK过度表达,增加ZO-1蛋白表达。结合上述实验结论,可推测氢气可能通过ROCK改善离体脓毒症肠屏障的功能状态。然而氢气治疗作用广泛,对多种疾病都有治疗作用,也有文献报道氢气的治疗作用可能通过其他作用靶点实现[6,13]。因此推测,氢气可通过多种途径调节保护脓毒症肠屏障功能状态,ROCK可能参与了氢气的保护机制,而氢气对脓毒症肠屏障复杂的保护机制仍有待研究。
综上所述,氢气可保护脓毒症肠屏障功能,改善肠上皮屏障完整性和通透性,增加肠细胞间紧密连接蛋白表达,这些保护机制可能与氢气抑制LPS诱导的ROCK过度表达有关。
参考文献
[1]An G,Namas RA,Vodovotz Y.Sepsis:from pattern to mechanism and back[J].Crit Rev Biomed Eng,2012,40(4):341-351.doi:10.1615/CritRevBiomedEng.v40.i4.80.
[2]Clark JA,Coopersmith CM.Intestinal crosstalk:a new paradigm for understanding the gut as the“motor”of critical illness[J].Shock,2007,28(4):384-393.doi:10.1097/shk.0b013e31805569df.
[3]Li Y,Xie KL,Chen HG,et al.The role of Nrf2 in the hydrogen treatment for intestinal injury caused by severe sepsis[J].Chin Crit Care Med,2014,26(6):415-419.[李媛,谢克亮,陈红光,等.Nrf2在氢气治疗严重脓毒症肠损伤中的作用[J].中华危重病急救医学,2014,26 (6):415-419].doi:10.3760/cma.j.issn.2095-4352.2014.06.010.
[4]Matsui T,Amano M,Yamamoto T,et al.Rho-associated kinase,a novel serine/threonine kinase,as a putative target for the small GTP binding protein Rho[J].EMBO J,1996,15(9):2208-2216.
[5]Walsh SV,Hopkins AM,Chen J,et al.Rho kinase regulates tight junction function and is necessary for tight junction assembly in polarized intestinal epithelia[J].Gastroenterology,2001,121(3):566-579.doi:10.1053/gast.2001.27060.
[6]Ranaldi G,Consalvo R,Sambuy Y,et al.Permeability characteristics of parental and clonal human intestinal Caco-2 cell lines differentiated in serum-supplemented and serum-free media[J].Toxicol In Vitro, 2003,17(5/6):761-767.doi:10.1016/S0887-2333(03)00095-X.
[7]Fanning AS,Jameson BJ,Jesaitis LA,et al.The tight junction protein ZO-1 establishes a link between the transmembrane protein occludin and the actin cytoskeleton[J].J Biol Chem,1998,273 (45):29745-29753.doi:10.1074/jbc.273.45.29745.
[8]Le Dréan G,Haure-Mirande V,Ferrier L,et al.Visceral adipose tissueandleptinincreasecolonicepithelialtightjunction permeability via a RhoA-ROCK-dependent pathway[J].FASEB J,2014,28(3):1059-1070.doi:10.1096/fj.13-234203.
[9]Van Itallie CM,Fanning AS,Bridges A,et al.ZO-1 stabilizes the tight junction solute barrier through coupling to the perijunctional cytoskeleton[J].Mol Biol Cell,2009,20(17):3930-3940.doi:10.1091/mbc.E09-04-0320.
[10]Mirza HT,Wu Z,Teo JD,et al.Statin pleiotropy prevents rho kinase-mediated intestinal epithelial barrier compromise induced by Blastocystis cysteine proteases[J].Cell Microbiol,2012,14(9):1474-1484.doi:10.1111/j.1462-5822.2012.01814.x.
[11]Zhang HT,Yu Y,Liu LL,et al.The role of JNK in the hydrogen treatment for intestinal barrier dysfunction in severe septic mice[J]. Tianjin Med J,2016,44(5):573-576.[张红涛,于洋,刘玲玲,等. JNK在氢气改善重度脓毒症小鼠肠屏障功能障碍中的作用[J].天津医药,2016,44(5):573-576].doi:10.11958/20150388.
[12]Dixon BJ,Tang J,Zhang JH.The evolution of molecular hydrogen:a noteworthy potential therapy with clinical significance[J].Med Gas Res,2013,3(1):10.doi:10.1186/2045-9912-3-10.
[13]Ohsawa I,Ishikawa M,Takahashi K,et al.Hydrogen acts as a therapeutic antioxidant by selectively reducing cytotoxic oxygen radicals[J].Nat Med,2007,13(6):688-694.doi:10.1038/nm1577.
(2016-01-21收稿2016-03-10修回)
(本文编辑李国琪)
中图分类号:R364.5
文献标志码:A
DOI:10.11958/20160025
The role of Rho kinase in the protective effects of hydrogen on the damage of Caco-2 epithelial barrier induced by LPS
MA Xiaoye1,YU Yang1,ZHANG Hongtao1,XIE Keliang1,2,YU Yonghao1,2△
1 Department of Anesthesiology,Tianjin Medical University General Hospital,Tianjin 300052,China;
2 Tianjin Institute of Anesthesiology
△Corresponding AuthorE-mail:yuyonghao@126.com
Abstract:ObjectiveTo investigate the role of Rho kinase(ROCK)in the protective effects of hydrogen on intestinal epithelial barrier function in sepsis.MethodsCaco-2 cells were cultured routinely,and divided into 6 groups randomly(n= 3):control group(C group),hydrogen-rich medium group(H group),lipopolysaccharide(LPS)-treatment group(L group),hy⁃drogen+LPS-treatment group(HL group),Rho kinase inhibitor(Y-37632)treatment group(Y group)and Rho kinase inhibi⁃tor Y-27632+LPS-treatment group(YL group).H group was treated with 0.6 mmol/L hydrogen-rich media.The concentra⁃tion of LPS and Y-27632 were 50 mg/L and 25 μmol/L separately.After the Caco-2 monolayer model was established,the transepithelial electrical resistance(TEER)values were measured regularly.When the TEER value reached 800 Ω·cm2,the treatment was administered.Then TEER values were measured at 6 h,12 h and 24 h,and FITC-dextran permeability was de⁃tected at 24 h.Cells were seeded on 6-well plates.After cell density reached 80%-90%,treatments were given randomly. The real time-polymerase chain reaction(RT-PCR)was conducted to assess mRNA levels of ZO-1 and ROCK mRNA.ZO-1 and ROCK protein expression levels were detected by Western blot assay.ResultsCompared with C group,TEER values were elevated in 12 h and 24 h in H group(P<0.05).There were no statistical significances in FITC-dextran permeability,protein expression levels of ZO-1 and ROCK between C group and H group(P>0.05).TEER values were elevated at 6 h,12 h and 24 h in Y group(P<0.05).There was no significant difference in FITC-dextran permeability between C group and Y group(P>0.05).The mRNA expression of ZO-1 increased and mRNA expression of ROCK decreased in Y group(P< 0.05).The TEER values reduced at 6 h,12 h and 24 h in L group.The FITC-dextran permeability increased significantly, mRNA and protein expressions of ZO-1 significantly decreased,mRNA and protein expressions of ROCK significantly in⁃creased in L group(all P<0.05).Compared with L group,TEER values increased significantly at 6 h,12 h and 24 h in YL group,FITC-dextran permeability decreased,mRNA expressions of ZO-1 increased,mRNA expressions of ROCK de⁃creased in YL group(P<0.05).Compared with L group,TEER values increased at 6 h,12 h and 24 h in HL group,FITC-dextran permeability reduced markedly,protein expressions of ZO-1 increased at each time point,protein expressions of ROCK decreased at each time point in HL group(P<0.05).ConclusionHydrogen can protect intestinal barrier function against sepsis,ameliorate the integrity and permeability of intestinal epithelium and increase the expressions of intercellular tight junction proteins.The suppression of Rho kinase over-expression induced by LPS may be involved in these protective effects of hydrogen.
Key words:rho-associated kinases;hydrogen;lipopolysaccharides;sepsis;Caco-2 cells;intestinal epithelial barrier function脓毒症是感染引起的全身炎症反应综合征(SIRS)。脓毒症常继发于创伤、大手术等引发的严重感染,可发生于各年龄段的患者。脓毒症发生率、病死率高,在美国,每年因脓毒症死亡人数约占总死亡人数的10%,是重症监护室(ICU)患者的第二大死因,幸存者也常因为并发症和后遗症而导致生活质量严重下降[1]。肠屏障一直被认为是脓毒症的“motor”[2],其构成错综复杂,在脓毒症的发生发展中扮演了重要的角色,是脓毒症治疗的研究热点。肠道细胞间的紧密连接使相邻肠细胞紧密锚定、相互沟通,与肠细胞共同构成了肠上皮的机械屏障。近年来研究显示,氢气对多种疾病具有治疗作用,本课题组前期研究显示,氢气在脓毒症模型中对肠屏障具有保护作用[3],然而具体作用机制并不明确。Rho激酶(ROCK)是一种丝/苏氨酸蛋白激酶,参与多种细胞内生命活动,可对细胞骨架蛋白起到调节作用[4]。研究发现,ROCK可以通过调节肠上皮细胞间紧密连接蛋白进而影响肠屏障通透性[5]。本实验旨在探讨ROCK在氢气对脓毒症肠屏障保护中的作用机制。

