胆道闭锁患儿肝移植术后EB病毒感染的危险因素分析
王天成,朱志军,孙丽莹,魏林,曲伟,曾志贵,刘颖,何恩辉,张梁,王永翠,王玥
胆道闭锁患儿肝移植术后EB病毒感染的危险因素分析
王天成1,朱志军2△,孙丽莹2,魏林2,曲伟2,曾志贵2,刘颖2,何恩辉3,张梁4,王永翠1,王玥1
摘要:目的探讨胆道闭锁患儿肝移植术后EB病毒(EBV)感染的发生情况及危险因素。方法回顾性分析因胆道闭锁致肝硬化接受肝脏移植的65例患儿的临床资料,据EBV感染情况分成感染组30例与非感染组35例,对所有患儿的肝移植术前、术中及术后等资料进行单因素分析,并将组间比较P<0.1的变量纳入多因素Logistic回归分析中,筛选胆道闭锁患儿肝移植术后EBV感染的危险因素。结果在65例肝移植受者中,共有30例(46.15%)出现EBV感染,其中23例(76.67%)发生于术后3个月内。单因素分析显示,2组间手术时年龄<1岁、供者EBV血清学阳性而受者EBV血清学阴性、术后发生排斥反应、术后联合应用骁悉抗排异的比例以及术后他克莫司药物谷值浓度超过目标浓度的次数差异有统计学意义(P<0.05);将上述变量及采用亲体供肝(P=0.060)、术中红细胞输入量(P=0.063)同时纳入多因素Logistic回归分析,结果显示,供者EBV血清学阳性而受者EBV血清学阴性、术后发生急性排斥反应、术后他克莫司药物浓度超过目标浓度次数多是胆道闭锁患儿肝移植术后发生EBV感染的危险因素。结论供者EBV血清学阳性而受者EBV血清学阴性、术后发生急性排斥反应及术后他克莫司药物谷值浓度多次超过目标浓度与胆道闭锁患儿肝移植术后发生EBV感染密切相关,对此类患儿应给予适当的抗病毒药物预防EBV感染。
关键词:胆道闭锁;肝移植;疱疹病毒4型,人;危险因素;儿童
基金项目:北京市卫生系统高层次卫生技术人才培养计划项目(2014-2-002)
作者单位:1天津医科大学研究生院(邮编300070);2首都医科大学附属北京友谊医院普外科,国家消化系统疾病临床医学研究中心,移植耐受与器官保护北京市重点实验室;3首都医科大学附属北京友谊医院超声科,4麻醉科
作者简介:王天成(1988),男,硕士研究生在读,主要从事肝移植及肝胆外科研究
△
通讯作者E-mail:zhu-zhijun@outlook.com
肝移植是目前治疗终末期肝病的有效治疗方式之一,随着手术技术及免疫抑制方案的改进,受者及移植物的生存率有很大的提高[1]。虽然免疫抑制药物的改进减少了移植术后排斥反应的发生,但同时增加了感染的风险。胆道闭锁是儿童肝脏移植的主要适应证,大部分胆道闭锁患儿行肝移植手术时年龄小,术后感染风险高。EB病毒(Epstein-Barr virus,EBV)感染是移植术后常见的病毒感染之一,在免疫缺陷的个体中可导致淋巴细胞增生紊乱,从而导致移植后淋巴组织增生性疾病(posttransplant lymphoproliferative disorders,PTLD)的发生,PTLD已成为儿童移植术后远期死亡的主要原因之一。因此分析胆道闭锁患儿肝移植术后EBV感染的危险因素,并予早期预防和治疗,降低PTLD的发生,对于保证肝移植受者术后的长期生存是十分必要的。本研究回顾性分析65例胆道闭锁患儿的临床资料,探讨其肝移植术后EBV感染的发生情况及危险因素。
1 对象与方法
1.1研究对象入选2014年4月—2015年7月北京友谊医院肝移植科收治的因胆道闭锁致肝硬化行肝移植术的患儿68例。手术指征[2]:未接受肝门-空肠吻合术(Kasai手术)受者出现肝硬化、肝功能失代偿及营养不良,或接受Kasai手术后肝脏持续纤维化、黄疸或黄疸加深,或者并发腹水、食管静脉曲张出血、肝昏迷等现象者。排除标准:肝移植术后3个月内因多器官功能衰竭或呼吸系统并发症死亡(死亡原因与EBV感染无关)。共有65例纳入研究,根据肝移植术后是否发生EBV感染分为感染组30例和非感染组35例。
1.2手术方式及术后免疫抑制方案纳入研究的65例受者均行原位肝移植术,其中42例(64.62%)采用活体肝移植术,23例(35.38%)采用心脏死亡器官捐献(donation after cardiac death,DCD)来源肝移植术。术中单用甲基强的松龙10 mg/ kg或甲基强的松龙10 mg/kg联合巴利昔单抗免疫诱导。术后根据受者年龄及病情等个体化予他克莫司+吗替麦考酚酯+糖皮质激素或他克莫司+糖皮质激素免疫抑制方案抗排异治疗,并规律复查他克莫司药物谷值浓度,术后1个月内维持药物浓度在8~12µg/L,术后1~3个月内维持药物浓度在8~10µg/L,术后3~12个月维持药物浓度在6~8µg/L,超过上述谷值浓度者则定义为他克莫司药物谷值浓度超过目标浓度,并统计药物浓度超过目标浓度的次数。对于术后出现临床急性排斥反应,或经肝穿刺活检证实的急性排斥反应,则采用甲基强的松龙冲击治疗,并监测肝功能指标变化情况。
1.3EBV感染的检测、诊断及分组采用荧光定量PCR技术检测受者全血标本中的EBV-DNA,所有纳入研究的受者在术后1个月内每1~2周检测1次,术后2~6个月每月检测1次,术后7个月~1年每2个月检测1次,PCR测定值> 1 000拷贝/mL时诊断为EBV感染。取供者、受者术前的外周静脉血检测EBV-IgG,阳性者定义为血清学EBV阳性。
1.4抗病毒治疗方案移植术后受者诊断为EBV血症者,给予更昔洛韦(5 mg/kg,每12 h 1次)抗病毒治疗,同时酌情减少免疫抑制剂用量,监测血药浓度及肝功能,并根据EBVDNA复制水平调整药物用量。
1.5病例资料收集收集纳入研究的受者的临床资料。受者一般资料:性别、移植时月龄、移植时体质量。受者术前资料:手术时年龄<1岁、术前手术史、术前小儿终末期肝病模型评分(pediatric end-stage liver disease score,PELD评分)、EBV血清学状态(供者EBV血清学阳性/受者EBV血清学阴性,D+/R-)。受者术中资料:手术时间、术中失血量、气管插管时间、术中红细胞输入量、血浆输入量、是否联合应用巴利昔单抗;移植物信息:移植物质量、移植物种类、冷缺血时间、热缺血时间、移植物受体比重比(graft to recipient weight ratio,GRWR)。受者术后资料:ICU停留时间、住院时间、术后随访时间、急性排斥反应、术后联合应用吗替麦考酚酯胶囊(骁悉)抗排异、术后他克莫司药物谷值浓度超过目标浓度的次数。1.6统计学方法采用SPSS 19.0统计软件进行统计学分析,计数资料以例(%)表示,正态分布的计量资料以±s表示,非正态分布的计量资料以M(P25,P75)表示。单因素分析用χ2检验、独立样本t检验及Mann-Whitney U检验,并将P<0.1的危险因素纳入多因素分析中,多因素分析采用非条件Logistic多元逐步回归分析,暴露因素的危险程度采用优势比(OR)。P<0.05为差异有统计学意义。
2 结果
2.1受者的一般资料65例患儿中,30例(46.15%)发生EBV感染,其中23例(76.67%)发生于肝移植术后3个月内,7例(23.33%)发生于肝移植术后3个月以后。EBV感染组与非感染组的一般资料比较差异无统计学意义,见表1。
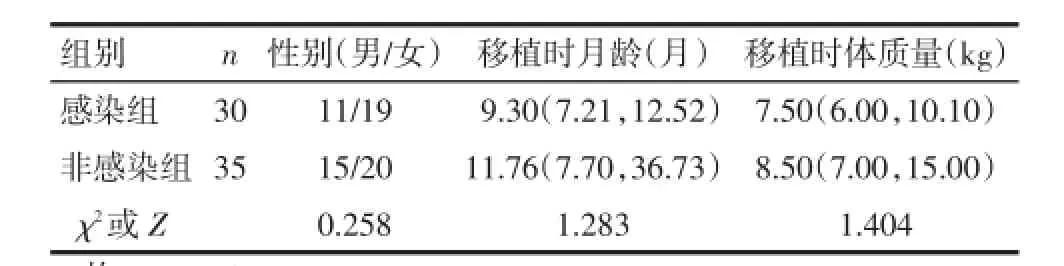
Tab.1 Comparison of clinical basic data between EBV infected group and non-infected group表1 EBV感染组与非感染组患儿一般资料的比较
2.2移植受者术后EBV感染危险因素的单因素分析 (1)术前资料。EBV感染组手术时年龄<1岁的受者比例明显高于非感染组,EBV血清学D+/R-的比例明显低于非感染组(P<0.05),见表2。(2)术中资料。EBV感染组受者手术中红细胞输入量较非感染组多,采用亲体供肝的受者比例较非感染组高,但差异无统计学意义(0.05<P<0.1),见表3。(3)术后资料。EBV感染组术后发生排斥反应的受者比例明显高于非感染组(P<0.05),术后他克莫司药物谷值浓度超过目标浓度的次数明显多于非感染组(P<0.05),术后联合应用骁悉抗排异的受者比例明显低于非感染组(P<0.05),见表4。
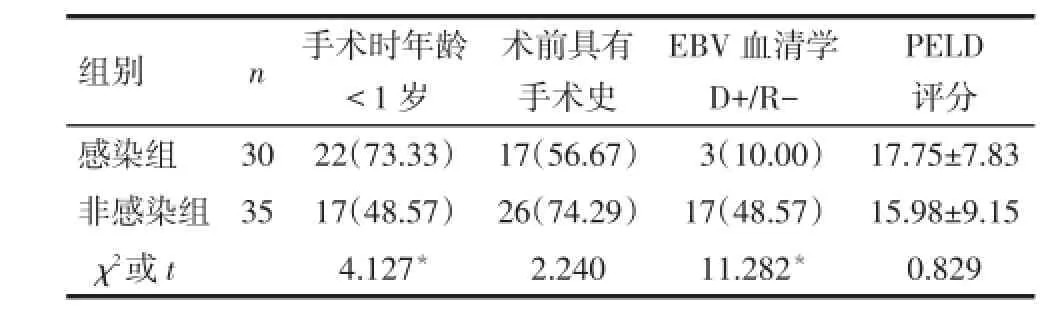
Tab.2 Comparison of the preoperative data between EBV infected group and non-infected group 表2 EBV感染组与非感染组患儿术前资料的比较
2.3移植受者术后EBV感染危险因素的多因素分析将单因素分析中所得到的EBV感染的危险因素:EBV血清学D+/R-、手术时年龄<1岁、术后发生急性排斥反应、术后联合应用骁悉抗排异、术后他克莫司药物谷值浓度超过目标浓度次数多,及采用亲体供肝(P=0.060)、术中红细胞输入量(P=0.063)同时纳入多因素Logistic回归分析发现,术后发生急性排斥反应、术后他克莫司药物浓度超过目标浓度次数多、EBV血清学D+/R-是胆道闭锁患儿肝移植术后发生EBV感染的危险因素,见表5~6。

Tab.3 Comparison of the related data in operation between EBV infected group and non-infected group表3 EBV感染组与非感染组患儿术中资料的比较
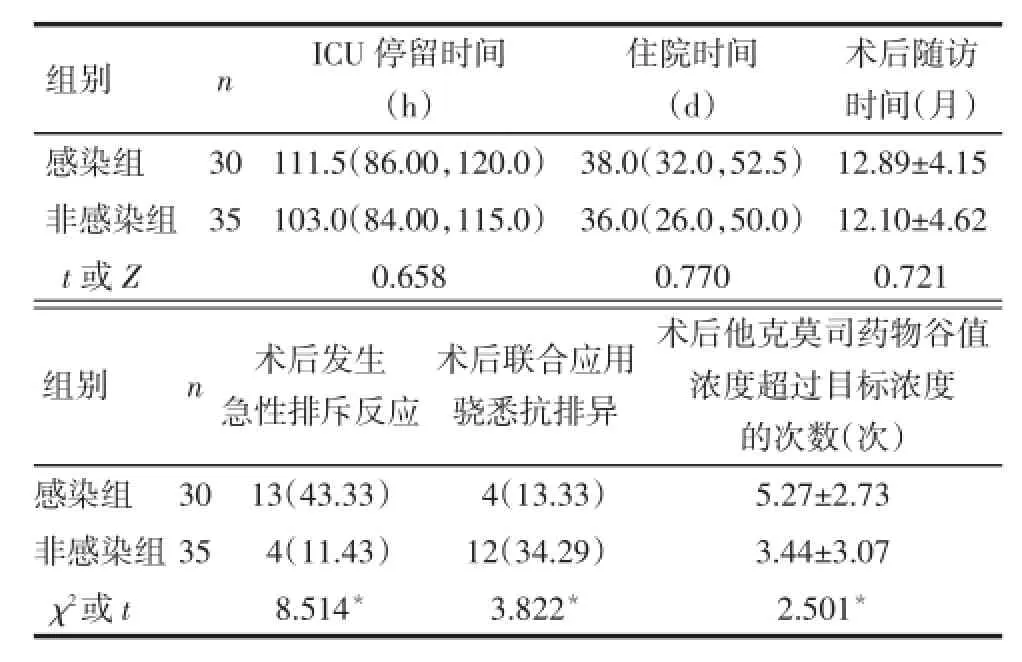
Tab.4 Comparison of the postoperative related data between EBV infected group and non-infected group表4 EBV感染组与非感染组患儿术后资料的比较
2.4预后本研究中的30例EBV感染的患儿中,1例(3.33%,1/30)出现PTLD,经抗病毒、调整免疫抑制剂及化疗后痊愈。其余经过抗病毒治疗或联合减量免疫抑制剂后,临床症状缓解,EBV-DNA载量为3.40×104(8.30×103,1.25×105),较治疗前1.10×105(1.98×104,3.82×105)明显下降(Z=2.509,P=0.012)。在感染组患儿中,12例(40.00%)患儿EBV-DNA转阴,2例出现EBV血症复发感染(外周血EBV-DNA转阴后再次转阳),至随访结束时,18例患儿EBV复制阳性。所有患儿于随访期间未出现EBV相关的死亡。

Tab.5 Logistic regression analysis of the factors assigned table表5 Logistic回归分析各因素赋值表
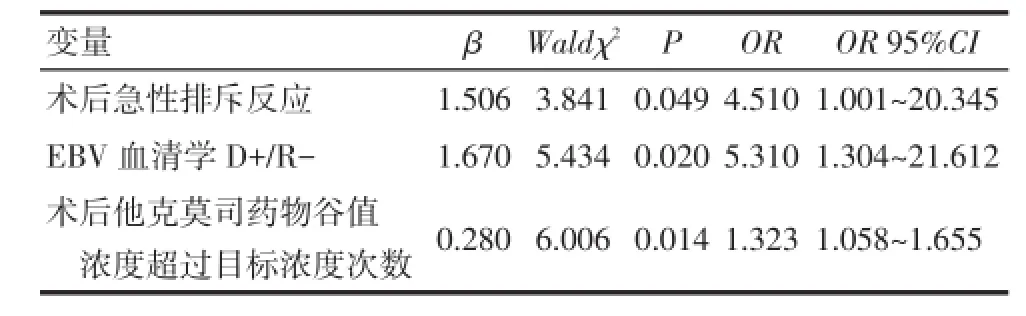
Tab.6 Multivariate analysis of risk factors for the infection of EBV表6 EBV感染的多因素Logistic回归分析结果
3 讨论
EBV感染是肝移植术后最为常见的病毒感染之一,特别是在儿童受者中,据国外相关文献报道,儿童肝移植术后EBV感染率可达27%~56%[3-4]。本研究中胆道闭锁患儿移植术后EBV的感染率为46.15%,与上述报道基本相符合,但较本移植组既往研究中的EBV感染率(17%)明显增高[5]。分析原因可能是研究对象的不同在不同程度上造成了研究结果的差异,而更为重要的是由于笔者对于术后患儿EBV的监测较前密切,从而提高了EBV感染的阳性检出率。而就移植术后EBV感染的时间来讲,大多数病例出现于移植术后早期,本研究中的EBV感染病例中的76.67%(23/30)发生于术后3个月内,与Shepherd等[6]的研究结果一致,这是由于移植术后早期大剂量免疫抑制剂的应用使机体处于较强的免疫抑制状态,从而增加了术后早期感染的风险。由于移植术后患儿EBV感染可导致PTLD的发生,从而影响移植物及受者术后的生存率[7],因此分析肝移植术后患儿EBV感染的危险因素,并予早期预防和治疗,对于保证儿童肝移植受者术后的长期生存是十分必要的。
本研究发现,肝移植术后发生急性排斥反应与EBV感染密切相关。Nafady-Hego等[3,6]在儿童肝移植受者的回顾性研究中同样表明,移植术后多次发生排斥反应是发生EBV感染的重要危险因素之一。同时也有研究表明,移植术后排斥反应增加了PTLD的发生风险[8]。这可能是因为在临床工作中,当急性排斥反应确诊后,临床医师通常采用调整基础免疫抑制药物的用量或者采用静脉用糖皮质激素冲击治疗,这从某种程度上反映了免疫抑制过量对术后感染风险的影响。依据笔者的临床经验,在急性排斥反应发生后,予调整免疫抑制剂的同时,加用抗病毒药物预防感染具有明显效果。
已有研究表明,移植术后他克莫司药物谷值浓度过高与术后EBV感染的发生密切相关[4]。在本研究中同样表明了术后多次出现他克莫司药物谷值浓度高于目标浓度增加了EBV的感染风险,这主要是因为钙调磷酸酶抑制剂(CNI)类药物同时作用于B淋巴细胞及T淋巴细胞,既可抑制体液免疫,又可抑制细胞免疫,从而使EBV特异性细胞毒性T淋巴细胞活性降低,导致EBV感染的发生[9]。因此,在对移植术后患儿的临床管理中,个体化应用免疫抑制药物的用量,密切监测药物浓度并保持于目标浓度内,对于降低术后EBV感染风险至关重要。在肾移植受者中霉酚酸酯类药物的使用可以降低术后EBV感染的风险[10]。但在本研究中,单因素分析显示儿童肝移植受者术后联合使用骁悉(霉酚酸酯类药物)抗排异可能降低EBV的感染风险,但在多因素分析中并未发现明显关联。
肝移植术后EBV的感染与供受者间的EBV血清学状态有一定关系[11-12]。诸多研究表明,对于术前EBV血清学阴性的患儿,供者EBV血清学阳性是肝移植术后发生EBV感染的重要危险因素[11-12],也是PTLD发生的重要危险因素之一[13]。这可能是因为EBV由血清学阳性供者经肝脏移植传播,从而导致EBV血清学阴性受者发生原发性EBV感染[14]。在本研究中,供受者EBV血清学为D+/R-组中EBV感染的发生率明显高于非D+/R-组,与上述研究结果一致。
综上所述,由于移植术后排斥反应的发生、他克莫司药物谷值浓度多次超过目标浓度及供受者EBV血清学D+/R-,使得肝移植术后患儿更易感染EBV。因此,对此类患儿应给予适当的抗病毒药物预防EBV感染。同时本研究的样本量小,且为回顾性调查,缺少前瞻性的干预研究,有待更进一步深入的研究。
参考文献
[1]Tannuri U,Tannuri AC.Postoperative care in pediatric liver transplantation[J].Clinics(Sao Paulo),2014,69(Suppl 1):42-46.
[2]Zhan JH.Diagnosis and treatment procedures of biliary atresia (Draft)[J].Chin J Pediatr Surg,2013,34(2):147-149.[詹江华.胆道闭锁诊疗流程(草案)[J].中华小儿外科杂志,2013,34(2):147-149].doi:10.3760/cma.j.issn.0253-3006.2013.02.018.
[3]Nafady-Hego H,Elgendy H,Uemoto S.Contrast patterns of Cytomegalovirus and Epstein-Barr virus infection in pediatric living-donor liver transplant recipients[J].Exp Clin Transplant,2015,13(Suppl 1):75-82.
[4]Lu BR,Park KT,Hurwitz M,et al.Impact of immunosuppression on the development of Epstein-Barr virus(EBV)viremia after pediatric liver transplantation[J].Transplant Proc,2013,45(1):301-304.doi:10.1016/j.transproceed.2012.04.035.
[5]Qi X,Sun LY,Zhu ZJ,et al.Epstein-Barr virus infection after pediatric liver transplantation:a single-centre experience[J].Chin J Transplant(Electronic Edition),2015,9(2):27-31.[祁雪,孙丽莹,朱志军,等.儿童肝移植术后EB病毒感染诊治单中心经验[J].中华移植杂志(电子版),2015,9(2):27-31].doi:10.3877/ cma.j.issn.1674-3903.2015.02.007.
[6]Shepherd RW,Turmelle Y,Nadler M,et al.Risk factors for rejection and infection in pediatric liver transplantation[J].Am J Transplant,2008,8(2):396-403.
[7]Park KT,Nanda P,Bensen R,et al.Effects of rural status on health outcomes in pediatric liver transplantation:a single center analysis of 388 patients[J].Pediatr Transplant,2011,15(3):300-305.doi:10.1111/j.1399-3046.2010.01452.x.
[8]Narkewicz MR,Green M,Dunn S,et al.Decreasing incidence of symptomaticEpstein-Barrvirusdiseaseandposttransplant lymphoproliferative disorder in pediatric liver transplant recipients:report of the studies of pediatric liver transplantation experience [J].Liver Transpl,2013,19(7):730-740.doi:10.1002/lt.23659.
[9]Hocker B,Fickenscher H,Delecluse HJ,et al.Epidemiology and morbidity of Epstein-Barr virus infection in pediatric renal transplant recipients:a multicenter,prospective study[J].Clin Infect Dis,2013,56(1):84-92.doi:10.1093/cid/cis823.
[10]Holmes MV,Caplin B,Atkinson C,et al.Prospective monitoring of Epstein-Barr virus DNA in adult renal transplant recipients during the early posttransplant period:role of mycophenolate mofetil[J]. Transplantation, 2009, 87(6):852-856.doi: 10.1097/ TP.0b013e318199f983.
[11]Ono Y,Ito Y,Kaneko K,et al.Simultaneous monitoring by realtime polymerase chain reaction of Epstein-Barr virus,human cytomegalovirus,and human herpesvirus-6 in juvenile and adult liver transplant recipients[J].Transplant Proc,2008,40(10):3578-3582.doi:10.1016/j.transproceed.2008.05.082.
[12]Shigeta T,Imadome K,Sakamoto S,et al.Epstein-Barr virus infection after pediatric living-related liver transplantation--management and risk factors[J].Transplant Proc,2010,42(10):4178-4180.doi:10.1016/j.transproceed.2010.09.134.
[13]Allen UD,Farkas G,Hebert D,et al.Risk factors for posttransplant lymphoproliferative disorder in pediatric patients:a casecontrol study[J].Pediatr Transplant,2005,9(4):450-455.
[14]DierickxD,CardinaelsN.Posttransplantlymphoproliferative disorders following liver transplantation:Where are we now?[J]. World J Gastroenterol,2015,21(39):11034-11043.doi:10.3748/ wjg.v21.i39.11034.
(2016-05-23收稿2016-06-15修回)
(本文编辑魏杰)
中图分类号:R657.4+4
文献标志码:A
DOI:10.11958/20160450
Risk factor analysis of EB virus infection after liver transplantation in children with biliary atresia
WANG Tiancheng1,ZHU Zhijun2△,SUN Liying2,WEI Lin2,QU Wei2,ZENG Zhigui2,LIU Ying2,HE Enhui3,ZHANG Liang4,WANG Yongcui1,WANG Yue1
1 Graduate School of Tianjin Medical University,Tianjin 300070,China;2 Department of General Surgery,Beijing Friendship Hospital Affiliated to Capital Medical University,National Clinical Research Center for Digestive Diseases,Beijing Key Laboratory of Tolerance and Organ Protection in Transplantation;3 Department of Ultrasound, 4 Department of Anesthesia,Beijing Friendship Hospital Affiliated to Capital Medical University
△Corresponding AuthorE-mail:zhu-zhijun@outlook.com
Abstract:ObjectiveTo determine the prevalence and risk factors of Epstein-Barr virus(EBV)infection after pediatric liver transplantation for patients with biliary atresia.MethodsClinical data of 65 pediatric patients with biliary atresia,who underwent liver transplantation,were retrospectively analyzed.Patients were divided into EBV infection group(n=30)and non-EBV infection group(n=35).The univariate analysis was used to analyse the preoperative,intraoperative and postoperative data of patients included.The variables with a P<0.1 were included in the multivariate Logistic regression analysis of EBV infections after pediatric liver transplantation for patients with biliary atresia.ResultsA total of 30 cases(46.15%)of pediatric recipients showed EBV infection in 65 cases,of which 23 cases(76.67%)occurred within 3 months after operation.The univariate analysis showed that there were significant differences in the ratio of patients younger than 1 year preoperation,EBV serology D+/R-,acute rejection,the usage of mycophenolate mofetil and supratheraputic tacrolimus level between two groups(P<0.05).The type of graft(P=0.060),input quantity of red blood cell intraoperation (P=0.063)and factors mentioned above were included in the multivariate Logistic regression analysis.It revealed that donor EBV serology positive but recipient negative,acute rejection and supratheraputic tacrolimus level were risk factors of EBV infection for pediatric liver transplantation recipients with biliary atresia.ConclusionDonor EBV serology positive but recipient negative,acute rejection,supratheraputic tacrolimus level are closely related to EBV infection in pediatric recipients with biliary atresia after liver transplantation.Appropriate antiviral drugs should be adopted to prevent EBV infection in high risk patients.
Key words:biliary atresia;liver transplantation;herpesvirus 4,human;risk factors;child

