不同低水解度的大米蛋白溶解性与结构变化的关系
崔沙沙,钟俊桢,方 冲,梁瑞红,刘 伟,刘成梅
(南昌大学食品科学与技术国家重点实验室,江西南昌 330047)
不同低水解度的大米蛋白溶解性与结构变化的关系
崔沙沙,钟俊桢,方冲,梁瑞红*,刘伟,刘成梅
(南昌大学食品科学与技术国家重点实验室,江西南昌 330047)
为了研究不同水解度的大米蛋白溶解性与其结构变化之间的关系,本文采用碱性蛋白酶处理大米蛋白,得到不同低水解度的大米蛋白(0%、1%、3%、5%),并表征了不同水解度蛋白的溶解性、二硫键含量、表面疏水性、微观结构和分子量。结果表明,在pH2.0~11.0范围内,各蛋白样品的溶解度均呈现先降低后升高的趋势,且在同一pH下,溶解度随水解度的增大而增大。尤其是在水解度为5%时,蛋白溶解度达到最高为65.93%。随着水解度的增大,蛋白样品的分子量、二硫键含量及表面疏水值发生了显著降低(p≤0.05)。这些变化可能是因为蛋白分子内部结构的变化,导致蛋白质的结构发生去折叠或者解聚现象,促使大米蛋白内部亲水基团暴露,从而提高蛋白质的溶解度。扫描电镜显示原料蛋白颗粒不均一,质地坚硬,而酶解后的蛋白颗粒大小相对均一,表面有较多孔洞且较蓬松。随着水解度的增大,蛋白样品的结构和性质发生更加显著的变化。这些结构变化可能导致大米蛋白溶解性提高。
大米蛋白,水解度,溶解度,结构,性质
中国在世界上100多个水稻生产国中有“稻米王国”的称号[1],大米蛋白氨基酸成分齐全、配比合理,与FAO/WHO所推荐的营养配比模式较相近[2]。尽管大米蛋白的需求量增加,但由于其溶解性差而导致胶凝性和乳化性等功能性质不佳,限制了其在食品领域的应用[1-2]。目前常用的蛋白质改性方法主要包括物理法、化学法和酶法,且主要以溶解度、乳化性和起泡性等功能性质的提升为目标[3]。例如,涂宗财[4]通过对大豆分离蛋白进行研究,发现随着超高压均质处理的压力提高,其溶解性、乳化性及乳化稳定性都得到了提高。鲁倩[5]等研究糖基化修饰对大米蛋白功能性质的影响,发现通过糖基化改性,蛋白溶解性、乳化性、起泡性均有提高。黄正虹等[6]通过五种蛋白酶处理大米蛋白,制备出溶解性高、乳化性高的大米蛋白水解物。赵强等[7]通过几种蛋白酶处理大米蛋白,研究酶的种类对大米蛋白功能性质和抗氧化活性的影响,结果显示:酶解蛋白相对于原料蛋白溶解性有大幅提升,抗氧化活性也有了提高。物理改性成本低,对蛋白营养价值影响小,但效果不显著[8]。化学改性有时会破坏蛋白质的原有营养特性,产生一些副反应,同时还须考虑所用试剂的毒性及残留[3,8]。而酶法改性专一性高、反应条件温和,溶解性高,对环境的污染小、适合工业化生产、水解产物营养价值高。目前关于酶法改性大米蛋白研究主要集中在改性前后大米蛋白的功能性质(溶解性、乳化性、起泡性、抗氧化性等)的变化上,而关于改性后大米蛋白的溶解性与蛋白结构及聚集态两者间关系的研究相对较少。
为此,本实验采用碱性蛋白酶处理大米蛋白,得到不同低水解度的水解蛋白,通过研究水解蛋白的溶解性,同时测定蛋白的二硫键含量、表面疏水性、分子量及表面微观形态变化,分析蛋白溶解度变化及其与蛋白结构和聚集态的关系,为大米蛋白改性方面提供理论依据,从而扩大大米蛋白在食品行业的应用。
1 材料与方法
1.1材料与仪器
大米蛋白江西金农生物科技有限公司,碱性蛋白酶(400 U/mg)南宁庞博生物工程有限公司,氢氧化钠、无水碳酸钠西陇化工股份有限公司 分析纯,磷酸二氢钠、盐酸天津永大化学试剂有限公司 分析纯,磷酸氢二钠天津市大茂化学试剂厂 分析纯等。
UV-1600PC紫外可见分光光度计上海美谱达仪器有限公司,F-4500荧光光谱仪日本日立公司,Mini Protean Tetra MP4电泳仪美国Bio-Rad伯乐公司,Quanta 200F场发射环境扫描电镜德国FEI公司等。
1.2实验方法
1.2.1水解度随时间的变化曲线参考文献[9],采用pH-state法计算水解度,得到水解度随时间的变化关系曲线。水解度公式如下:DH(%)=B(Mb)(1/a)(1/MP)(1/htot)×100
其中:B-NaOH的体积,mL;Mb-NaOH的浓度,mol/L;1/a-在pH9.0,55℃的实验条件下,对于大米蛋白,1/a为1.01;MP-蛋白的质量,g;htot-每克原料蛋白质中肽键的毫摩尔数,对于大米蛋白,取7.40 mmol/g。
1.2.2水解蛋白样品的制备原料蛋白为购于江西金农生物科技公司的大米蛋白,其他低水解度蛋白样品的制备根据1.2.1的变化曲线,将大米蛋白粉分散于蒸馏水中配成料液比为1∶10的溶液,用1.0 mol/L NaOH溶液调节蛋白样液pH至9.0,在水浴锅中水浴搅拌15 min,水浴锅温度为55℃,然后向该大米蛋白分散液中加入相同酶活性的碱性蛋白酶(水解度0%蛋白样品为未加蛋白酶处理样品),在连续搅拌的情况下使其反应,反应完毕后于95℃水浴条件下灭酶10 min。通过控制酶解反应的时间来得到不同低水解度的大米蛋白样品。
1.2.3大米蛋白组分测定采用国标的方法,分别测定各个蛋白样品基本组分。其中蛋白纯度参照GB 5009.5-2010中凯氏定氮法进行测定,水分含量参照GB 5009.3-2010中直接干燥法进行测定,淀粉含量参照GB/T 5009.9-2003中酸水解法进行测定,灰分、脂肪、纤维的测定分别参照GB 5009.4-2010、GB/T 14772-2008和GB/T 5009.10-2003方法。
1.2.4溶解度的测定将不同低水解度的大米蛋白和原料蛋白溶于不同pH的缓冲液中室温下用六联磁力搅拌器搅拌12 h,在4800 r/min离心15 min,取上清液。上清液中蛋白质的含量以牛血清白蛋白做标准用福林酚法[10]进行测定。

1.2.5表面微观形态测定参考文献[11]分别取原料蛋白和不同低水解度的蛋白样品粉末,放在环境扫描电镜下进行观察,比较不同蛋白样品的表面微观形态的差异。
1.2.6二硫键含量的测定二硫键含量的测定采用Ellman方法[12]。精确称取30 mg蛋白样品溶于10 mL溶解液中(包含10 mol/L尿素的Tris-glycine 缓冲液),取0.5 mL该溶液并加入0.03 mL巯基乙醇,室温放置1 h后加入5 mL 12% TCA溶液,室温暗处放置1 h后,离心(4800 r/min,15 min),用12% TCA溶液清洗残渣两次后,加入3 mL Tris-Gly-8 mol/L Urea溶液和0.04 mL DTNB溶液,再在暗室室温放置30 min,离心(4800 r/min,15 min),取上清液在412 nm处测定吸光度。对于巯基含量的测定,将30 mg样品溶解在10 mL Tris-Gly-8 mol/L Urea,然后加入0.1 mL的DTNB,将混合液置于暗处室温下反应1 h,离心(4800 r/min,15 min),上清液在412 nm处测定吸光度。
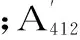
二硫键含量计算公式为:
式中:D为稀释倍数6.08;C为蛋白浓度(mg/mL);A412为吸光值。
1.2.7表面疏水性测定根据文献[13],分别取4mL样品溶液,加入20μL的1-苯胺基-8-萘(1-anilino-8-naphthalene sulfonic acid,ANS)溶液(8 mmol/L ANS溶于0.01 mol/L磷酸盐缓冲液),避光静置10 min,摇匀,在F-4500荧光分光光度计中于390 nm波长激发,检测发射荧光光谱,以最大发射波长处的荧光强度对蛋白质浓度作图,进行线性回归,初始段的斜率即为蛋白质分子的表面疏水性指数H0。
1.2.8分子量的测定参考文献[14]采用的Laemmli电泳系统。将蛋白样液与含有β-巯基乙醇的还原性上样缓冲液按比例为3∶1进行混合,离心30 s,然后95℃加热10 min,再离心30 s。电泳结束后,用含R-250考马斯亮蓝染色液染色,然后用脱色液进行脱色到电泳条带清晰。
1.2.9统计分析所有实验重复三次,应用SPSS 19.0和Origin 8.0对实验数据进行统计分析和作图,数据用平均值±标准偏差表示,差异显著性分析限定为p≤0.05。
2 结果与讨论
2.1水解曲线
图1为在pH9.0、料液比1∶10、温度为55℃、加酶量为2.5 U/mg的情况下,改变反应时间而得到的水解度曲线。在水解前40 min,酶促反应速率大,水解度增加较快,随着酶解时间的增加,反应速率降低,水解度的增长趋势趋于平缓,这种典型的水解曲线在酶解黄色条纹鯵鱼蛋白[15],胃蛋白酶酶解鼬肌肉蛋白[16],酶解格陵兰海豹肌肉蛋白[17],鲱蛋白水解物[18],不同碱性蛋白酶酶解鲑鱼肌肉蛋白[19],不同蛋白酶酶解小沙丁鱼[20]这些文献中均有报道。
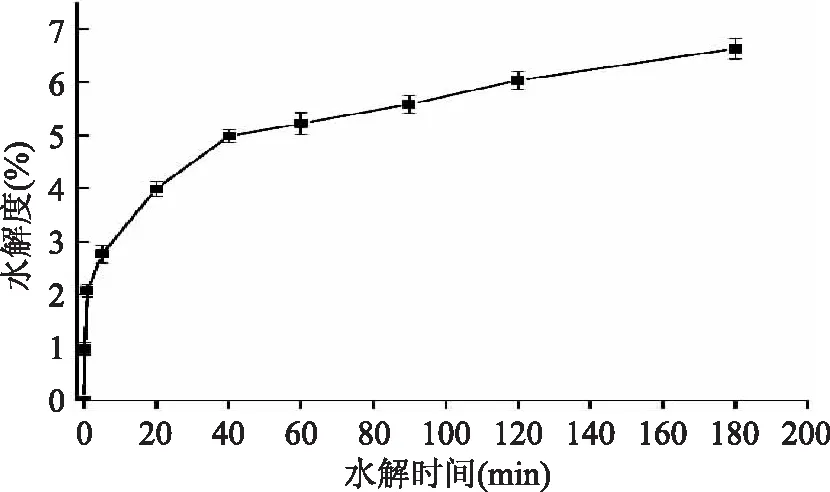
图1 大米蛋白水解度随时间的变化趋势图Fig.1 The change tendency of rice protein hydrolysis with time
2.2基本组成对比
分别测定原料大米蛋白和不同低水解度蛋白样品的蛋白纯度、脂肪、淀粉、灰分、水分、粗纤维指标,测得结果如表1。
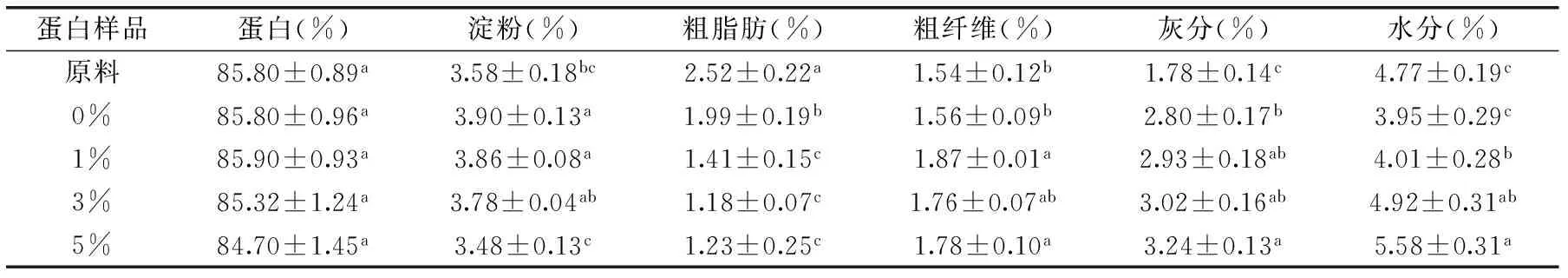
表1 蛋白组分
注:所有数值均表示为:平均值±标准偏差SD,不同的字母表示在p≤0.05水平上有显著性差异,图4、图6同。
表1为原料大米蛋白和不同低水解度蛋白样品的基本组分,从表中可以看出水解前后蛋白含量基本不变(p>0.05),蛋白样品的灰分含量却随着水解度的增大而增加,这可能是因为在样品制备过程中加入了NaOH及HCl溶液从而增加了盐含量。水解前后,粗脂肪含量降低,可能是由于碱溶液中的氢氧化钠在加热条件下和原料中的脂质发生反应,生成可溶于水的脂肪酸盐,从而降低了脂肪含量[21]。水解前后,样品中的淀粉含量发生变化,可能是因为碱和酶的共同作用[22]。粗纤维和水分也发生了无规律的变化。
2.3溶解度
从图2可以看出,随着pH的增加,各个蛋白样品的溶解度都呈现先降低后增加的趋势,在pH5.0,即谷蛋白等电点pH4.6[23]附近时,原料中蛋白溶解度最低,为1.28%左右。大米蛋白的溶解度很低,这可能与大米蛋白本身的大分子结构有关,大米蛋白分子包含很多分子间和分子内二硫键,并且疏水相互作用也比较强[24]。随着水解度的增加,在pH2.0~11.0之间,大米蛋白的溶解度有了大幅提高,尤其是水解度为5%时,蛋白溶解度最高达到65.93%。Zheng等[12]研究了复合蛋白酶水解玉米谷蛋白,发现在pH7.0时,谷蛋白的溶解度极低(1.99%),然而在酶解到150 min,即水解度达到6.31%时,溶解度上升到94.65%。Kong等[9]用几种蛋白酶水解小麦谷蛋白,发现经过不同的蛋白酶酶解(水解度最高为15.8%)后,在pH2.0~12.0之间小麦谷蛋白的溶解度均提高至60%以上。酶解将蛋白质水解成短肽,可能使得肽链展开,更多的亲水基团暴露[7]。
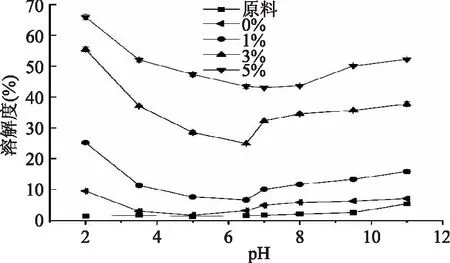
图2 不同低水解度大米蛋白在不同pH下溶解度变化Fig.2 Solubility changes of rice protein with different hydrolysis degrees under different pH
2.4微观结构
图3A~图3E分别是各个蛋白样品在环境扫描电镜下观察的结果。由上图可以看出,原料大米蛋白颗粒大小不均一,质地坚硬,表面呈现大小不规则的块状或颗粒堆积且较紧实。而酶解后的蛋白颗粒大小相对均一,表面多孔洞且较蓬松。蛋白的聚集形式和表面微观形态,可能对蛋白的溶解度等性质具有一定的影响。酶解后的蛋白表面蓬松并有较多孔洞,且随着水解度的增大,蛋白表面越蓬松,孔洞越多,相对于原料蛋白表面紧实,颗粒不均一及比较坚硬的质地结构,更有利于蛋白在溶液中的溶解和分散,从而提高了蛋白的溶解度。
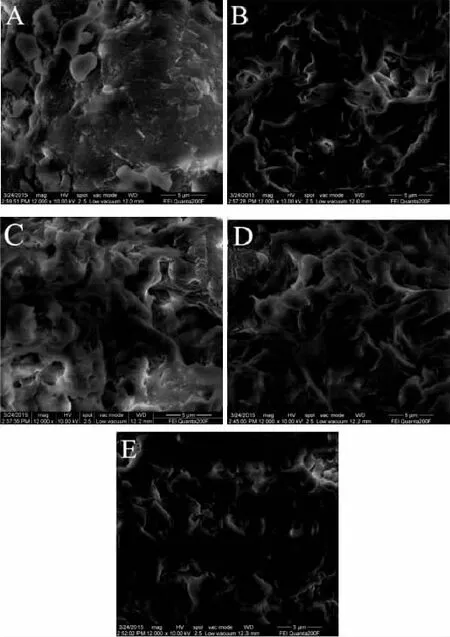
图3 不同低水解度蛋白的微观结构Fig.3 Microstructure of different hydrolysis degrees proteins注:A:原料B:0% C:1% D:3% E:5%,图8同。
2.5二硫键含量
二硫键在蛋白相对刚性结构的形成中有重要作用,且对蛋白的功能性质有显著影响[25]。从图中可以看出,水解后,蛋白样品的二硫键含量与原料大米蛋白相比显著降低(p≤0.05),且随着水解度的增大,二硫键含量逐渐下降(p≤0.05)。谷蛋白富含二硫键,促进蛋白质的聚集[12]。0%水解蛋白和原料蛋白相比,二硫键含量有所降低,说明加热会导致二硫键含量降低,而随着酶解程度的加大,二硫键含量持续降低,结果表明,加热和酶解会使蛋白质的结构发生去折叠或者解聚现象,可能促使大米蛋白内部亲水基团暴露,从而提高蛋白质的溶解度。随着水解度的增加,蛋白样品中二硫键含量显著降低,而溶解度却反之。如图5所示,在本实验中,蛋白样品二硫键含量与溶解度有负相关的关系(p≤0.05)。
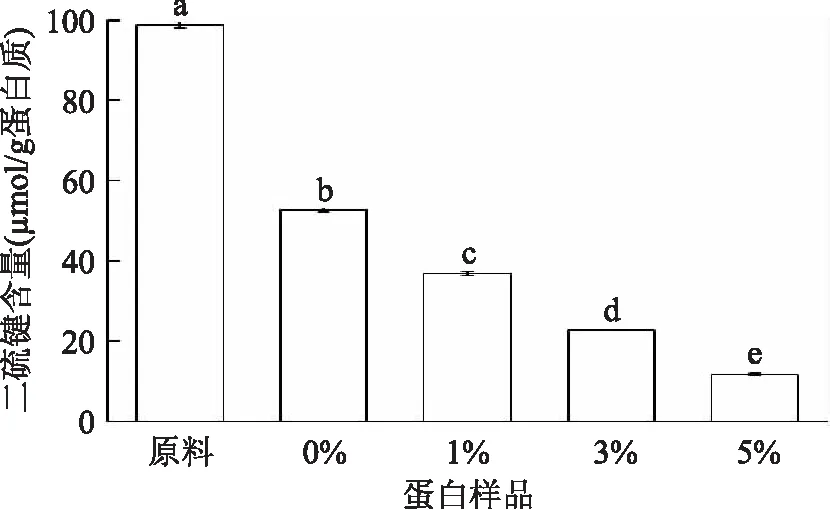
图4 不同低水解度大米蛋白中二硫键含量Fig.4 Disulphide bond(SS)contents in rice protein with different degrees of hydrolysis
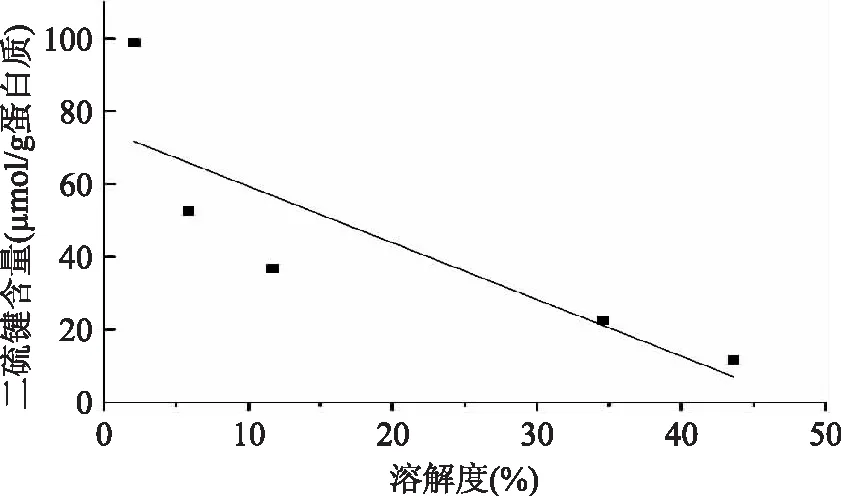
图5 二硫键含量与溶解度的相关性Fig.5 Correlation relationship between disulphide bond(SS)contents and solubility注:pH8。
2.6表面疏水性
如图6所示,随着水解度的增加,蛋白质的表面疏水性逐次降低。经过水解,蛋白样品的表面疏水性与原料大米蛋白相比显著降低(p≤0.05),且随着水解度的增大,表面疏水性逐渐下降(p≤0.05)。Avramenko等[26]在限制性酶解对小扁豆蛋白理化性质及乳化性的影响研究中发现蛋白质的表面疏水值随着水解度的增加而降低,这和本实验的研究现象是一致的。一般来说,表面疏水值表示在水环境中蛋白质表面疏水基团的数量。蛋白被水解成小的肽链后,折叠在原来完整的蛋白质分子中以及由小肽形成的肽链中的疏水基团的暴露可能会引起表面疏水性的增大或者减小,进而会影响蛋白质的功能性质[27]。一部分研究报道显示蛋白质的表面疏水性随着酶解程度的增大而降低。例如,碱性蛋白酶和酯酶处理挤压与非挤压大豆浓缩蛋白[28]、限制性酶解对小扁豆蛋白理化性质及乳化性的影响[26]。Jung等[29]认为蛋白表面疏水性的降低可能与蛋白质疏水基团的暴露有关,疏水相互作用使蛋白聚集,从而在分子内部重新形成分子聚集结构。Surowka等[28]认为蛋白构象的展开和多肽的释放可能会引起疏水基团重新折叠形成新的结构。本实验酶解蛋白表面疏水值的降低可能是由于蛋白分子内部结构的变化,导致蛋白质的结构发生去折叠或者解聚现象,促使大米蛋白内部亲水基团暴露,从而提高蛋白质的溶解度。随着水解度的增加,蛋白样品表面疏水性显著降低,而溶解度却反之。如图7所示,在本实验中,蛋白样品表面疏水性与溶解度有负相关的关系(p≤0.05)。
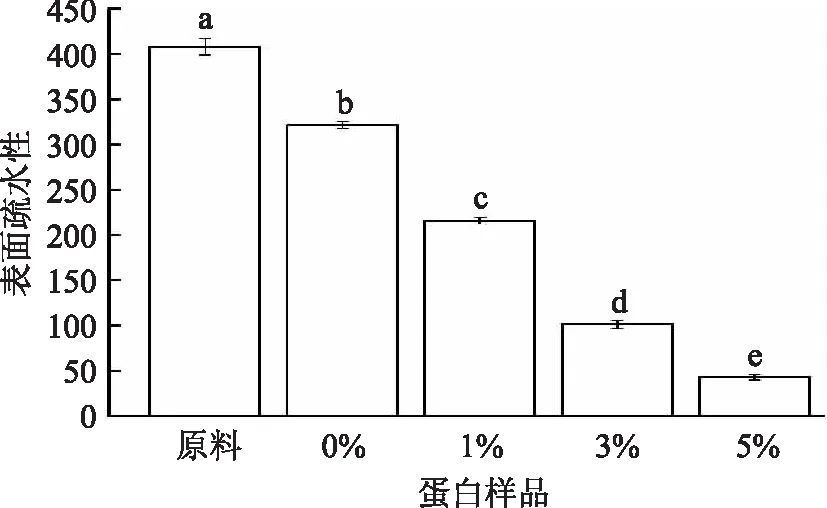
图6 不同低水解度大米蛋白表面疏水性的变化Fig.6 Changes of surface hydrophobicity of rice protein with different degrees of hydrolysis
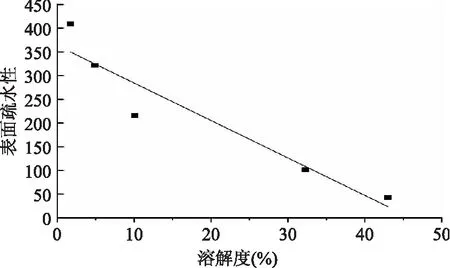
图7 表面疏水性与溶解度的相关性Fig.7 Correlation relationship between surface hydrophobicity and solubility注:pH7。
2.7电泳
蛋白水解物分子量的分布是其最重要的性质之一,将影响到它作为功能性食品材料的应用[30]。图8显示了原料大米蛋白以及不同水解度蛋白的分子量分布。0水解蛋白与原料蛋白相比无明显变化,随着水解时间增加,18.4~35 ku范围内的亚基条带变浅,而14.4 ku以下的亚基条带变深,说明蛋白由大分子变成了小分子肽,这种结果与风味蛋白酶水解玉米谷蛋白中蛋白分子量变化是一致的[30]。目前关于肽的研究表明大分子蛋白水解成小分子肽会提高蛋白的功能性质(溶解性、还原性、热稳定性等)[31]。赵强[31]等人对酶解米渣蛋白的分子量进行了测定,发现所有的酶解物几乎都由低分子量(<10 ku)肽链所组成,而米渣蛋白分子量大部分是大于10 ku,同时,其溶解性得到大幅提高。由此可以看出,酶解将大米蛋白由大分子变成了小分子肽,从而提高了蛋白溶解性。
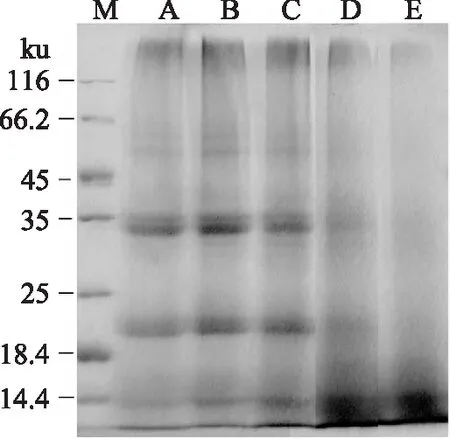
图8 不同低水解度大米蛋白的电泳图谱Fig.8 The SDS-PAGE profiles of the rice protein with different degrees of hydrolysis
3 结论
采用pH-stat法通过控制碱性蛋白酶水解大米蛋白的时间可实现大米蛋白的有限水解。同原料蛋白相比,未加酶组蛋白溶解度提高,经过有限酶解的大米蛋白在pH2.0~11.0范围内,蛋白溶解度有了显著提高。水解度为5%时,蛋白溶解度最高可达到65.93%。结果显示,未加酶组二硫键含量和表面疏水性降低,而酶解使蛋白分子量降低且减少了二硫键含量,随着酶解程度的加大,蛋白表面疏水性显著降低,酶解后蛋白表面结构较疏松。这些变化表明,随着加热和酶解度的增高,大米蛋白可能发生解聚现象,由大分子变成小分子,这可能与其溶解性增大存在一定的关系。
[1]吴英华,任凤莲.大米蛋白提取工艺的研究及产品开发[J].粮油加工,2010(11):71-75.
[2]邓霄,钟鸣,王菊,等.大米蛋白及其提取、改性的研究进展[J].粮食与饲料工业,2007(9):13-16.
[3]文敏,曾庆孝.蛋白质改性研究进展[J].食品科学,2000,21(6):6-10.
[4]涂宗财,汪菁琴,阮榕生,等.超高压均质对大豆分离蛋白功能特性的影响[J].食品工业科技,2006,27(1):66-67.
[5]鲁倩,林亲录,梁盈.糖基化修饰对大米蛋白功能性质影响[J].粮食与油脂,2013(4):11-14.
[6]黄正虹,钟芳,李玥,等.酶法改性大米蛋白的研究[J].食品与机械,2009,25(1):28-31.
[7]Zhao Q,Xiong H,Selomulya C,et al.Enzymatic hydrolysis of rice dreg protein:Effects of enzyme type on the functional properties and antioxidant activities of recovered proteins[J].Food Chemistry,2012,134(3):1360-1367.
[8]银波,李亦蔚,汪霞丽,等.大米蛋白改性技术的研究进展[J].食品与机械,2011(3):147-151.
[9]Kong X Z,Zhou H M,Qian H F.Enzymatic hydrolysis of wheat gluten by proteases and properties of the resulting hydrolysates[J].Food Chemistry,2007,102(3):759-763.
[10]黄百芬,张双凤,铁晓威.福林-酚试剂法测定冰茶栓中微量蛋白质含量[J].浙江预防医学,2004,16(4):77-78.
[11]Chen J,Liang R H,Liu W,et al.Degradation of high-methoxyl pectin by dynamic high pressure microfluidization and its mechanism[J].Food Hydrocolloids,2012,28(1):121-129.
[12]Zheng X Q,Wang J T,Liu X L,et al.Effect of hydrolysis time on the physicochemical and functional properties of corn glutelin by Protamex hydrolysis[J].Food Chemistry,2015,172(1):407-415.
[13]Liu Y L,Li X H,Chen Z J,et al.Characterization of structural and functional properties of fish protein hydrolysates from surimi processing by-products[J].Food Chemistry,2014,151(1):459-465.
[14]Anderson A,Hettiarachchy N,Ju Z Y.Physicochemical properties of pronase-treated rice glutelin[J].Journal of the American Oil Chemists’ Society,2001,78(1):1-6.
[15]Klompong V,Benjakul S,Kantachote D,et al.Antioxidative activity and functional properties of protein hydrolysate of yellow stripe trevally(Selaroides leptolepis)as influenced by the degree of hydrolysis and enzyme type[J].Food Chemistry,2007,102(4):1317-1327.
[16]Bougatef A,Hajji M,Balti R,et al.Antioxidant and free radical-scavenging activities of smooth hound(Mustelus mustelus)muscle protein hydrolysates obtained by gastrointestinal proteases[J].Food Chemistry,2009,114(4):1198-1205.
[17]Shahidi F,Synowiecki J,Balejko J.Proteolytic hydrolysis of muscle proteins of harp seal(Phoca groenlandica)[J].Journal of Agricultural and Food Chemistry,1994,42(11):2634-2638.
[18]Liceaga-Gesualdo A M,Li-Chan E C Y.Functional properties of fish protein hydrolysate from herring(Clupea harengus)[J].Journal of Food Science,1999,64(6):1000-1004.
[19]Kristinsson H G,Rasco B A.Biochemical and functional properties of Atlantic salmon(Salmo salar)muscle proteins hydrolyzed with various alkaline proteases[J].Journal of Agricultural and Food Chemistry,2000,48(3):657-666.
[20]Bougatef A,Nedjar-Arroume N,Ravallec-Plé R,et al.Angiotensin I-converting enzyme(ACE)inhibitory activities of sardinelle(Sardinella aurita)by-products protein hydrolysates obtained by treatment with microbial and visceral fish serine proteases[J].Food Chemistry,2008,111(2):350-356.
[21]郭荣荣,潘思轶,王可兴.碱法与酶法提取大米蛋白工艺及功能特性比较研究[J].食品科学,2005,26(3):173-177.
[22]盛志佳,林亲禄,肖华西.大米淀粉的提取及纯化方法研究[J].湖南农业科学:上半月,2011(7):80-84.
[23]王艳玲.米糠中四种蛋白的提取工艺及特性研究[D].哈尔滨:东北农业大学,2013.
[24]Paraman I,Hettiarachchy N S,Schaefer C,et al.Physicochemical properties of rice endosperm proteins extracted by chemical and enzymatic methods[J].Cereal Chemistry,2006,83(6):663-667.
[25]Shimada K,Cheftel J C.Determination of sulfhydryl groups and disulfide bonds in heat-induced gels of soy protein isolate[J].Journal of Agricultural and Food Chemistry,1988,36(1):147-153.
[26]Avramenko N A,Low N H,Nickerson M T.The effects of limited enzymatic hydrolysis on the physicochemical and emulsifying properties of a lentil protein isolate[J].Food Research International,2013,51(1):162-169.
[27]Barca A M,Ruiz-Salazar R A,Jara-Marini M E.Enzymatic hydrolysis and synthesis of soy protein to improve its amino acid composition and functional properties[J].Journal of Food Science,2000,65(2):246-253.
[28]Surowka K,Zmudzinski D,Surowka J.Enzymic modification of extruded soy protein concentrates as a method of obtaining new functional food components[J].Trends in Food Science & Technology,2004,15(3):153-160.
[29]Jung S,Murphy P A,Johnson L A.Physicochemical and functional properties of soy protein substrates modified by low levels of protease hydrolysis[J].Journal of Food Science,2005,70(2):C180-C187.
[30]Zheng X Q,Li L T,Liu X L,et al.Production of hydrolysate with antioxidative activity by enzymatic hydrolysis of extruded corn gluten[J].Applied Microbiology and Biotechnology,2006,73(4):763-770.
[31]赵强.热变性米渣蛋白功能改性与结构关系研究[D].南昌:南昌大学,2012.
Relationship between solubility and structural properties of different low degree of hydrolysis of rice protein
CUI Sha-sha,ZHONG Jun-zhen,FANG Chong,LIANG Rui-hong*,LIU Wei,LIU Cheng-mei
(State Key Laboratory of Food Science and Technology,Nanchang University,Nanchang 330047,China)
In order to study the relationship of different degree of hydrolysis of rice protein solubility and the structure change,rice protein was enzymatically modified with alkaline protease to get desired degree of hydrolysis(DH)(0%,1%,3%,5%).And the solubility and disulfide bond content,surface hydrophobicity,surface microscopic structure and molecular weight of different degree of hydrolysis protein were characterized.In the range of pH2.0~11.0,the solubility of protein samples was decreased firstly,and then increased.At the same pH,solubility was increased with the increase of hydrolysis degree.When the degree of hydrolysis was 5%,maximum protein solubility was 65.93%.It showed that with the increase of the degree of hydrolysis,rice protein’s molecular weight,disulphide bond content and surface hydrophobicity were decreased significantly(p≤0.05).These changes may be because of the change of protein molecule structure,which led to the structure of the protein unfold or depolymerization,prompting rice protein internal hydrophilic group exposure,so as to improve the solubility of protein.From the scanning microscopy analysis:the grain size of rice protein was uneven and the material quality was hard.The size of rice protein hydrolysates was relatively uniform and the surface had more holes and they were fluffier.With the increase of the degree of hydrolysis,the structure and properties of protein samples were significantly changed.The conformational changes may lead to rice protein solubility increase.
rice protein;degree of hydrolysis;solubility;structure;properties
2015-09-07
崔沙沙(1990-),女,硕士,研究方向:食物(含生物质)资源开发与利用,E-mail:767769711@qq.com。
梁瑞红(1966-),女,博士,研究员,研究方向:天然产物研究与开发,E-mail:liangruihong@ncu.edu.cn。
食品科学与技术国家重点实验室目标导向资助项目(SKLF-ZZA-201304)。
TS201.1
A
1002-0306(2016)07-0086-06
10.13386/j.issn1002-0306.2016.07.009

