微小核糖核酸-24对内皮型一氧化氮合酶基因表达的调节及其对血管内皮细胞管腔形成的影响
陈伟,莫国君,罗雪兰,王辉,杨鹏,欧和生
基础与实验研究
微小核糖核酸-24对内皮型一氧化氮合酶基因表达的调节及其对血管内皮细胞管腔形成的影响
陈伟,莫国君,罗雪兰,王辉,杨鹏,欧和生
目的:探讨微小核糖核酸(microRNA)-24(miR-24)对内皮型一氧化氮合酶(eNOS)基因表达调节的分子机制及其对血管内皮细胞增殖、迁移和管腔形成能力的影响。
方法:构建miR-24及其反义序列的高表达质粒,分别转染人脐静脉内皮细胞(HUVECs),根据转染质粒将实验细胞分为:miR-24高表达组、miR-24 干扰组和空白质粒对照组。用四甲基偶氮唑盐(MTT)检测HUVECs增殖能力,划痕和Transwell试验检测细胞的迁移能力,人工基底膜检测细胞的管腔形成能力;分别用逆转录-聚合酶链反应(RT-PCR)、蛋白免疫印迹法(Western blotting)检测eNOS和Sp1转录因子mRNA和蛋白表达水平。
结果:(1)与空白质粒对照组比较,miR-24高表达组细胞增殖能力降低45.45%(0.36 ± 0.04 vs 0.66 ± 0.08,P<0.05);miR-24高表达组细胞迁移速度明显减缓,且迁移数目降低74.75%(30.25±3.78 vs 119.80±10.94,P<0.01),未能形成明显管腔样结构。(2)与空白质粒对照组比,miR-24高表达组eNOS mRNA降低46.2%(0.49±0.02 vs 0.91±0.01,P<0.05),蛋白表达减少49.07%(0.55±0.05 vs 1.08±0.05,P<0.05);同时Sp1 mRNA降低44.9%(0.49±0. 01 vs 0. 89±0.02,P<0.05),其蛋白质表达量也相应减少54.90%(0.46±0.02 vs 1.02±0.04,P<0.05)。在miR-24抑制组中,上述指标较空白质粒对照组降低,但比miR-24高表达组显著升高,特别是小管形成数量、及管腔长度与空白质粒对照组相近。
结论: miR-24显著抑制HUVECs的增殖、迁移和管腔形成的能力,并且与miR-24对eNOS的表达调控有关;miR-24明显抑制eNOS表达,Sp1的参与可能是这一调节过程的重要分子机制之一。
核糖核酸;管腔;一氧化氮合酶,内皮型
Abstract
Objective: To investigate the effects of miR-24 on endothelial nitric oxide synthase (eNOS) gene expression with regulation and endothelial cell proliferation,migration,tube formation in human umbilical vein endothelial cells (HUVECs).
Methods:Constructed high expression plasmid of miR-24 and miR-24 antisense sequence were introduced into HUVECs and the cells included in 3 groups: Control group,miR-24 group and miR-24 inhibitor group. HUVEC proliferation was detected by MTT test,migration was measured by Scratching and Transwell methods,tube formation was examined by Matrigel assay; mRNA and protein expressions of eNOS and Sp1were determined by RT-PCR and Western blot analysis respectively.
Results:①Compared with Control group,miR-24 group had decreased cell proliferation by 45.45% as (0.36 ± 0.04) vs (0.66 ± 0.08),P<0.05; miR-24 group had lower speed of cell migration,decreased number of cell migration by 74.75% as (30.25±3.78) vs (119.80±10.94),P<0.01 and there was no obvious tube formation.②Compared with Control group,miR-24 group showed reduced eNOS mRNA expression by 46.2% as (0.49±0.02) vs (0.91±0.01),P<0.05,reduced protein expression by 49.07% as (0.55±0.05) vs (1.08±0.05),P<0.05; meanwhile,decreased Sp1 mRNA expression by44.9% as (0.49±0. 01) vs (0. 89±0.02) P<0.05,decreased protein expression by 54.90% as (0.46±0.02) vs (1.02±0.04),P<0.05. In miR-24 inhibitor group,the above indexes were lower than Control group but higher than miR-24 group,the amount of tube formation and the length of tubes were similar between Control group and miR-24 inhibitor group.
Conclusion:MiR-24 may inhibit HUVECs proliferation,migration,tube formation and suppress eNOS expression; Sp1 might be one of the important regulators.
(Chinese Circulation Journal,2016,31:797.)
近年来研究显示,一些微小核糖核酸(MicroRNA)可通过调控血管内皮细胞的增殖、迁移和形态变化进而调控血管生成。然而,这些miRNAs的表达异常参与了心血管疾病的发生、发展[1,2]。
内皮型一氧化氮合酶(eNOS)是内皮组织特异型基因,介导大部分的血管内源性一氧化氮(NO)合成,后者不仅是调节血管紧张度的舒张因子,而且在内皮细胞生长、迁移、血管重构和血管生成等方面起着至关重要的作用[3]。Sp1是锌指蛋白家族中最具代表性的一员,通过三个保守的锌指结构与DNA结合,在许多基因的表达过程中发挥重要调控作用。令人感兴趣的是,eNOS核心启动子区域的GC盒含有Sp1的高亲和位点,且Sp1是eNOS的必需转录因子。我们前期研究提示microRNA-24 (miR-24)对内皮细胞增殖的调控与其抑制eNOS和Sp1的表达有关[4]。然而,miR-24抑制eNOS的表达是否参与血管生成的调控,目前尚不清楚。
为进一步探讨miR-24对eNOS和Sp1表达调节的分子机制,以及该过程对内皮细胞增殖、迁移和管腔形成能力的影响,本实验选取人脐静脉内皮细胞(HUVECs)为实验模型,构建的miRNA-24及其反义序列的高表达质粒,然后分别转染HUVECs,观测HUVECs的增殖、迁移和血管形成情况,并检测 eNOS和核转录因子Sp1的表达变化情况。
1 材料与方法
试验材料:HUVECs(Procell,中国武汉);1640细胞培养基(Gibco,上海立菲生物技术有限公司);胎牛血清(Gibco,澳洲);四甲基偶氮唑盐(MTT)(索莱宝科技有限公司,中国北京);人工基底膜(Matrigel)(Corning,美国);载体 miRNA SelectTMpEGP-miR(Cell Biolabs,美国);质粒提取试剂盒(天根生化科技有限公司,中国北京);X-tremeGENE HP DNA 转染试剂盒(Roche,德国);总RNA提取试剂盒(TRIzol法)(北京百泰克生物技术有限公司,中国北京);RT试剂盒(MBI公司,美国);PCR试剂盒(天根生化科技有限公司,中国北京);eNOS、Sp1兔源多克隆抗体(Abcam,英国);辣根过氧化物酶标记的羊抗兔二抗(Santa Cruz,美国)。
miR-24高表达质粒的构建及鉴定:miRNA-24序列(来 自 http://www.miRbase.org)为 5`UGGCUCAGUUCAGCAGGAACAG-3`;anti-miRNA-24用于下调 miR-24并干扰其作用,序列与miR-24互补,5`-ACCGAGUCAAGUCGUCCUUGUC-3`。对照组为随机序列,5`-GUCAUCAGUCGAGCUAGACGAG-3`。使用脱氧核糖核酸(DNA)合成技术得到第一链DNA,通过DNA连接反应合成相应的双链DNA,随后经过聚合酶链反应(PCR)扩增并进行体外重组,最终插入pEGP-miR载体,载体分别命名为pEGP-miRNA-24、pEGP-anti-miRNA-24和 pEGP-control。分别将载体转化入 E.coliDH5α感受态宿主菌并于氨苄抗性的平板上培养,挑取经酶切初步证实插入正确的单克隆菌落,摇菌后提取质粒DNA并寄上海生工进行DNA序列测定。
HUVECs的培养和转染:HUVECs用含有1×105U/L青霉素、100 mg/L链霉素、10%胎牛血清的1640培养液培养,置于37℃、5% CO2、饱和湿度培养箱中。提取的质粒分别使用NANO核酸测定仪测定浓度,重复3次,取平均值。然后使用无血清1640培养液将质粒稀释至浓度为0.01 μg/ μl,并将X-tremeGENE HP DNA转染试剂与质粒按3 μl:1 μg比例混合,取生长正常的HUVECs孵育,24 h后更换含10%胎牛血清1640培养液,培养24 h观察免疫荧光。根据转染质粒将实验细胞分为:miR-24高表达组、miR-24 干扰组和空白质粒对照组。
MTT检测HUVECs的增殖能力:按文献[5]的方法通过MTT检测HUVECs的增殖能力。各组细胞分别以每孔5×103个接种到96孔板,待细胞达到50%融合时更换无血清培养基培养24 h实现细胞同步生长。接种后24、48和72 h,每孔加10μl MTT继续孵育4 h,弃去培养液,每孔加入100μl二甲基亚砜,震荡15 s,使用酶联免疫检测仪在570 nm的波长下测定吸光度(OD值),实验重复3次。
划痕和Transwell检测HUVECs的迁移能力:按文献[6]的方法通过划痕检测HUVECs的迁移能力。各组细胞分别以4×105个接种到6孔板,待细胞融合后用,用移液枪枪头垂直培养板底部划“一”字痕。接着,用磷酸缓冲盐溶液(PBS)(磷酸根浓度=0.01 mol/L,pH=7.4)冲洗3遍,将悬浮细胞洗脱,加入无血清1640培养基继续培养。分别于0 h和24 h观察细胞迁移情况并测量划痕宽度,迁移比例=(划痕0 h后划痕宽度-划痕24 h后划痕宽度)/划痕0 h后划痕宽度,实验重复3次。
按文献[3]的方法通过transwell检测HUVECs的迁移能力。各组细胞预先用无血清1640培养基饥饿12 h,各组细胞消化后用无血清1640重悬并以1×104个接种到Transwell上层小室,下层小室均加入500 μl的含血清培养基,37℃、5%CO2孵育箱中培养。12 h后取出上层小室,用棉签小心拭去小室内的细胞,4%多聚甲醛固定15 min,取出上层小室用PBS冲洗3次,结晶紫室温染色1 h,自来水洗去多余结晶紫,倒置显微镜下观察Transwell小室膜下的细胞(每组随机取5个视野进行细胞计数,取平均值表示),实验重复3次。
Matrigel检测HUVECs的成管能力:按文献[3]的方法通过人工基底膜(Matrigel)检测HUVECs的成管能力。预先将Matrigel放置于4℃冰箱过夜解冻,以每孔20 μl铺于96孔板中,冰上操作。然后将96孔板置于37℃、5%CO2培养箱中放置1 h。各组细胞消化后用无血清培养基重悬并以1×104个分别种于铺好的Matrigel上,放回培养箱继续培养,12 h后镜下观察并分析小管数量(随机取5个视野)。
逆转录-聚合酶链反应(RT-PCR)检测转染前后eNOS和Sp1 mRNA的表达:按照TRIzol试剂盒说明书提取各组的细胞总RNA。利用Primer 5.0软件设计合成人种属eNOS、Sp1以及β-actin的引物(序列见表1)。分别取细胞总RNA 1μg,加入1.0 μl(0.5 g/L)Oligo(dT)18引物,70 ℃变性 5 min,迅速置于冰上冷却。加入4μl 5×reaction buffer,1 μl RiboLockTM Ribonuclease Inhibitor(20 U/μl),2 μl 10 mmol/L dNTP Mix,37℃温育5 min,加入1 μl逆转录酶,42℃1 h,之后 70℃10 min终止反应,合成cDNA第1条链。PCR扩增反应:94 ℃ 预变性5 min后,开始30个循环: 94℃ 30 s、56℃ 1 min、72℃ 1 min;最后72℃ 5 min,终止反应。取5μl PCR产物进行1.5%琼脂糖凝胶电泳分析。

表1 引物序列
免疫蛋白印迹法检测 eNOS 和 Sp1 蛋白的表达:分别将各组细胞裂解,以8000 g离心力、4℃离心15 min,取上清。各组分别取蛋白30μg进行SDS-PAGE(8%)分离并转至聚偏二氟乙烯(PVDF)膜上。经脱脂奶粉封闭1 h后加入eNOS和Sp1Ⅰ抗湿盒过夜(4℃)。TBST(0.14 mol/L NaCl,2.7 mmol/L KCl,24.8 mmol/L Trise base,1%吐温,pH=7.4)冲洗3次(每次10 min),加入Ⅱ抗(辣根过氧化物酶标记)孵育,1 h后重复用TBST冲洗(方法同上)。利用LI-COR公司的Odyssey红外荧光扫描成像系统分析。
统计学处理:采用SPSS 16.0统计软件分析数据。实验重复3次,数据以均数±标准差(±s)表示,组间差异比较采用单因素方差分析,采用LSD-t和SNK-q检验。以P<0.05为差异有统计学意义。
2 结果
2.1miR-24对HUVECs增殖的影响
MTT检测结果显示miR-24高表达组细胞增殖明显受到抑制。培养72 h后,与空白质粒对照组相比,miR-24高表达组OD值降低45.45%(0.36±0.04 vs 0.66±0.08,P<0.05);miR-24干 扰 组OD值降低18.18%(0.54±0.05 vs 0.66±0.08,P<0.05)。与miR-24高表达组相比,miR-24干扰组OD值则增加50.00%(0.54±0.05 vs 0.36±0.04,P<0.05)。可见miR-24对HUVECs的增殖具有一定的抑制作用。
2.2miR-24对HUVECs迁移的影响
细胞划痕实验显示(图1),与空白质粒对照组相比,划痕24 h后miR-24高表达组HUVECs的迁移比例降低42.68%(0.47± 0.02 vs 0.82±0.01,P<0.05);miR-24干扰组HUVECs的迁移比例降低18.29%(0.67± 0.01 vs 0.82±0.01,P<0.05)。与miR-24高表达组相比,miR-24干扰组HUVECs的迁移比例则增加42.55%(0.67± 0.01 vs 0.47± 0.02,P<0.05)。
为了阐明miR-24对HUVECs迁移能力的影响,本实验选择Transwell试验进行再一次验证。Transwell结果以镜下被染色的细胞判定(见图2),并计数对比各组差异。与空白质粒对照组比较,miR-24高表达组细胞迁移数目明显降低74.75% (30.25±3.78 vs 119.80±10.94,P<0.01),miR-24干扰组细胞迁移数降低34.89%(78.00±4.30 vs 119.80±10.94,P<0.01); 而与 miR-24高表达组比较,miR-24干扰组细胞迁移数则增加157.85%(78.00±4.30 vs 30.25±3.78,P<0.01)。可见miR-24对HUVECs的迁移能力具有一定的抑制作用。
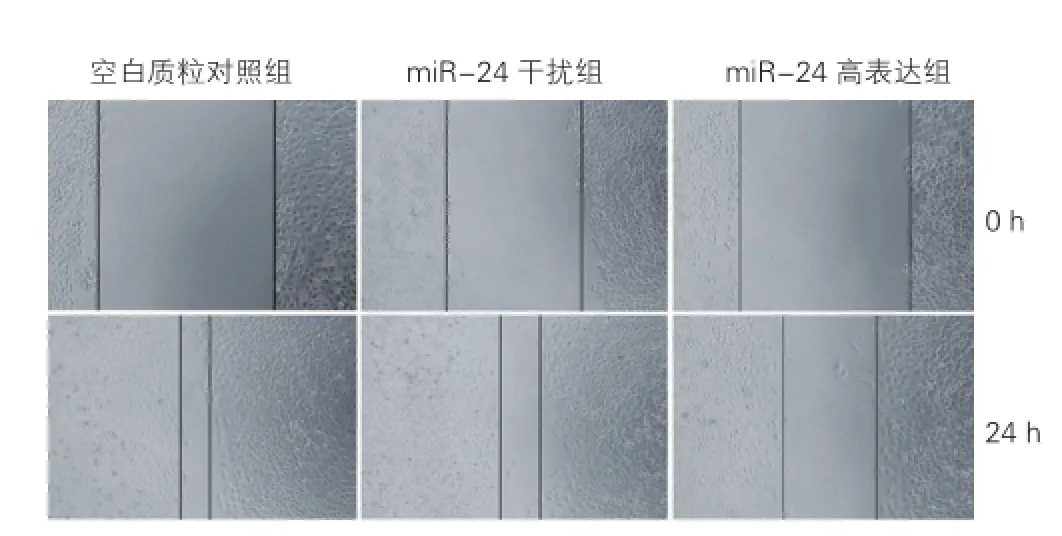
图1 微小核糖核酸-24对人脐静脉内皮细胞运动性的影响 (×100,n=3)

图2 微小核糖核酸-24对人脐静脉内皮细胞迁移的影响 (×100,n=3)
2.3miR-24对HUVECs管腔形成的影响(图3)
HUVECs的增殖和迁移能力与管腔形成密切相关,为了明确miR-24对HUVECs管腔形成的影响,本实验选择Matrigel试验进行验证。结果显示,与空白质粒对照组相比,miR-24干扰组HUVECs所形成的管腔数目、长度及宽度均较小,而miR-24高表达组HUVECs有聚集倾向,但未能形成管腔样网络结构。综上,miR-24对HUVECs的管腔形成具有一定的抑制作用。
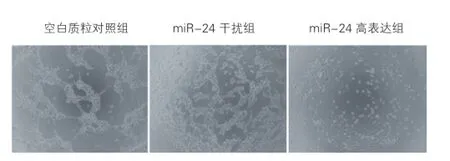
图3 微小核糖核酸-24对人脐静脉内皮细胞管腔形成的影响(×100,n=3)
2.4miR-24对HUVECs eNOS 和Sp1 mRNA表达的影响
RT-PCR结果显示,与空白质粒对照组相比,miR-24高表达组的eNOS mRNA表达量降低46.2% (0.49±0.02 vs 0.91±0.01,P<0.05),miR-24干扰组的eNOS mRNA表达量降低 17.6% (0.75±0.03 vs 0.91±0.01,P<0.05)。 而 与miR-24高 表 达 组相比,miR-24干扰组增加了53.06%(0.75±0.03 vs 0.49±0.02,P<0.05)。 可 见miR-24明 显 降 低HUVECs的eNOS mRNA水平。
与空白质粒对照组相比,miR-24高表达组的Sp1 mRNA表达量降 低44.9%(0.49±0.01 vs 0.89±0.02,P<0.05),miR-24干扰组的Sp1 mRNA 表 达 量 降 低 18.0%(0.73±0.02 vs 0.89±0.02,P<0.05)。而与miR-24高表达组相比,miR-24干扰 组 增 加 了 48.98%(0.73±0.02 vs 0.49±0.01,P<0.05)。可见miR-24明显降低HUVECs的Sp1 mRNA水平。
2.5miR-24对HUVECs eNOS和Sp1蛋白表达的影响
Western blotting的检测结果显示,与空白质粒对照组相比,miR-24高表达组的eNOS蛋白表 达 量 下 降 49.07%(0.55±0.05 vs 1.08±0.05,P<0.05),miR-24干扰组下降20.37% (0.86±0.07 vs 1.08±0.05,P<0.05);而与miR-24高表达组比较,miR-24 干扰组增加了56.36%(0.86±0.07 vs 0.55±0.05,P<0.05)。结果显示,miR-24明显降低HUVECs 的eNOS蛋白水平。
通过Western blotting对Sp1蛋白表达量进行分析,miR-24高表达组转录因子Sp1 的表达量比对照组下调54.90%(0.46±0.02 vs 1.02±0.04,P<0.05);miR-24干扰组转录因子Sp1的表达量比对照组下调27.45%(0.74±0.02 vs 1.02±0.04,P<0.05)。与miR-24高表达组比较,miR-24 干扰组蛋白表达量增加了60.87%(0.74±0.02 vs 0.46±0.02,P<0.05)。结果显示,miR-24明显降低HUVECs转录因子Sp1蛋白水平。
3 讨论
本研究发现,miR-24对HUVECs的eNOS和转录因子Sp1表达具有明显的抑制作用,而且Sp1可能作为重要的调节分子与miR-24共同参与对eNOS的表达调控。进一步发现,该调控机制可能与miR-24抑制HUVECs的管腔形成有关。另外,我们再一次验证了miR-24对HUVECs增殖的抑制作用,因此推测miR-24可能通过调控内皮细胞的增殖和管腔形成能力进而调控血管生成。
血管生成是从原有的血管上形成新血管的过程,不仅贯穿整个生命过程,而且在心血管疾病的发生、发展过程中发挥着重要作用。近年来,研究表明,血管生成与某些miRNA的调控密切相关。例如干扰内皮型miRNA的成熟将影响内皮细胞功能以及内皮细胞的血管形成能力;大鼠妊娠期敲除Dicer基因使血管发生异常,甚至导致胚胎死亡。miR-24属于miR-23~27~24家族,在心脏特别是血管组织表达最高[7]。值得注意的是,在高血压患者血浆中有16个miRNA明显下调,而miR-24等14个miRNA则明显上调,而且miR-24与高血压的严重程度和并发症呈现正相关。然而,虽然近年来有关miR-24在心肌梗死过程中调控心肌细胞凋亡的研究已取得重大进展,其相应的信号通路以及发挥的生物学效应也逐步被阐明,但miR-24通过调控内皮细胞功能促进血管生成的研究仍处于起步状态。
eNOS是组织特异性基因,其产物NO不仅是调节血管紧张度的舒张因子,而且在内皮细胞生长、迁移、血管重构和血管生成等方面起着至关重要的作用[3]。然而,随着年龄的增长或病理过程的发展,内皮细胞功能障碍引起的NO生成减少,将导致血管新生功能减弱,以及血管内皮受损区域的修复能力显著降低[8]。例如,心血管疾病患者体内NO产量减少,且循环内皮祖细胞数量和血管内皮修复功能降低[9]。通过刺激内皮细胞迁移促进血管内皮修复及毛细血管的形成治疗心血管疾病,得到了普遍认可。目前,在缺血性心脏病的治疗中,干细胞移植疗法是一个新颖而颇具前景的选择[10,11]。近期体外试验证实,eNOS的表达与间充质干细胞的迁移能力密切相关[12],有进一步研究提示,锌指蛋白可通过促进内皮祖细胞的eNOS表达促进其定向内皮细胞分化。而Sp1是锌指蛋白家族中最具代表性的一员,eNOS核心启动子区域的GC盒含有Sp1的高亲和位点,且Sp1是eNOS的必需转录因子。引人注目的是,miR-24可促进干细胞定向分化及表达心血管祖细胞(cardiovascular progenitor cells,CPC)功能,并提高CPC移植到心脏MI区域后的存活率[13],促进血浆中干细胞通过趋化作用富集并进入血管壁,使血管稳定成熟,但其调控机制尚不明晰。
综上所述,本研究已证明miR-24可能通过调节eNOS和Sp1对HUVECs的增殖和管腔形成具有一定的抑制作用。然而该调控机制是否对血管生成具有调控作用,以及是否参与干细胞定向内皮细胞分化,仍需进一步探讨。
[1]Zhou Q,Anderson C,Zhang H,et al. Repression of choroidal neovascularization through actin cytoskeleton pathways by microRNA-24. Mol Ther,2014,22: 378-389.
[2]Lorenzen JM,Kaucsar T,Schauerte C,et al. MicroRNA-24 Antagonism Prevents Renal Ischemia Reperfusion Injury. J Am Soc Nephrol,2014,25: 2717-2729.
[3]Huang JJ,Shi YQ,Li RL,et al. Angiogenesis effect of therapeutic ultrasound on HUVECs through activation of the PI3K-Akt-eNOS signal pathway. Am J Transl Res,2015,7: 1106-1115.
[4]Zhang W,Yan L,Li Y,et al. Roles of miRNA-24 in regulating endothelial nitric oxide synthase expression and vascular endothelial cell proliferation. Mol Cell Biochem,2015,405: 281-289.
[5]Hung HS,Chang CH,Chang CJ,et al. In Vitro Study of a Novel Nanogold-Collagen Composite to Enhance the Mesenchymal Stem Cell Behavior for Vascular Regeneration. PLoS One,2014,9: e104019.
[6]Pafumi I,Favia A,Gambara G,et al. Regulation of Angiogenic Functions by Angiopoietins through Calcium-Dependent Signaling Pathways. Biomed Res Int,2015,2015: 965271.
[7]Zhou Q,Gallagher R,Ufret-Vincenty R,et al. Regulation of angiogenesis and choroidal neovascularization by members of microRNA-23~27~24 clusters. Proc Natl Acad Sci U S A,2011,108:8287-8292.
[8]赵艳霞,格日力. 内皮型一氧化氮合酶脱偶联在心血管疾病中的致病作用. 中国循环杂志,2014,4: 315-318.
[9]Schmidt-Lucke C,Rössig L,Fichtlscherer S,et al. Reduced number of circulating endothelial progenitor cells predicts future cardiovascular events: proof of concept for the clinical importance of endogenous vascular repair. Circulation,2005,111: 2981-2987.
[10]Premer C,Blum A,Bellio MA,et al. Allogeneic Mesenchymal Stem Cells Restore Endothelial Function in Heart Failure by Stimulating Endothelial Progenitor Cells. E Bio Medicine,2015,2: 467-475.
[11]李玲,石蓓. 心脏干细胞移植治疗缺血性心脏病的研究进展. 中国循环杂志,2015,3: 290-292.
[12]Lin YL,Yet SF,Hsu YT,et al. Mesenchymal Stem Cells Ameliorate Atherosclerotic Lesions via Restoring Endothelial Function. Stem Cells Transl Med,2015,4: 44-55.
[13]Hu S,Huang M,Nguyen PK,et al. Novel microRNA prosurvival cocktail for improving engraftment and function of cardiac progenitor cell transplantation. Circulation,2011,124(11 Suppl): S27-34.
Effects of miR-24 on Endothelial Nitric Oxide Synthase Gene Expression and Tube Formation in Human Umbilical Vein Endothelial Cells
CHEN Wei,MO Guo-jun,LUO Xue-lan,WANG Hui,YANG Peng,OU He-sheng.
College of Pharmacy,Guangxi Medical University,Nanning (530021),Guangxi,China
Corresponding Author: OU He-sheng,hsou01@yahoo.com
RNA; Tube formation; Endothelial nitric oxide synthase; Sp1
2015-11-22)
(编辑:许菁)
国家自然科学基金项目(81373403);广西研究生科研创新项目(YCSZ2015119)
530021广西壮族自治区南宁市,广西医科大学药学院
陈伟硕士研究生主要研究方向:心血管分子药理学Email:chenwei_mir2013@163.com通讯作者:欧和生Email:hsou01@yahoo.com
R54
A
1000-3614(2016)08-0797-05
10.3969/j.issn.1000-3614.2016.08.017

