经皮穴位电刺激对颅脑手术行控制性降压重要脏器功能的保护效应
莫云长,陈林碧,王茜茜,潘媛媛,骆珊,黄陆平,王均炉
(温州医科大学附属第一医院 麻醉科,浙江 温州 325015)
·论著·
经皮穴位电刺激对颅脑手术行控制性降压重要脏器功能的保护效应
莫云长,陈林碧,王茜茜,潘媛媛,骆珊,黄陆平,王均炉
(温州医科大学附属第一医院 麻醉科,浙江 温州 325015)
目的:探讨经皮穴位电刺激(TEAS)在颅脑手术行控制性降压过程中对脑、肝、肾等脏器的保护作用。方法:选择颅脑手术患者50例,随机分为对照组和观察组,各25例。观察组:TEAS+控制性降压,刺激频率为2/100 Hz,疏密波,强度为8~12 mA,电刺激双侧合谷、三阴交、曲池、足三里4个穴位,降低平均动脉压(MAP)到达目标值持续40~50 min;对照组:仅用TEAS的电极贴附固定穴位,不进行刺激,其余处理同观察组一样。分别于降压前5 min(T1)、维持血压60 min(T2)、升压后60 min(T3)、术后24 h(T4)、术后48 h(T5)等时间点抽取颈内静脉血,检测脑保护和脑损伤因子:超氧化物岐化酶(SOD),降钙素基因相关肽(CGRP)、内皮素(ET)、丙二醛(MDA)、白介素-6(IL-6)、S100β蛋白;心功能指标:乳酸脱氢酶(LDH)、心肌肌钙蛋白(cTnI)、肌红蛋白(MYO)、肌酸激酶(CK)、肌酸激酶同工酶(CK-MB);肝功能指标:前白蛋白(PA)、α谷胱甘肽S转移酶(α-GST)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(ALP)、γ-谷氨酰胺转移酶(γ-GT);肾功能指标:胱抑素C(Cys C)、尿素氮(BUN)、肌酐(Cr)、尿酸等。结果:①在脑保护和脑损伤因子方面:与T1相比,对照组患者的SOD因子在T2、T3、T5时明显降低(P<0.05),CGRP、ET、MDA、IL-6水平在T3、T4或T5均明显升高(P<0.05)。与对照组相比,观察组可分别在T2降低IL-6和S100β水平,在T3降低ET水平,在T4提高SOD水平,在T5降低MDA水平(P<0.05);②在心功能指标方面:2组患者差异均无统计学意义(P>0.05);③在肾功能指标方面:与T1相比,对照组Cys C水平在T2与T3时明显升高(P<0.05)。与对照组相比,观察组在T2与T3时可以降低Cys C水平(P<0.05);④在肝功能指标方面:与T1相比,对照组患者的AST、ALT、α-GST含量分别在T2、T3、T4或T5明显升高(P<0.05),PA含量在T2和T5显著降低(P<0.05)。与对照相比,观察组在T2与T3时可以降低α-GST含量,在T4与T5时降低AST和ALT水平(P<0.05)。结论:颅脑手术行控制性降压时,对脑、肝、肾可产生一定的影响,TEAS在开颅手术行控制性降压时对脑、肝、肾等器官起到一定的保护作用。
经皮穴位电刺激;神经外科手术;控制性降压;器官保护
围术期行控制性降压是控制开颅手术中因病灶血运丰富而导致出血过多的重要措施。但是在行控制性降压期间,重要脏器可能会产生缺血再灌注损伤[1-2]。目前采用控制性降压的药物中,麻醉药物在控制性降压方面能取得较满意的效果,但是为了达到目标平均动脉压(mean arterial pressure,MAP),需要较高浓度的麻醉药物,从而会对患者产生不良影响[3]。经皮穴位电刺激(transcutaneous electrical acupoint stimulation,TEAS)具有减少术中麻醉药用量、调控患者生理指标、促进术后恢复等特点,目前已经用于围术期[2]。本研究通过对颅脑手术患者行控制性降压期间,观察降压前后心、脑、肝、肾等重要脏器的功能指标变化,探讨MAP对颅脑手术行控制降压是否能达到脏器保护的效应,为针药复合麻醉在围术期行控制性降压时的应用提供依据。
1 资料和方法
1.1一般资料 选择在温州医科大学附属第一医院收住并符合临床需行控制性降压标准的颅脑手术患者50例。美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级:I~I I级,其中男14例,女36例,年龄17~65岁,体质量40~88 kg。其中ASA I级28例,I I级22例。纳入标准:①患有脑膜瘤、脑胶质瘤、脑动脉瘤和脑转移肿瘤等需手术治疗患者;②控制性降压时间大于1 h。排除标准:①经穴循行经线进行过手术的患者;②经穴局部有皮肤感染的患者;③有上肢或者下肢神经损伤的患者;④近4周内参加过其他临床试验患者;⑤不能配合完成研究计划的患者,包括语言困难、传染病及其他病史。利用随机化分组表,选取任意一行数字,规定对应奇数随机数字的患者入选试验组,对应偶数随机数字的患者入选对照组,每组各25例。观察组为丙泊酚静脉靶控输注(target controlled infusion,TCI)复合TEAS,对照组为丙泊酚静脉TCI复合假TEAS。本研究报请本院伦理委员会审核并通过,与研究对象签订知情同意书。
1.2观察组处理 ①麻醉方法:诱导以静脉TCI异丙酚3~5 μg/mL、舒芬太尼3~4 μg/kg、维库溴胺0.1~0.15 mg/kg,气管插管,控制呼吸,维持呼气末CO2分压30~35 mmHg(1 mmHg=1.4 cmH2O),术中以持续静脉TCI异丙酚2~3 μg/mL,并分别于降压前、剪脑膜、缝合脑膜时静脉输注舒芬太尼0.2~0.3 μg/kg、维库溴胺0.1~0.15 mg/kg维持麻醉,麻醉深度以量化脑电双频谱指数(bispectral index,BIS)监测,若BIS值高于50或低于40且持续1 min,按0.5 μg/mL的速度上下调整丙泊酚靶控浓度维持BIS值在45±5。②控制性降压方法:打开脑膜麻醉稳定后行控制性降压,即通过调节硝酸甘油浓度,降低MAP到达目标MAP(即MAP与术前比较下降30%~35%,同时确保MAP≥50 mmHg),并持续60 min。③TAES方法:麻醉诱导前给予30 minTAES诱导并持续到手术结束。刺激参数:频率2/100 Hz,疏密波,强度8~12 mA。穴位取合谷、三阴交、曲池、足三里等4个穴位。④围术期血压控制:MAP高于目标MAP值10%且持续时间超过3 min时,静脉注射尼卡地平0.5 mg(可重复);MAP低于目标MAP 值10%且持续时间超过3 min时,静脉注射麻黄碱3~5 mg(可重复)。若出现心动过缓,予阿托品0.5 mg静脉注射;若出现心动过速予艾司洛尔20 mg静脉注射。2组患者术毕均采用新斯的明1.0 mg加阿托品0.5 mg拮抗肌松药的残余作用。术后30 min内自主呼吸满意,拔除气管导管。观察10 min,如生命体征稳定,送恢复室。
1.3对照组处理 仅作相同穴位行TAES电极贴附固定,不进行任何电刺激,其余处理方法均同观察组。
1.4液体管理 患者麻醉诱导前常规静脉输注乳酸林格氏液500 mL,诱导后输注羟乙基淀粉500 mL,然后根据循环监测输注乳酸林格氏液或万汶。血红蛋白(hemoglobin,Hb)浓度<7 g/dL时,开始成分输血。钻颅骨前,常规注射20%甘露醇250 mL。
1.5监测指标 分别在降压前5 min(T1)、维持血压60 min(T2)、升压后60 min(T3)、术后24 h (T4)、术后48 h(T5)抽取10 mL血液装在抗凝管中,再分装在预处理抗凝管中(预处理方法:每支抗凝管中加入1 500~2 000 U抑肽酶),2管血均放在4 ℃离心机中,4 000 r/min,20 min后取上层血浆,置于-70 ℃冰箱中保存。用于测定脑保护和脑损伤因子:包括内皮素(endothelin,ET)、降钙素基因相关肽(calcitonin gene-related peptide,CGRP)、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、白介素-6 (interleukin-6,IL-6)、S100β蛋白;心功能指标:乳酸脱氢酶(lactate dehydrogenase,LDH)、心肌肌钙蛋白(cardiac troponin I,cTnI)、肌红蛋白(myoglobin,MYO)、肌酸激酶(creatine kinase,CK)、肌酸激酶同工酶(creatine kinase isoenzymes,CK-MB);肾功能指标:胱抑素C(cystatin c,Cys C)、尿素氮(urea nitrogen,BUN)、肌酐(creatinine,Cr)、尿酸;肝功能指标:前白蛋白(prealbumin,PA)、α谷胱甘肽S转移酶(α-glutathione-s-transferase,α-GST)、谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate transaminase,AST)、碱性磷酸酶(alkaline phosphatase,ALP)、γ-谷氨酰胺转移酶(γ-glutamyl transpeptidase,γ-GT)。
1.6统计学处理方法 采用SPSS11.0统计软件进行数据分析。计数资料采用卡方检验。计量资料以表示,进行正态分析及方差齐性检验。组内比较采用重复测量方差分析,各个时间点两两比较采用LSD检验。同一时间点,组间比较采用成组t检验。P<0.05为差异有统计学意义。
2 结果
2.12组患者一般情况比较 2组手术患者的年龄、性别(男/女)、体质量、出血量、手术时间等差异无统计学意义(P<0.05)。见表1。

表1 2组患者一般情况(n=25)
2.22组患者降压前、中、后脑功能指标变化
2.2.1脑保护因子的变化:观察组患者的SOD在T3时明显较T1降低,差异有统计学意义(P<0.05);而对照组患者的SOD在T2、T3和T5时明显降低,差异有统计学意义(P<0.05)。观察组患者的CGRP水平在T3、T4和T5时间点上均较T1明显升高,差异有统计学意义(P<0.05);对照组患者的CGRP水平在T3、T4和T5时间点上均较T1明显升高,差异有统计学意义(P<0.05)。在T1、T2、T3和T5时间点,2组患者的SOD和CGRP水平差异无统计学意义(P>0.05);在T4时间点,观察组患者的SOD水平较对照组明显增高,差异有统计学意义(P<0.05),而2组患者的CGRP差异无统计学意义(P>0.05)。见表2。2.2.2 脑损伤因子的变化:观察组患者的ET含量在T3时间点明显较T1时间点降低,差异有统计学意义(P<0.01);对照组患者的ET含量在T3时间点明显较T1时间点升高,差异有统计学意义(P<0.01)。观察组患者的MDA在T4明显较T1时间点降低,而在T5点上较T1明显升高,两者差异均有统计学意义(P<0.05);对照组患者的MDA在T3和T5时间点上明显较T1点升高,差异有统计学意义(P<0.01)。观察组患者的IL-6水平在T2时间点上较T1明显降低,差异有统计学意义(P<0.01);对照组患者的IL-6水平在T2时间点上较T1明显升高,差异有统计学意义(P<0.01)。观察组患者的S100β含量在T2和T5时间点上较T1明显降低,差异有统计学意义(P<0.05);而对照组患者的S100β含量在T2、T3、T4、T5时间点上均与T1时间点差异无统计学意义(均P>0.05)。在T2时间点上,观察组患者的IL-6和S100β水平均较对照组明显降低,差异有统计学意义(P<0.05);在T3时间点上,观察组患者的ET水平较对照组明显降低,差异有统计学意义(P<0.01);在T4时间点上,观察组患者的MDA水平较对照组明显降低,差异有统计学意义(P<0.05);在T5时间点上,观察组患者的MDA和S100β水平较对照组明显降低,差异有统计学意义(P<0.05)。见表2。
表2 2组患者降压前、中、后脑保护和脑损伤因子的变化(n=25,±s)
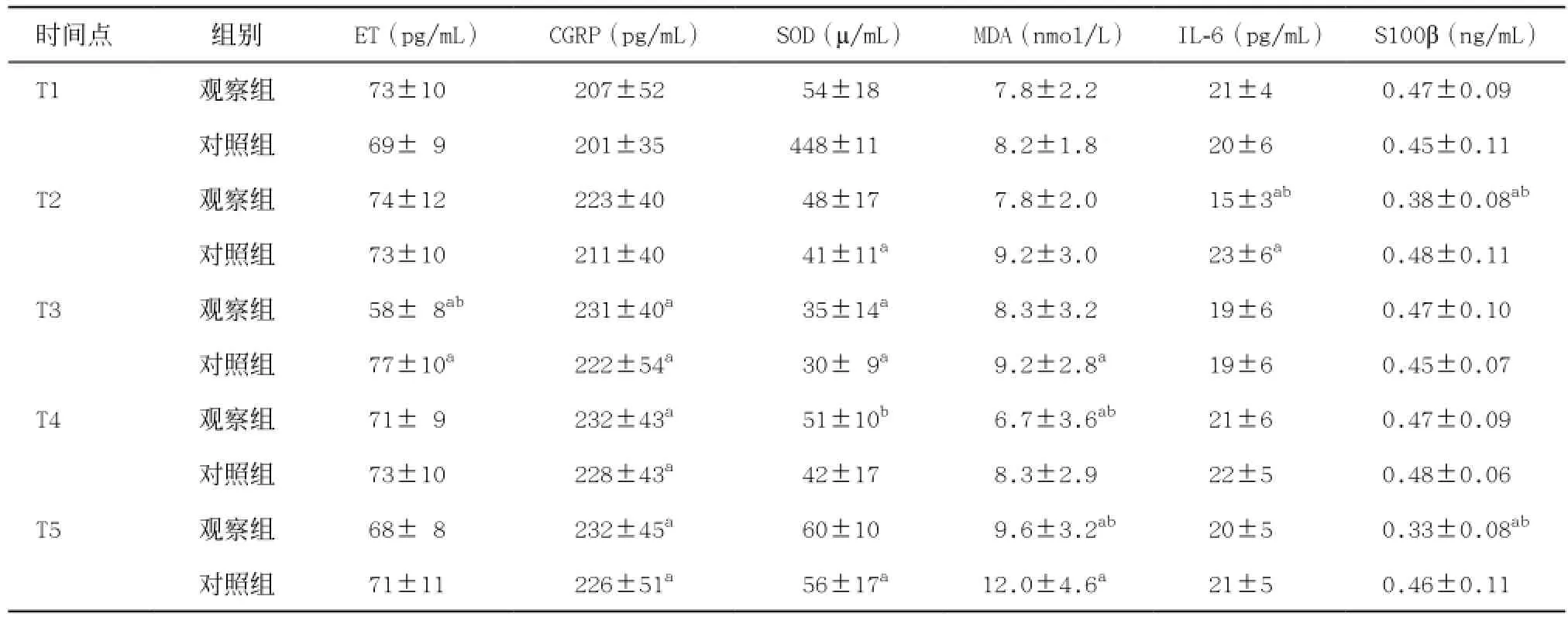
表2 2组患者降压前、中、后脑保护和脑损伤因子的变化(n=25,±s)
与T1比:aP<0.05;与对照组比:bP<0.05
时间点组别 ET(pg/mL) CGRP(pg/mL) SOD(µ/mL) MDA(nmol/L) IL-6(pg/mL) S100β(ng/mL)T1 观察组 73±10ab 207±52b 54±18b 7.8±2.2ab 21±4ab 0.47±0.09ab对照组 69± 9ab 201±35b 448±11b 8.2±1.8ab 20±6ab 0.45±0.11abT2 观察组 74±12ab 223±40b 48±17b 7.8±2.0ab 15±3ab 0.38±0.08ab对照组 73±10ab 211±40b 41±11a 9.2±3.0ab 23±6ab 0.48±0.11abT3 观察组 58± 8ab 231±40a 35±14a 8.3±3.2ab 19±6ab 0.47±0.10ab对照组 77±10ab 222±54a 30± 9a 9.2±2.8ab 19±6ab 0.45±0.07abT4 观察组 71± 9ab 232±43a 51±10b 6.7±3.6ab 21±6ab 0.47±0.09ab对照组 73±10ab 228±43a 42±17b 8.3±2.9ab 22±5ab 0.48±0.06abT5 观察组 68± 8ab 232±45a 60±10b 9.6±3.2ab 20±5ab 0.33±0.08ab对照组 71±11ab 226±51a 56±17a 12.0±4.6ab 21±5ab 0.46±0.11ab
2.32组患者降压前、中、后心功能指标变化 观察组患者的LDH水平在T5上相较于T1显著升高(P<0.01);对照组患者的LDH在T5时间点明显较T1时间点升高,差异有统计学意义(P<0.01)。观察组患者的MYO含量在T3,T4和T5时间点明显较T1时间点升高,差异有统计学意义(P<0.05);对照组患者的MYO含量在T3,T4和T5时间点明显较T1时间点升高,差异有统计学意义(P<0.05)。在T1、T2、T3、T4和T5时间点上,2组患者的心功能指标LDH、cTnI、MYO、CK和CK-MB差异均无统计学意义(均P>0.05)。见表3。
2.42组患者降压前、中、后肾功能指标变化 观察组患者的Cys C水平在T3上相较于T1显著升高(P <0.01);对照组患者的Cys C在T2和T3时间点明显较T1时间点升高,差异有统计学意义(P<0.05)。观察组患者的尿酸含量在T5时间点明显较T1时间点升高,差异有统计学意义(P<0.05);在T2时间点上,相比于T1,对照组患者的尿酸含量显著升高(P <0.05)。观察组患者血Cr含量在T2时间点明显较T1时间点升高,差异有统计学意义(P<0.01);相比于T1,对照组患者的血Cr含量在其它时间点上差异无统计学意义(P>0.05)。观察组患者的血BUN含量在T3时间点明显较T1时间点升高,差异有统计学意义(P<0.05);在T5时间点上,相比于T1,对照组患者的血BUN含量显著升高(P<0.05)。在T2时间点上,观察组患者的Cys C水平较对照组显著降低,差异有统计学意义(P<0.01);在T3时间点,观察组患者的Cys C水平较对照组显著降低,差异有统计学意义(P<0.01)。见表4。
2.52组患者降压前、中、后肝功能指标变化 观察组患者的AST含量在T3、T4和T5时间点明显较T1时间点升高,差异有统计学意义(P<0.05);对照组患者的AST含量在T2、T3、T4和T5时间点明显较T1时间点升高,差异有统计学意义(P<0.05)。观察组患者的ALT含量在T4和T5时间点明显较T1时间点升高,差异有统计学意义(P<0.05);对照组患者的ALT含量在T4和T5时间点明显较T1时间点升高,差异有统计学意义(P<0.05)。观察组患者的α-GST水平在T2、T3、T4时间点上较T1明显升高,差异有统计学意义(P<0.05);对照组患者的α-GST水平在T2和T3时间点上较T1明显升高,差异有统计学意义(P<0.05)。在T2、T3、T4和T5时间点上,相比于T1,2组患者的GGT水平差异无统计学意义(P >0.05)。观察组在T4时间点的ALP水平较T1升高,差异有统计学意义(P<0.05);对照组的ALP水平在其他时间点相较于T1差异均无统计学意义(均P >0.05)。观察组患者的PA含量在T5时间点上相较于T1显著降低(P<0.01);对照组患者的PA含量在T2和T5时间点上相较于T1显著降低,差异有统计学意义(P>0.05)。在T2时间点上,观察组患者的α-GST较对照组显著降低(P<0.01);在T3时间点上,观察组患者的α-GST较对照组显著降低(P<0.01);在T4时间点,观察组患者的AST和ALT均较对照组患者显著降低,差异有统计学意义(P<0.05);在T5时间点,观察组患者的AST和ALT均较对照组患者显著降低,差异有统计学意义(P<0.05)。见表5。
表3 2组患者降压前、中、后心功能指标变化(n=25,±s)

表3 2组患者降压前、中、后心功能指标变化(n=25,±s)
与T1比:aP<0.05
时间点组别 LDH(U/L) cTnI(μg/L) MYO(μg/L) CK(U/L) CK-MB(U/L)T1 观察组 125±36a 0.0020±0.0013 21±17a 51± 7 7.6±2.8对照组 133±52a 0.0021±0.0014 24±16a 50± 9 7.5±2.0 T2 观察组 125±37a 0.0022±0.0018 24±20a 49± 8 7.7±2.3对照组 129±42a 0.0023±0.0020 25±21a 53± 8 7.9±2.8 T3 观察组 124±39a 0.0023±0.0021 27±17a 50± 9 7.4±3.0对照组 133±48a 0.0023±0.0020 28±24a 55±13 7.5±2.2 T4 观察组 135±29a 0.0026±0.0014 43±27a 48±11 6.5±2.1对照组 142±43a 0.0030±0.0025 40±27a 51±14 6.7±1.8 T5 观察组 145±29a 0.0028±0.0020 41±24a 48± 7 7.8±2.4对照组 150±37a 0.0034±0.0021 30±28a 50± 8 7.8±2.6
表4 2组患者肾功能指标变化(n=25,±s)

表4 2组患者肾功能指标变化(n=25,±s)
与T1比:aP<0.05;与对照组比:bP<0.05
时间点组别 Cys C(mg/L) 尿酸(μmmol/L) 血Cr(μmmol/L) 血BUN(mmol/L)T1 观察组 0.69±0.15ab 201±75b 48± 8b 4.2±0.9b对照组 0.72±0.21ab 228±54b 52±14b 4.8±1.5bT2 观察组 0.77±0.17bb 249±44b 55± 6a 4.8±0.9b对照组 1.24±0.35ab 240±60a 59± 8b 4.7±0.9bT3 观察组 0.79±0.20ab 210±31b 48±12b 4.8±0.8a对照组 1.12±0.37ab 205±64b 45± 9b 5.2±1.3bT4 观察组 0.78±0.20ab 188±46b 48±10b 4.4±0.6b对照组 0.79±0.11ab 189±61b 46±11b 4.7±0.5bT5 观察组 0.74±0.14ab 192±37a 48± 8b 5.1±1.2b对照组 0.82±0.21ab 188±46b 45±12b 5.0±1.4a
3 讨论
颅内手术具有手术时间长,出血量较多等特点,如何减少术中出血量,降低围术期并发症的发生率,是促进术后恢复的关键。控制性降压应用于颅脑手术可以减少出血,是一项非常重要的技术[4]。控制性降压是指在某些手术麻醉期间,采用降压药物与技术使患者MAP降低至50~65 mmHg左右,终止降压后迅速恢复至正常水平。控制性降压不仅能够减少失血和输血,还能改善术野的环境,缩短手术时间,使手术期的安全性增加。但是控制性降压造成的缺血再灌注会对重要脏器产生损伤:①控制性降压期间,由于神经细胞对缺氧的耐受性低,因此一旦发生脑供血不足就会引起脑细胞功能损害[5]。并且研究发现一旦MAP低于55 mmHg,脑血流将随动脉血压而平行地下降,从而影响脑功能造成术后脑功能不全。②控制性降压期间因药物对心肌的抑制和对外周血管阻力的降低,从而引起心输出量和主动脉压的降低,最终可能导致心肌缺血性损害[6]。③由于控制性降压期间的低灌注特点,容易导致肝组织的缺血、缺氧损伤,而肝的缺血、缺氧必然会导致肝功能的改变[7]。④肾脏本身对肾血流量和肾小球滤过率有调节作用,但是随着MAP的降低超出肾脏自身调节的下限,肾血流量将减少,从而诱发急性肾损伤[8]。研究表明,术中血压下降引起的血流量减少和术后血压回升引起的再灌注/无复流损伤是引起肾脏结构和功能损伤的主要原因[9]。
表5 2组患者降压前、中、后肝功能指标变化(n=25,±s)

表5 2组患者降压前、中、后肝功能指标变化(n=25,±s)
与T1比:aP<0.05;与对照组比:bP<0.05
时间点组别 AST(U/L) ALT(U/L) α-GST(μg/L) γ-GT(U/L) ALP(U/L) PA(mg/L)T1 观察组 8.6±3.5ab 10.7±2.9ab 21±6ab 15±5 43±9b 186±30b对照组 8.8±2.8ab 9.4±3.6ab 22±8ab 14±5 47±9b 179±42bT2 观察组 10.9±2.0ab 11.1±2.1ab 26±6ab 15±5 41±9b 165±63b对照组 10.3±2.5ab 11.6±3.1ab 33±5ab 14±5 46±9b 137±51aT3 观察组 12.1±3.6ab 9.4±2.8ab 25±5ab 15±5 43±9b 172±44b对照组 11.2±3.5ab 9.6±3.6ab 36±7ab 14±4 45±9b 169±38bT4 观察组 17.5±6.0ab 16.7±5.6ab 25±6ab 14±3 48±9a 173±34b对照组 24.4±8.1ab 22.4±7.8ab 26±5ab 14±7 49±9b 159±58bT5 观察组 26.8±7.6ab 25.0±7.3ab 24±7ab 15±5 45±9b 154±45a对照组 39.1±6.1ab 37.9±5.9ab 24±7ab 14±6 44±9b 144±51a
已有研究[7,10-11]表明,针刺在低血压状态下对脑、心、肝、肾、胃都具有一定的保护作用。目前针药复合麻醉在围术期逐渐得到应用,这既保留了针刺麻醉的优势,又解决了针刺镇痛不全的难题,同时大大减少了麻醉药物的用量,提高了患者的安全性[12]。
而TEAS是一种经皮神经电刺激(transcutaneous electrical nerve stimulation,TENS)与穴位治疗相结合的新型针刺疗法,具有与电针相似的镇痛效应及神经化学机制。并且相对于手针和电针,TEAS操作简单、安全无创。随着麻醉监测方法的进步,如BIS、Narcotrend监测等增加了针刺以及相关技术干预效应的说服力[13-14],采用TEAS代替传统电针用于针药复合麻醉将成为一种有益的探索。
围术期维护组织氧供需平衡是减轻机体术后继发性损伤的有效措施。在颅脑手术中行控制性降压后,通过检测一系列脑保护和脑损伤因子,来明确是否会带来不同程度的脑损伤。其中SOD与MDA作为反映氧自由基水平的2个指标,两者比例失衡代表着脑神经元氧自由基水平明显升高[15]。CGRP广泛分布于中枢神经系统和外周神经系统。它可以直接扩张脑血管或拮抗ET的缩血管作用,恢复和增加脑血流量,减少脑组织缺血性损伤,并对缺氧神经元有保护和功能恢复等作用[16]。而ET广泛分布于神经细胞和神经系统的血管内皮细胞中,是迄今所知作用最强、最持久的缩血管活性多肽,作为内源性损伤因子参与许多中枢神经系统损伤的病理过程。ET与CGRP的比值往往作为脑组织损伤的一个指标之一[17]。而有研究[18]表明炎症因子中IL-6具有神经毒性作用、促退行性变作用或促进炎性反应级联放大作用等。S100β蛋白主要由神经胶质细胞合成和分泌,其含量的升高与脑损伤相关,而且可以作为预测患者预后的一个指标。我们发现在控制性降压期间,SOD的含量减低,MDA含量增加,提示控制性降压时脑自由基水平明显升高,而且ET含量增加,IL-6明显升高,均提示控制性降压后脑损伤因子明显升高。而TEAS组患者术后早期的SOD和CGRP含量升高,ET、MDA、IL-6和S100β蛋白含量均明显减少,提示TEAS可以明显增加脑保护因子,降低脑损伤因子的产生,从而达到脑功能保护效果。在动物研究上也发现,通过穴位刺激的预处理能够减少大脑中动脉阻塞造成的脑梗死体积,并且凋亡抑制蛋白Bcl-2表达量也明显增加[19]。
cTnI是目前临床敏感性和特异性最好的心肌损伤标志物,已成为心肌组织损伤最重要的诊断依据,MYO是检测急性心肌缺血的早期指标。除了以上2个指标外,CK-MB和LDH是检测心肌损伤的早期指标[20]。本研究发现,与术前和控制性降压期间相比,MYO在T4和T5均明显增高,但2组间差异无统计学意义,并且2组患者在组间和组内各时间点的LDH、cTnI、CK、CK-MB均无明显差异。由此提示颅脑外科手术在全麻期间行控制性降压对心肌并未产生明显的损伤,但是可能存在一定程度的缺血。
α-GST在肝脏中含量最高,当肝组织受损时会迅速释放到血液中,并且该酶的半衰期只有60 min,是肝脏功能损伤的早期灵敏标志[21]。ALT和AST是在临床上检验肝功能时应用最多的指标,主要存在于肝细胞中,其升高常提示肝功能受损。我们的研究发现,2组患者T4和T5均可出现血ALT、血AST增高,并且α-GST含量于行控制性降压期间明显增加,提示控制性降压会影响肝脏功能,并且通过TEAS能够降低血ALT、AST及α-GST的增高幅度,由此提示穴位刺激可能具有保护肝功能的效应。2组患者的一系列肾脏功能指标,其中Cys C的血清浓度与肾小球滤过率密切相关,在肾功能不全等多种疾病中能够很好地替代血Cr和肌酐清除率成为一种新的可反映肾小球滤过率的理想标记物[22]。根据我们的临床试验结果,与降压前相比,Cys C在行控制性降压时含量明显增高,提示控制性降压对肾脏功能有所损害,并且给予TEAS的观察组患者的Cys C的增高幅度低于对照组,提示了穴位刺激可能具有保护肾脏功能的效应。
虽然TEAS辅助麻醉尚存在一定的不足之处,如效果的稳定性、评价指标的客观性、穴位的最优化等,但是本研究得出TEAS与全麻结合应用于颅脑手术行控制性降压中对脑、肝、肾等重要脏器具有一定的保护作用,为围术期行控制性降压提供一定的临床依据。
[1]王宇,崔宇,刘馨烛,等. 控制性降压对大脑影响的系统评价[J]. 中国循证医学杂志,2009,9(1): 88-92.
[2]方剑乔,王均炉,邵晓梅,等. 针药复合麻醉的新思路—经皮穴位电刺激参与全麻行控制性降压中对器官保护的可行性[J]. 针刺研究,2007,32(6): 402-406.
[3]杨云,汪小海. 麻醉药物不良反应国内文献计量学研究[J].徐州医学院学报,2006,26(3): 243-245.
[4]林海,王均炉,姚尚龙. 神经外科手术期问地氟烷复合丙泊酚控制性降压的临床研究[J]. 温州医学院学报,2005,35(5): 379-382.
[5]林洪启,韩冬梅,孟凡民. 全髋置换术中控制性降压对内脏灌注的影响[J]. 中医正骨,2005,17(10): 16-18.
[6]方剑乔,邵晓梅,张乐乐,等. 经皮穴位电刺激复合药物全麻行控制性降压对心功能及心肌抗氧化能力的影响[J].中国针灸,2012,32(10): 913-917.
[7]张乐乐,方剑乔,邵晓梅,等. TEAS复合药物全麻行控制性降压至60%基础MAP水平时的肝保护效应分析[J]. 中华中医药学刊,2012,30(10): 2167-2171.
[8]陈莺,刘乐,金烈烈,等. 颅脑手术患者不同血压水平对内脏灌注和代谢指标的影响[J]. 温州医学院学报,2010,40 (2): 152-155.
[9]李秋霞,杨慧蓉,安刚,等. 控制性低血压联合血液稀释对兔肾小球滤过率的影响[J]. 中华麻醉学杂志,2002,22(7): 420-422.
[10] 邵晓梅,方剑乔,周传龙,等. 经皮穴位电刺激复合麻醉药物全麻行控制性降压对丘脑局部血流的影响[J]. 临床麻醉学杂志,2012,28(6): 599-601.
[11] 石君杰,李新伟,王海云,等. TEAS足三里预处理对NSAIDs胃粘膜损伤的保护作用[J]. 浙江中医杂志,2013,48(6): 406-407.
[12] 中国科学技术协会,中国针灸学会. 2011-2012针灸学学科发展报告[M]. 北京: 中国科学技术出版社,2012: 115-122.
[13] 杨琼卉,马武华,黎玉辉. 针刺不同穴位辅助全麻在妇科腹腔镜手术中的作用比较[J]. 中国针灸,2012,32(1): 59-64.
[14] 陈雪,王保国,李锦. 经皮穴位电刺激对经蝶垂体瘤切除患者围术期静脉全麻的影响[J]. 中国针灸,2013,33(8): 732-736.
[15] 周凡. 颅脑损伤的继发性损伤因子和保护因子[J]. 中国医药导刊,2010,12(6): 1012-1013.
[16] KRESSE A,TACOBOWTIZ D M,SKOFITSCH G. Detailed mapping of CGRPmRNA expression in the rat central nervous system: comparison with previous in munocytochemical fndings[J]. Brain Res Bull,1995,36(3): 261-274.
[17] 王均炉,任秋生,沈财成,等. 经皮穴位电刺激对开颅术围术期脑损伤相关因子的影响[J]. 针刺研究,2008,33(1): 26-30.
[18] ISHIHARA K,HIRANO T. Molecular basis of the cell specifcity of cytokine action[J]. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research,2002,1592(3): 281-296.
[19] 梁冬冬,王宏法,张明晓,等. 百会穴局部腺苷A1受体对电针诱导脑缺血耐受的作用[J]. 中华医学杂志,2013,93 (7): 537-540.
[20] 潘柏申. 心脏标志物的临床应用[J]. 中华检验医学杂志,2004,28(1): 124-126.
[21] 聂立红. 谷胱甘肽硫-转移酶研究进展[J]. 中国病理生理杂志,2000,16(11): 1240-1243.
[22] 刘欣,王彤. 血清胱抑素C测定及临床意义[J]. 国际检验医学杂志,2010,31(5): 473-477.
(本文编辑:吴昔昔)
The protective effect of transcutaneous electrical stimulation on vital organ function in neurosurgery doing controlled hypotension
MO Yunchang,CHEN Linbi,Wang Xixi,PAN Yuanyuan,LUO Shan,HUANG Luping,WANG Junlu. Department of Anesthesiology,the First Affiliated Hospital of Wenzhou Medical University,Wenzhou,325015
Objective: To study the protective effect of transcutaneous electrical acupoint stimulation (TEAS) combined with controlled hypotension on brain,liver and kidney in neurosurgery. Methods: Fifty elective surgery patients with brain tumor were randomly divided into control group and treatment group,each was 25 cases. The treatment group (TEAS group) with TEAS plus controlled hypotension,stimulation frenquecy was 2/ 100 Hz,density wave,the intensity of 8-12 mA,electrical stimulation of bilateral Hegu,Sanyinjiao,Qu Chi and Zusanli,and reduced the mean arterial pressure (MAP) to the target and maintained 40-50 minutes. In the control group (Sham group): only electrodes attached to the same points,no stimulation,as other treatments with the TEAS group. Then we extracted internal jugular vein in these time points,including 5 minutes before lowering blood pressure (T1),to maintain blood pressure 60 minutes (T2),after elevated blood pressure 60 minutes (T3),24 hours and 48 hours after surgery (T4 and T5),detected cerebral protection factor and damage factor: SOD,CGRP,ET,MDA,IL-6 and S100β protein; the function indicators of heart: LDH,cTnI,MYO,CK and CK-MB;indexes of liver function: prealbumin,glutathione,ALT,AST,ALP,γ-transglutaminase; renal function parameters:Cystatin C,BUN,Cr,uric acid. Results: ①The cerebral protection factor and damage factor: Compared with T1,the level of SOD decreased obviously in the patients of control group at T2,T3 and T5 time points (P<0.05),however the level of CGRP,ET,MDA,IL-6 increased in T3,T4 and T5 (P<0.05). Compared with the control group,the TEAS group respectively reduced IL-6 and S100β in T2,reducing the level of ET in T3,increasing the SOD in T4,and lowering the MDA in T5 (P<0.05). ②The function indicators of cardiac: there was no difference between these two groups in the function indicators of cardiac (P>0.05). ③The indexes of renal function:the level of cystatin C of sham group was signifcantly higher in the T2 and T3 compared with the T1 time point (P<0.05). Compared with the control group,the treatment group could reduce the level of cystatin C in the T2 and T3 (P<0.05). ④The indicators of liver function: compared with T1,the level of AST,ALT and α-GST respectively increased in the T2,T3,T4 and T5 (P<0.05),while the prealbumin level signifcantly decreased in two points,including T2 and T3 (P<0.05). The patients of TEAS group was observed the level of α-GST could be reduced in T2 and T3 and the level of AST and ALT also reduced in the T4 and T5 in these two points (P<0.05). Conclusion:The neurosurgery combines with controlled hypotension can cause a certain impact on the function of brain,liver and renal. However the transcutaneous electrical acupoint stimulation (TEAS) can play a role in organ protection.
transcutaneous electrical acupoint stimulation; neurosurgical procedures; controlled hypotension;organ protection
R246.2
A DOI: 10.3969/j.issn.2095-9400.2016.08.001
2015-12-22
国家重点基础研究发展计划项目(2007CB51206);国家自然科学基金资助项目(8127926,81573742)。
莫云长(1983-),男,浙江温州人,主治医师,在职博士生。
王均炉,教授,主任医师,Email:wangjunlu973@163.com。

