基于金-银纳米异质二聚体的双酚A的表面增强拉曼光谱检测方法
严文静, 章建浩, 杨龙平, 王永丽
(国家肉品质量与安全控制工程技术研究中心,南京农业大学食品科技学院,江苏南京210095)
双酚A(Bisphenol A,BPA)是塑料制备过程中的一种重要原料,广泛存在于奶瓶、水瓶、牙套、保鲜膜等日常生活用品中。由于BPA在自然环境中很难降解,所以很容易通过食物链富集或食品包装材料迁移到食品中,进而对人体健康造成严重危害[1]。因此,研究和建立BPA快速检测方法,对于保障人类健康和食品安全具有十分重要的意义。传统的BPA检测多采用气相色谱和气-质联用法、液相色谱和液-质联用法等[2]。这些检测方法前处理过程繁琐、设备昂贵,不适应食品安全检测快速、方便、低成本、低污染、高通量检测的要求[3]。近年来,针对BPA国内外许多研究小组开展了这类物质的检测技术研究,并开发了一些新型快速检测方法,如酶联免疫法[4]、荧光分析法[5]、电化学分析法[6]等。这些分析方法虽然能弥补上述方法的一些不足,但在实际检测应用中常常受复杂样品基质干扰,重复性较差[7]。由此,开发一种快速、稳定、高灵敏的BPA检测方法是目前迫切需要解决的问题。
表面增强拉曼光谱(Surface Enhanced Raman Spectroscopy,SERS)是利用纳米材料表面等离子共振对吸附于金属表面分子的拉曼信号进行增强的现象,增强因子最高可达108~1014倍,具有单分子检测的潜能[8,9]。SERS的优势还表现在不需要对样品进行任何的前处理或提取分离,便可以通过分子特有的指纹图谱,对复杂混合体系中的特定微量成分进行直接检测[10],特别适用于复杂食品基质中的有毒有害物检测[11]。基于此性质,SERS技术目前已经被广泛用于环境监测、食品安全、生物大分子检测、疾病诊断、基因分析等领域[12,13]。
本文基于两种不同尺寸的金、银纳米颗粒,结合DNA自组装技术,制备了高产率、高SERS活性的金-银纳米异质二聚体,利用BPA与核酸适配体的特异性识别作用,建立了一种基于金-银纳米异质二聚体的SERS传感检测体系,实现了BPA的快速、稳定、高灵敏定量检测。
1 实验部分
1.1 仪器与试剂
JEM-2100HR透射电子显微镜(日本,电子株式会社);UV-1800紫外分光光度计(日本,岛津公司);HR-800显微激光共聚焦拉曼光谱仪(法国,HORIBA Jobin Yvon公司);Nano ZS纳米粒径分析仪(英国,马尔文公司);Allegra 64R型高速冷冻离心机(美国,Beckman公司)。
HAuCl4(99%)、柠檬酸三钠、AgNO3、抗坏血酸、NaBH4、聚乙烯吡咯烷酮(PVP)、4-氨基苯硫酚(4-ATP)、双酚A、双酚C、双酚酸、己烯雌酚,均购于Sigma试剂公司。其他试剂均为分析纯,购于国药集团化学试剂有限公司。实验用水为超纯水。
实验中所有单链核酸序列均来自上海生工生物技术有限公司。BPA核酸适配体序列(DNA1):5′-SH-(T)6-CCGGT GGGTG GTCAGGTGGG ATAGC GTTCC GCGTA TGGCC CAGCGCATCA CGGGT TCGCA CCA-3′;其互补序列(DNA2):5′-SH-(T)6-CCCAC CTGAC CACCC ACCGG -3′。
1.2 实验方法
1.2.1纳米颗粒的制备参见文献方法[14]制备金、银纳米颗粒。(1)金纳米颗粒的制备:100 mL 0.01%的HAuCl4溶液,匀速搅拌、加热沸腾持续7~8 min后,快速加入1.6 mL 1%柠檬酸三钠溶液,继续搅拌加热,待溶液从无色变为红色并不再发生变化,停止加热并继续搅拌30 min。(2)银纳米颗粒的制备:取100 mL洁净的锥形瓶置于冰浴中,依次加入40 mL超纯水,1.2 mL 0.01 mol/L NaBH4溶液和10 mL 1%的聚乙烯吡咯烷酮溶液。搅拌下,逐滴向瓶中加入10 mL 1%的聚乙烯吡咯烷酮溶液和10 mL 0.1%的AgNO3溶液,溶液从无色逐渐变为黄色。将反应物置于温度80 ℃反应3 h,最后溶液变为亮黄色。制备的金、银纳米颗粒溶液放入4 ℃冰箱备用。
采用透射电子显微镜,紫外吸收光谱仪及动态光散射仪对制备的金、银纳米颗粒的形貌、粒径、分散度等进行表征。
1.2.2纳米颗粒表面定向修饰DNA人工合成巯基修饰DNA序列用1倍TE缓冲液稀释到5 μmol/L浓度,存放在-20 ℃冰箱备用。制备的金、银纳米颗粒,各取1 mL 25 nmol/L于2个不同离心管中,分别向2个管中加入20 μL 5 μmol/L人工合成的DNA溶液,混合均匀后,分别向2管中加入25 μL 1 mol/L的Tris-HCl缓冲液和10 μL 5 mol/L的NaCl溶液,室温反应12 h后,13 000 r/min离心10 min,去除上清液,加20 mmol/L Tris-HCl恢复到原体积。DNA通过末端的巯基与金、银纳米颗粒形成Au-S或Ag-S 键偶联在纳米颗粒表面。利用琼脂糖凝胶电泳对纳米颗粒偶联DNA后的特性进行表征,胶的浓度为1.5%,电压80 kV,电泳时间100 min。
实验中采用密度梯度离心法将未偶联DNA的纳米颗粒从体系中分离。参考文献方法[14],具体步骤如下:取1.5 mL 15%的Ficoll 400加入到5 mL离心管中,再将1.5 mL 60%的Ficoll 400轻轻加到底层,取500 μL纳米颗粒-DNA溶液加入到离心管的最上层,5 000 r/min离心30 min。由于金-DNA比单个金纳米颗粒的体积大,离心后溶液分为两层,上层为金-DNA,下层为金纳米颗粒。取上层溶液,加入超纯水离心,沉淀物用超纯水分散,再离心重复3~4次,最后得到金-DNA复合物。
1.2.3金-银纳米异质二聚体的制备取制备的两种纳米颗粒-DNA复合物各1 mL混合于5 mL离心管中,随后加入20 μL 5 mol/L NaCl溶液,混合均匀,90 ℃水浴5 min后在水蒸汽中缓慢降到室温,实现金-银纳米异质二聚体的制备。采用密度梯度离心分离法对组装体进行纯化分离,方法参考1.2.2节。利用透射电子显微镜和动态光散射对异质二聚体的结构和尺寸进行表征。
1.2.4异质二聚体修饰SERS活性测定及优化分别取制备好的金纳米颗粒、银纳米颗粒及金-银纳米异质二聚体200 μL于3个不同的离心管中,向3个管中加入2 μL 100 μmol/L的4-ATP溶液,室温反应8 h后,13 000 r/min离心10 min,除去上清液,加入20 mmol/L Tris-HCl缓冲液恢复到原体积,分别测量SERS。测定的激发波长为514 nm,扫描时间为10 s。
拉曼活性分子的浓度对于金-银异质二聚体的SERS信号强度和体系的分散性有很大的影响,本实验对4-ATP的浓度进行了优化。分别取200 μL制备好的异质二聚体于4个不同的管中,每管加入不同量的4-ATP,使得体系中4-ATP的最终浓度分别为0.5、1.0、2.0和5.0 μmol/L,反应结束后,通过比较溶液SERS信号强度,确定4-ATP的最佳浓度。采用514 nm、633 nm和785 nm三种不同波长的激发光对组装体SERS信号进行测定,确定合适的激发波长。
1.2.5SERS传感检测体系的建立及优化向制备的金-银纳米异质二聚体中,加入一定浓度的BPA溶液,室温分别反应0、10、20、30、40、50和60 min,测定体系不同反应时间的SERS信号强度,从而确定合适的反应时间。
1.2.6BPA的传感检测按照上述优化的条件,制备得到高产率、高分散性且具有强SERS信号的金-银纳米异质二聚体,分别取200 μL于7个不同的离心管中,每个管中加入5 μL不同浓度的BPA溶液,使得BPA的最终浓度分别为0、0.05、0.1、0.5、1.0、5.0和10.0 μg/L,反应一定时间后,取100 μL反应液加入到微量石英比色皿中,进行SERS测定。测定的激发波长为514 nm,扫描时间为10 s。
2 结果与讨论
2.1 基于金-银纳米异质二聚体结构检测BPA的原理
分别制备两种尺寸不同的金(25 nm)、银(10 nm)纳米颗粒,将含有BPA核酸适配体的序列(DNA1)通过末端巯基修饰在金纳米颗粒表面,其互补序列(DNA2)通过末端巯基修饰在银纳米颗粒表面,通过调整DNA与纳米颗粒的摩尔比,制备得高产率金-银纳米异质二聚体结构。拉曼活性分子4-ATP通过巯基定向修饰在二聚体的表面,利用异质二聚体中两个粒子之间形成的强烈的电磁场增强,对修饰在表面的4-ATP的拉曼信号进行增强,从而使组装体表现出强烈的SERS信号。当体系中存在BPA时,会与其对应的核酸适配体竞争性结合,使得金-银异质二聚体解离,组装体SERS信号减弱。利用目标物浓度变化与SERS信号的规律性变化关系,建立标准曲线,从而实现对BPA的快速检测。原理如图1所示。

图1 基于金-银纳米异质二聚体结构检测BPA的原理Fig.1 Schematics of detection of BPA based on self-assembled Au-Ag hetero-dimer nanostructures
2.2 纳米颗粒的表征
图2a、2b分别为金、银纳米颗粒的透射电镜(TEM)图,图中显示金纳米颗粒的尺寸为25±3 nm,银纳米颗粒的尺寸为10±2 nm,这与动态光散射谱的测量结果显示基本吻合(图2d)。另外,从图2d可以看出,金、银的峰形对称,峰宽较窄,并且当粒径大于50 nm时没有明显的峰,说明制备的纳米颗粒分散性好,体系中没有明显的聚集体产生。Zeta电位结果显示(图2e),金、银纳米颗粒的电位分别为-21.9 mV和-2.1 mV,这主要与纳米颗粒表面修饰的配体有关。紫外-可见吸收光谱分别在522 nm和400 nm波长处有明显的吸收峰,对应于金、银纳米颗粒的等离子体共振吸收峰(图2c),峰尖且对称,说明制备的金、银纳米颗粒形貌均一。

图2 金、银纳米颗粒透射电镜(TEM)图(a、b),紫外-可见吸收光谱图(c),粒径分布图(d)和Zeta电位图(e)Fig.2 TEM images of Au and Ag NPs (a,b),UV-Vis spectra (c),Dynamic light scattering size distributions (d) and Zeta potential (e)
2.3 纳米颗粒表面定向修饰DNA表征

图3 Au-DNA和Ag-DNA复合物的琼脂糖凝胶电泳图Fig.3 Agarose gel images of Au-DNA and Ag-DNA complex
将人工合成的单链寡核苷酸序列,通过末端修饰的巯基定向偶联在金、银纳米颗粒的表面,为了防止纳米颗粒因表面DNA杂交产生大片的聚集体,体系中加入的纳米颗粒与DNA的摩尔比为1∶5。实验中采用琼脂糖凝胶电泳对纳米颗粒偶联DNA的结果进行表征[14]。如图3所示,电泳方向从上到下,从负极到正极。柠檬酸三钠制备的金纳米颗粒带负电荷,当表面偶联DNA之后,由于DNA的空间阻力,使得偶联DNA之后的金纳米颗粒相比于没有偶联DNA的金纳米颗粒,电泳迁移率较小,条带位置靠后,如图3(条带1和条带2)。以PVP为保护剂制备的银纳米颗粒不带电荷,当表面偶联DNA后,银-DNA复合物表面的负电荷增加,电泳迁移率增大,条带位置靠前,如图3(条带3和条带4)。由于金和银纳米颗粒表面电荷的差异,银纳米颗粒的电泳条带比金纳米颗粒的条带靠后[15]。根据文献报道的方法[16],对纳米颗粒表面DNA的数量进行了估算,金、银纳米颗粒表面的DNA数量分别为0.9±0.2和1.2±0.5,有效避免了纳米多聚体的形成。
2.4 金-银纳米异质二聚体的制备

图4 金-银纳米异质二聚体结构透射电镜(TEM)图Fig.4 TEM images of Au-Ag hetero-dimer structures
金-银纳米异质二聚体的组装依赖于两条单链DNA的互补杂交,水浴90 ℃ 5 min是为了使折叠的单链DNA完全展开,有利于双链杂交。在缓慢降温的过程中,两条单链DNA按照碱基互补配对原则进行杂交,从而制备得到金-银纳米异质二聚体。从图4显示可以看出:金、银纳米颗粒组装有序,组装体分布均一,没有出现大片的聚集体。
从图2中可以看出,金-银异质二聚体分别在520 nm 和409 nm有两个特征峰,分别对应组装体中金颗粒和银颗粒的特征峰,由此也表明异质二聚体组装是成功的。实验中采用动态光散射对组装体的尺寸分布进行了测定,从图5可以看出:当单个纳米颗粒定向组装成二聚体后,体系的尺寸变大,直径约为43±3 nm,根据金、银纳米颗粒的尺寸计算得出二聚体中两个纳米颗粒之间的距离为8±4 nm,符合实验设计。另外,由图5可知,当粒径大于150 nm时,光谱中没有明显的信号,说明体系中没有大片的聚集体产生,有效避免了因聚集体产生的强SERS信号对检测体系的干扰。
2.5 金-银异质二聚体SERS活性测定及优化
实验中采用4-ATP分别对金纳米颗粒、银纳米颗粒及金-银纳米异质二聚体进行修饰,4-ATP的浓度均为1 μmol/L。从图6可以看出,同样浓度下金-银异质二聚体的SERS信号最强,约为金和银纳米颗粒SERS信号的6倍。其原因在于,当两个分散的纳米颗粒距离十分接近的时候,在两个纳米颗粒之间会形成强烈的电磁场增强区域,即“热点”区域,使得存在于该区域的拉曼活性分子的拉曼信号会被极大地增强[17]。图中分别在388、1 078和1 617 cm-1有三个明显的峰,对应于4-ATP的拉曼特征峰。
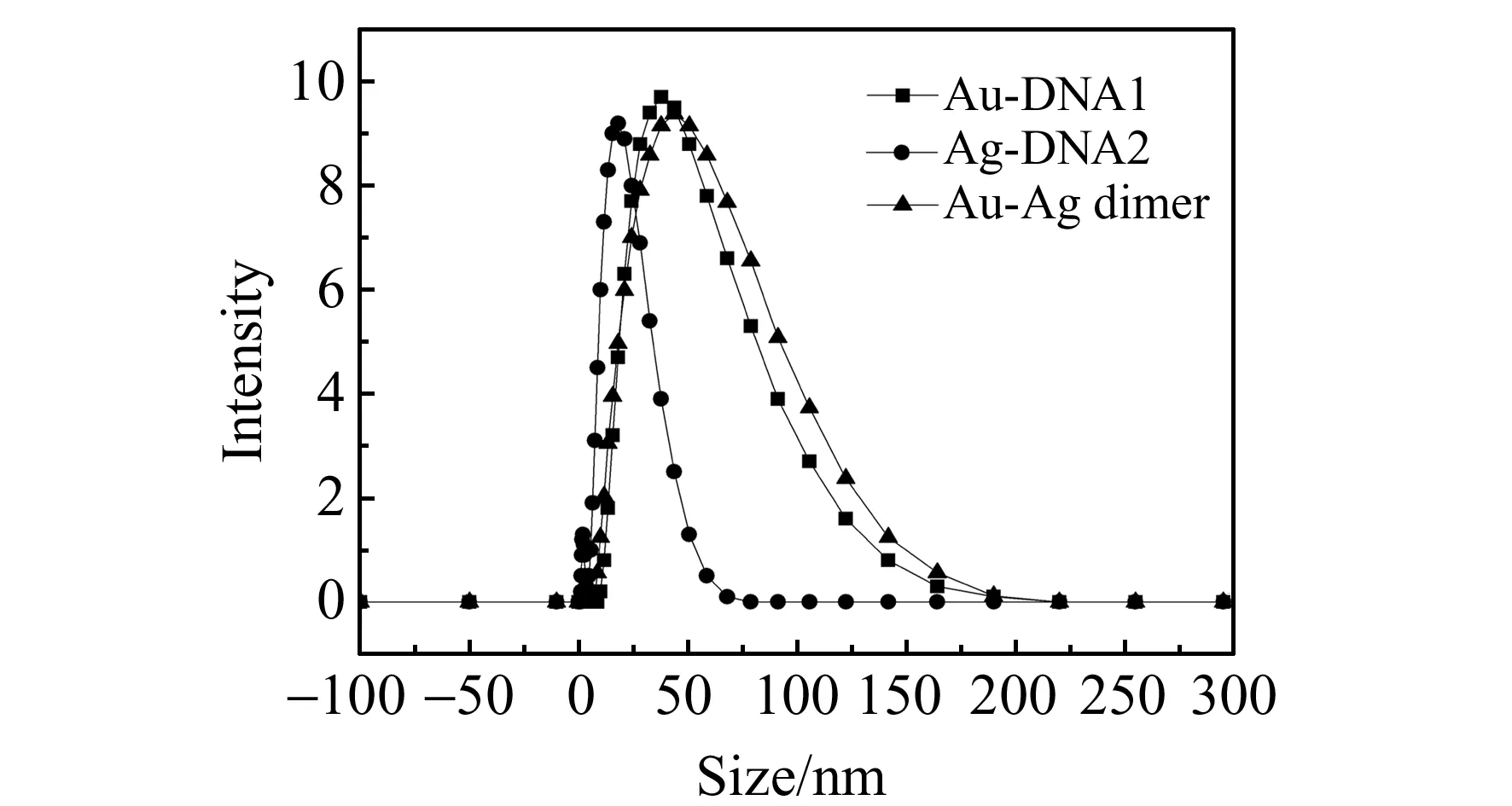
图5 金-银纳米异质二聚体结构水合粒径图Fig.5 Hydrodynamic diameters of Au-Ag hetero-dimer structures

图6 金-银异质二聚体的SERS图Fig.6 SERS spectra of Au-Ag hetero-dimer structures
为了研究不同浓度4-ATP对于体系SERS信号强度的影响,实验中对拉曼活性分子的浓度进行了优化。如图7a所示,随着4-ATP浓度的增加,体系SERS信号逐渐增加,4-ATP浓度为2 μmol/L时,SERS信号最强;当浓度高于2 μmol/L时,体系的SERS信号减弱。其原因可能是,过多的4-ATP引起纳米组装体聚集,从而使得SERS信号减弱[18],由此确定4-ATP的最佳浓度为2 μmol/L。另外,本实验研究了514、633和785 nm三种激发波长对组装体SERS信号强度的影响,从图7b可以看出,采用514 nm时得到的SERS强度最高,其原因可能是514 nm比较接近金和银的吸收峰,激发光能够引起金、银纳米颗粒表面等离子体共振,从而使得SERS信号大大增强[19]。
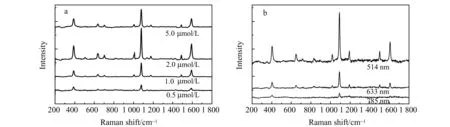
图7 异质二聚体修饰不同浓度4-ATP的SERS图谱(a);异质二聚体不同激发光源的SERS图谱(b)Fig.7 SERS spectra of Au-Ag hetero-dimers with different concentrations of 4-ATP(a);SERS spectra with different excitation source(b)

图8 异质二聚体与BPA反应时间对SERS信号强度的影响Fig.8 Effect of reaction time of hetero-dimers and BPA on the SERS signal intensity
2.6 SERS传感检测体系的建立及优化
向制备好的高SERS活性的金-银纳米异质二聚体中加入一定量的BPA,研究金-银纳米异质二聚体与BPA反应时间对体系SERS信号强度的影响,以确定检测体系的最佳反应时间。实验以1 078 cm-1处的特征峰强度为对象,建立时间-SERS信号强度的关系曲线。如图8所示,当体系中不存在BPA时,随着时间的延长体系的SERS信号基本不变;当体系中加入5 μg/L的BPA后,随着时间的延长体系的SERS信号快速下降,反应30 min后基本保持不变。由此确定BPA与检测体系的最佳反应时间为30 min。
2.7 BPA的传感检测
基于上述制备好的金-银纳米异质二聚体,进行了不同浓度BPA的快速检测。检测体系中BPA的终浓度分别为0、0.05、0.1、0.5、1.0、5.0和10.0 μg/L。反应30 min后,测量SERS信号强度。如图9所示,随BPA浓度增加体系的SERS信号逐渐减弱,以1 078 cm-1处特征峰为目标建立标准曲线。从图10可见,BPA浓度在0.05~10 μg/L呈现出良好的线性关系,线性回归方程为:y=-157.9lnx+730.4(R2=0.9904),检测限为0.038 μg/L。
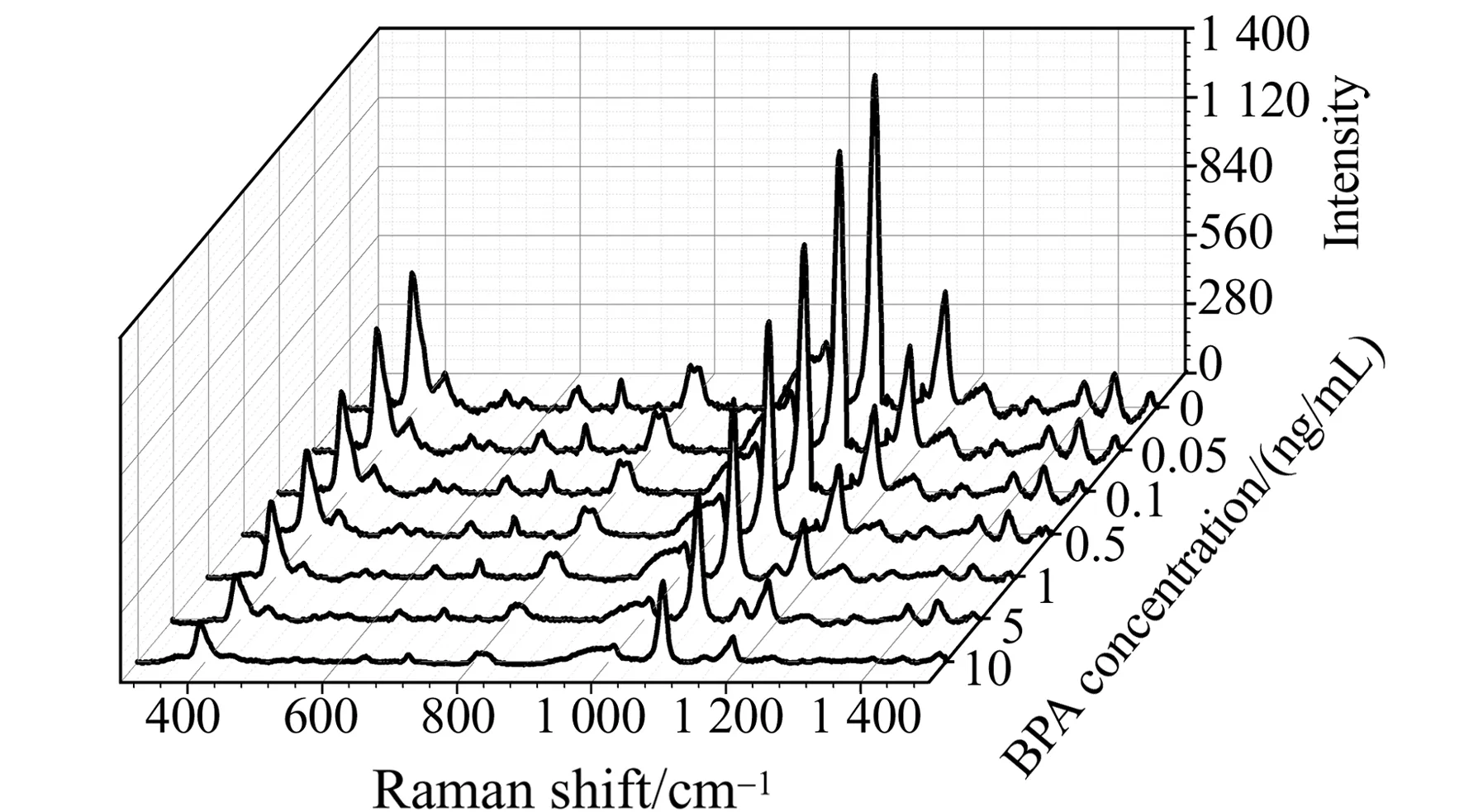
图9 不同浓度BPA的SERS光谱图Fig.9 SERS spectra under different concentrations of BPA
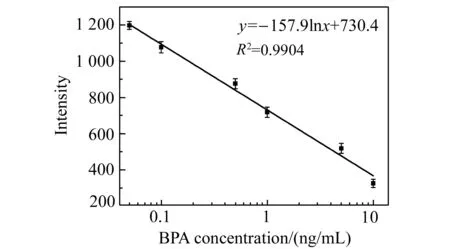
图10 BPA检测标准曲线图Fig.10 Standard curve of the determination of target BPA

图11 检测体系特异性分析图Fig.11 Selectivity of the hetero-dimers detecting system towards BPA,BPC,DPA and DEC
2.8 检测方法特异性分析
为了验证该检测方法的特异性,配制浓度为5 μg/L的双酚A(BPA)、双酚C(BPC)、双酚酸(DPA)、己烯雌酚(DEC)溶液,按照本实验构建的检测方法,按步骤加入到检测体系中,通过测定1 078 cm-1处拉曼特征峰的强度进行比较。结果如图11所示,除了BPA外,其他物质均不会引起体系SERS信号变化,证明本检测方法具有良好的特异性。
2.9 实际样品的加入回收实验
考察了该检测方法对实际牛奶样品中BPA的响应,结果如表1所示,当样品加入BPA的最终浓度为0.1、0.5、1.0、5.0 μg/L时,得到的回收率在89.8%~108.0%之间,说明本方法BPA检测方法准确性高,可以应用于实际样品中BPA的检测。

表1 牛奶样品中添加BPA的检测回收率
3 结论
本实验基于金、银纳米颗粒及DNA模板自组装技术,构建了一种具有高SERS活性的金-银纳米异质二聚体结构,并成功用于BPA的快速、高灵敏的定量分析。在最优条件下,BPA浓度在0.05~10 μg/L之间具有良好的线性(R2=0.9904),检测限为0.038 μg/L。与传统方法相比,本方法具有快速、高灵敏、高特异性、操作简单、成本低廉等优点,并且能在30 min内实现检测。利用该方法可以对实际样品进行定量检测,具有较好的应用价值。

