正丙醇-氯化钠-4-(2-吡啶偶氮)-间苯二酚双水相萃取光度法测定工业废水中的Zn2+
孙赛兰, 盛小娅, 祖力甫哈尔·亚科甫, 黎春兰, 何 叶, 覃事栋*
(吉首大学化学化工学院,湖南吉首 416000)
锌是人体必需的微量元素之一,当人体缺乏锌时会引起疾病,但当人体摄入过量锌时会引起锌中毒,造成呕吐、肠功能失调和腹泻[1]。近年来,随着现代工业的发展,工业废水的排放量也日益增加[2]。这些大量工业废水的排放也影响着我国环境和居民的身体健康,工业废水中锌污染来源主要是锌矿开采及冶炼、锌合金、颜料、油漆等的生产废水[3]。有机溶剂沉淀法等传统分析方法普遍存在萃取效率较低、操作步骤繁琐[4]。基于本实验小组前期的研究[5 - 9],建立了正丙醇-NaCl-4-(2-吡啶偶氮)-间苯二酚(PAR)双水相萃取体系,并用该体系萃取Zn2+与PAR形成的配合物。该方法有萃取过程温和、简单、毒害小、操作方便等优势,其测定结果与原子吸收法一致。
1 实验部分
1.1 仪器与试剂
UV-2450型紫外-可见分光光度计,AA-6300C型原子吸收分光光度计(日本,岛津公司);iCAP6300 Radial电感耦合等离子体发射光谱仪(美国,Thermo Fisher Scientific)。
Zn2+标准溶液(1 mg·mL-1):准确称取1.0000 g高纯锌粒,加适量HNO3,加热溶解并容至1 000 mL;PAR溶液:准确称取0.0502 g PAR,溶于1 mL 1% NaOH溶液中,用蒸馏水定容于50 mL容量瓶中;掩蔽剂:20 mg·mL-1硫代硫酸钠、20 mg·mL-1氟化钠、20 mg·mL-1酒石酸钾钠;缓冲溶液:pH=3~6的HAc-NaAc缓冲溶液,pH=7~9的Na2B4O7-HCl缓冲溶液,pH=10~13的Na2B4O7-NaOH缓冲溶液。实验所用试剂均为分析纯,实验用水为二次蒸馏水。
1.2 实验方法
于25 mL比色管中依次加入1 μg·mL-1Zn2+标准溶液1.0 mL,一定量的Na2B4O7-HCl缓冲溶液(pH=8.0),加入PAR溶液0.6 mL,反应10~12 min后,加入正丙醇3.0 mL,用水定容至10 mL刻度线处,加入2.0 g NaCl,震荡、静置完全分层后,移取正丙醇相或者水相于1 cm比色皿中,用紫外-可见分光光度计测定Zn2+与PAR配合物的吸光度。
2 结果与讨论
2.1 配合物的吸收光谱

图1 紫外可见吸收光谱Fig.1 UV-Vis absorption spectra of the PAR and Zn2+-PAR 1.PAR;2.Zn2+-PAR.
Zn2+-PAR配合物的紫外-可见吸收光谱图如图1。根据图1可知,在正丙醇相中,Zn2+与PAR配合物最大吸收波长为493 nm,相对于试剂空白红移了88 nm。此时PAR结构中的-C=N-发生π-π*跃迁,-C=N-上的N原子与Zn2+发生配位导致共轭效应变强,分子轨道的能量差降低使得吸收能量降低,故较低波长产生红移现象。
2.2 分相条件的选择
2.2.1盐的选择向10%~50%不同百分含量的正丙醇溶液中,分别加入不同量的NaCl、NH4Cl、Na2CO3、NaNO3、K2HPO4、Na2HPO4、KH2PO4、NaH2PO4,结果表明除K2HPO4、Na2HPO4、KH2PO4、NaH2PO4外其它盐均能使正丙醇与水分相,且分相能力由强变弱的顺序依次为:Na2CO3>NaCl>NH4Cl>NaNO3。这是由于所加入的盐与水发生水化作用,减弱了水与异丙醇的结合力,并最终将有机相排斥出水相的缘故[10]。当改变双水相体系中的正丙醇的百分含量时,分相所需的盐的用量也随之改变。结果如图2。

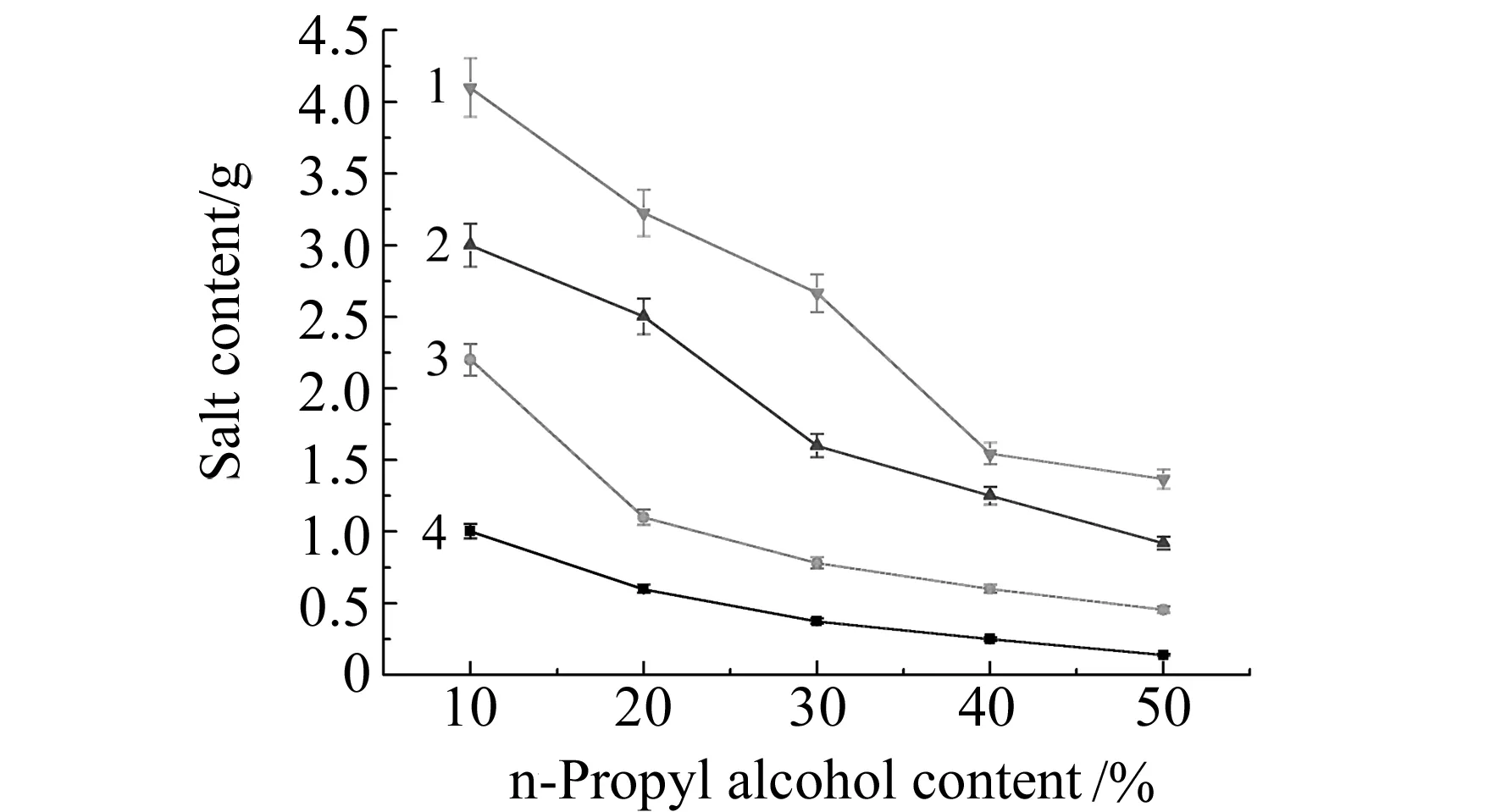
图2 盐的选择Fig.2 The effect of salt 1.NaNO3;2.NH4Cl;3.NaCl;4.Na2CO3.

图3 正丙醇-水-氯化钠三相图Fig.3 The choice of salt n-propanol-water-sodium chloride three -phase diagram
2.2.2缓冲溶液酸度的选择固定正丙醇、Zn2+、NaCl、PAR的用量,分别考察了pH=3.0~12.0的不同缓冲溶液对吸光度的影响。结果表明,当加入pH=8.0的缓冲溶液时,配合物的吸光度最高且维持不变。而在酸性较强条件下,正丙醇发生质子化失去配位能力,影响配合物的萃取结果。因此,综合考虑,选用pH=8.0的Na2B4O7-HCl缓冲溶液。
2.3 萃取条件的优化
2.3.1PAR用量的影响固定正丙醇的量为3.0 mL,Zn2+的量为1 μg等条件,分别试验了PAR的用量为0.2~0.9 mL时对吸光度的影响。结果表明,吸收峰波长没有随PAR的用量变化而发生变化,随着PAR用量的增加,吸光度增加,当加入PAR用量为0.6 mL后,吸光度变化趋于平缓。因此络合剂PAR用量选择为0.6 mL。
2.3.2NaCl用量的影响在PAR加入量为0.6 mL条件下,固定其他条件,试验了0.0~2.3 g NaCl用量的影响。结果表明,当加入NaCl少于0.78 g时,分相不清晰且分相速度慢;当加入NaCl在1.6~2.2 g之间时,分相速度较快且清晰;但当加入NaCl的量超过2.3 g时,盐不再溶解,水相开始浑浊,盐达到饱和并析出。综合考虑,选择NaCl的用量为2.0 g。
2.3.3缓冲溶液用量的影响固定其他条件,试验了pH=8.0的Na2B4O7-HCl缓冲溶液为0.2、0.4、0.6、0.8、1.0 mL对吸光度的影响。结果表明,正丙醇能和水相完全分相,当缓冲溶液用量为0.6~0.8 mL时,吸光度达到最大并趋于平稳;当加入1.0 mL缓冲溶液时,吸光度下降,体系中硼酸根含量增加影响配合物的稳定性。综合考虑选用0.6 mL的pH=8.0的Na2B4O7-HCl缓冲溶液作为介质。
2.3.4络合时间的影响以及稳定性当正丙醇、Zn2+标准溶液、pH=8.0缓冲溶液、PAR溶液用量、NaCl用量分别为3.0 mL、1.0 mL、0.6 mL、0.6 mL、2.0 g时,按实验方法考察了PAR与Zn2+的络合显色时间。结果表明,显色10 min后配合物的吸光度达到最大值,在10 min~2 h内基本保持不变,但时间超过2 h,随着时间的增长,吸光度急剧变小,配合物的稳定性也随之变弱。因此,选择络合显色时间为10 min。
2.3.5配合物的组成在本实验选定条件下,用摩尔比法和等摩尔连续变化法测定PAR-Zn的配合物组成为PAR∶Zn=2∶1。
2.4 标准曲线的绘制
在最优实验条件下按照实验方法对Zn2+的配合物进行测定,并绘制标准曲线。结果表明:Zn2+的浓度在0.05~0.25 μg·mL-1呈线性关系,其线性回归方程为:A=0.09974c+0.27482,相关系数为0.9989,表观摩尔吸光系数ε为2.26×104L·mol-1·cm-1。
2.5 共存离子的影响
在选定的条件下,向双水相体系中加入0.75 μg的Zn2+,在相对误差±5%以内时,试验多种常见的金属阳离子对本体系的影响。结果表明:10倍的Mg2+、Ca2+、Sn2+、V2+、Sr2+,100倍的Cr3+、Li2+,100倍的Na+、K+、Ba2+不影响体系中Zn2+的测定;等量的Al3+、Pb2+、Ni2+、Mn2+、Co2+没有影响;等量的Cd2+、Cu2+、 Fe3+对Zn2+的测定有干扰,可加入硫代硫酸钠-氟化钠-酒石酸钾钠混合掩蔽剂来掩蔽。进行混合掩蔽剂用量实验时,对硫代硫酸钠、氟化钠、酒石酸钾钠溶液进行1∶1∶1、1∶2∶1、1∶2∶2三种比例混合,结果表明:当使用硫代硫酸钠∶氟化钠∶酒石酸钾钠的比例为1∶2∶1时,吸光度最大且稳定,且使用混合掩蔽剂的量为1.5 mL。
2.6 样品分析
将在本地某锰矿企业采集的尾水静置一定时间后,过滤,取一定量滤液,调节其pH达到与实验中所用的Zn2+标准溶液一致。根据1.2节实验方法并加入1.5 mL混合掩蔽剂对水样中Zn2+配合物进行测定,并与原子吸收(FAAS)法测试结果进行对比,见表1。同时对水样进行加标回收试验,结果表2。

表1 样品分析结果(n=5)

表2 加标回收试验结果(n=5)
3 结论
本文研究了正丙醇-水-NaCl双水相体系,从分相条件和反应条件对Zn2+-PAR的影响,探讨了Zn2+与PAR络合、显色的最佳条件。在该条件下对工业废水中的Zn2+进行测定,方法具有萃取过程条件温和、环境友好、操作简单方便等优势,实际样品的测定结果与原子吸收法一致。

