姜黄素减弱Aβ25-35致大鼠原代小胶质细胞的神经炎症反应*
刘绪华, 王孝庆, 王中苏, 赵 航, 钱小伟, 曹 红, 李 军
(温州医科大学附属第二医院麻醉科,浙江 温州 325027)
姜黄素减弱Aβ25-35致大鼠原代小胶质细胞的神经炎症反应*
刘绪华, 王孝庆, 王中苏, 赵 航, 钱小伟, 曹 红, 李 军△
(温州医科大学附属第二医院麻醉科,浙江 温州 325027)
目的: 研究姜黄素(Cur)对β-淀粉样蛋白(Aβ)刺激下大鼠原代小胶质细胞活力及高迁移率族蛋白1(HMGB1)、白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)表达的影响。方法:取新生SD大鼠大脑皮层行混合胶质细胞原代培养,摇床振摇法分离小胶质细胞并行Iba-1免疫细胞化学鉴定。在培养的小胶质细胞中加入Aβ25-35作用24 h后,观察细胞形态并用CCK-8实验确定造模浓度及Cur的治疗浓度。将大鼠原代小胶质细胞分为5组:正常组、Aβ25-35模型组、Cur组、Aβ25-35+Cur治疗组、Aβ25-35+DMSO组;用Western blot法检测细胞内HMGB1、晚期糖基化终末产物受体(RAGE)、NF-κB的表达情况,取上清液用ELISA检测HMGB1、IL-1β、TNF-α的表达。结果:Iba-1的阳性率在95%以上,培养的大鼠原代小胶质细胞可用于实验。Western blot实验结果示Aβ25-35活化诱导后,细胞内的HMGB1、RAGE和NF-κB表达明显升高(P<0.05),加入姜黄素后细胞内的HMGB1、RAGE和NF-κB表达明显减少(P<0.05)。ELISA结果示Aβ25-35活化诱导后,细胞上清液中HMGB1、IL-1β、TNF-α明显升高(P<0.05),加入姜黄素后上清液中HMGB1、IL-1β、TNF-α明显下降(P<0.05)。结论:姜黄素可明显抑制Aβ25-35刺激下大鼠原代小胶质细胞的神经炎症反应。
阿尔茨海默病; 姜黄素; β-淀粉样蛋白; 小胶质细胞; 高迁移率族蛋白1
阿尔兹海默病(Alzheimer’s disease,AD)是一种常见进行性神经退行性疾病。目前认为β-淀粉样蛋白(amyloid-β,Aβ)沉积引发的神经炎症反应在AD过程中起核心作用,这一炎症过程由激活小胶质细胞(microglial,MG)诱导产生的炎性因子以及相关信号通路所驱动,最终导致突触和神经元的损害[1]。高迁移率族蛋白1(high mobility group box-1 protein,HMGB1)是存在于真核细胞核内的非组蛋白染色体结合蛋白,可直接促进炎症介质释放,调节炎症反应和组织损伤,因此HMGB1被认为是一些神经退行性疾病的危险因素[2-4]。姜黄素(curcumin,Cur)是从传统中药姜黄的根茎中提取出来的一种脂溶性酚类色素,具有抗炎、抗氧化、抗斑块、清除氧自由基、抗纤维化及防癌、抗癌等多种药理作用[5]。本研究采用大鼠原代培养小胶质细胞,用Aβ的活性片段Aβ25-35诱导活化大鼠原代培养小胶质细胞建立炎症模型,观察姜黄素对Aβ刺激下大鼠原代小胶质细胞活力、HMGB1、白细胞介素-1β(interleukin-1β,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)表达的影响,探讨姜黄素对AD作用的可能机制。
材 料 和 方 法
1 动物
SPF级SD大鼠,雌雄不限,1~3 d 龄,由温州医科大学实验动物中心提供,动物许可证编号为SCXK(浙)2010-0044。小胶质细胞由大鼠大脑皮层分离提取。
2 主要试剂
Aβ25-35、姜黄素购自Sigma;DMEM/F12培养基和胎牛血清购自Gibco;anti-Iba1 antibody购自Wako;CCK-8检测试剂购自Dojindo;晚期糖基化终末产物受体(receptor for advanced glycation end products,RAGE)抗体、HMGB1抗体、NF-κB抗体、Toll样受体4(Toll like receptor 4,TLR4)抗体购自Abcam;小鼠HMGB1、IL-1β和TNF-α ELISA检测试剂盒购自R&D;小鼠多克隆抗β-actin抗体购自Bioworld。
3 主要方法
3.1 大鼠原代小胶质细胞的培养和纯度鉴定 取新生1~3 d 的SD大鼠,消毒后沿头部纵轴打开颅腔分离出大脑皮质,置于胰蛋白酶中剪成细小碎块并消化5 min,加入等体积DMEM/F12培养基终止消化,吸管吹打分散成单细胞悬液并过滤。滤过液离心后吸去上清液,用上述DMEM/F12培养基重新悬浮细胞,以4×108/L细胞数接种于多聚赖氨酸包被的25 mL培养瓶中,置37 ℃、5% CO2及饱和湿度培养箱中培养,约9~10 d细胞长满瓶底后再次换液,次日置于37 ℃恒温摇床中以260 r/min振速摇动处理2 h,收集摇晃下来的细胞悬液并接种到25 mL培养瓶和放置于盖玻片的6孔板中,37 ℃、5% CO2及饱和湿度培养箱中培养1 h,弃去未贴壁细胞,获得的细胞即为纯化的小胶质细胞。将原代小胶质细胞接种于6孔板中,用Iba1多克隆抗体(1∶500)标记小胶质细胞,用DAPI染核在荧光显微镜下观察、采集图像。通过计数阳性细胞计算细胞纯度,随机抽取10张细胞盖片显微镜下观察和照相并随机抽取10个视野计数阳性细胞,用Iba1染成红色的为小胶质细胞(阳性细胞)。计算其与视野内总细胞(用DAPI染成蓝色)的比值,其平均值即为细胞纯度,阳性率大于95%以上即可用于实验。
3.2 CCK-8法测细胞活力 取大鼠原代小胶质细胞,经胰酶消化后,吹打成单细胞悬液,将各组细胞按5×107/L的密度接种于96孔板上。16~24 h后细胞单层铺满孔底,小心吸去孔内培养液,换液,各组加入不同梯度的药物浓度。孵育24 h后,每孔加入10 μL CCK-8溶液,在培养箱内孵育1 h,用酶标仪测定在450 nm处的吸光度。细胞活力(%)=(各处理组吸光度-空白组吸光度)/(对照组吸光度-空白组吸光度)。
3.3 实验分组 将大鼠原代培养小胶质细胞分为5组:正常组(normal cell组):不做任何处理; Aβ25-35模型组:40 μmol/L Aβ25-35刺激细胞24 h;Cur组:加入终浓度为10 μmol/ L 的Cur孵育(姜黄素被溶解于DMSO中)细胞24 h; Aβ25-35+Cur治疗组:同时加入10 μmol/L的姜黄素和40 μmol/L的Aβ25-35共同孵育细胞24 h; Aβ25-35+DMSO组:同时加入终浓度为10 μmol/L的Aβ25-35和0.2% DMSO共同孵育细胞24 h。
3.4 Western blot分析 细胞接种在6孔板中,分组方法同上。24 h后收获细胞,提取细胞总蛋白,经制胶、上样、电泳、转膜、封闭、孵育 I 抗、 II 抗后曝光,用Quantity One软件分析目的蛋白HMGB1、RAGE、TLR4、NF-κB、内参照蛋白β-actin的平均光密度值。
3.5 ELISA检测HMGB1、IL-1β、TNF-α在培养上清中的浓度 细胞接种在6孔板中,分组方法同上。24 h后提取上清液。按ELISA试剂盒说明书操作,测定上清液中HMGB1、IL-1β、TNF-α的浓度。用酶标仪测定标准品及样本吸光度值,根据标准品的浓度和吸光度绘制标准曲线,计算样本HMGB1、IL-1β、TNF-α浓度。
4 统计学处理
实验数据用均数±标准差(mean±SD)表示,应用SPSS 19.0及GraphPad Prism5统计学软件进行统计分析并作图。组间比较采用单因素方差分析(one-way ANOVA),方差齐则组内两两比较采用SNK-q检验,否则采用Tamhane’s T2检验,以P<0.05为差异有统计学意义。
结 果
1 大鼠原代小胶质细胞培养结果
1.1 倒置显微镜下观察细胞形态 混合细胞培养24 h后,细胞贴壁,可见透光性较好的小胶质细胞、星形胶质细胞、神经元细胞及部分红细胞。10 d左右细胞分层,上层为半贴壁,呈圆形,透光性较好,主要为小胶质细胞及少量的少突胶质细胞,下层细胞主要为星形胶质细胞、神经元。通过机械振摇法分离后的小胶质细胞形态基本不变。接种约1 h后,小胶质细胞贴壁。培养24 h后,小胶质细胞完全贴壁,形态不规则,多为蜘蛛状、梭形及椭圆形,见图1。

Figure 1.The morphological observation of the microglial cells after purification by mechanical shaking separation under inverted microscope.
图1 倒置显微镜正常小胶质细胞形态
1.2 小胶质细胞的纯度鉴定 Iba-1是小胶质细胞、巨噬细胞表面的特异性抗原,且不会与神经元、星形胶质细胞发生交叉反应。小胶质细胞Iba-1免疫荧光术鉴定显示小胶质细胞阳性率达95%以上,见图2。
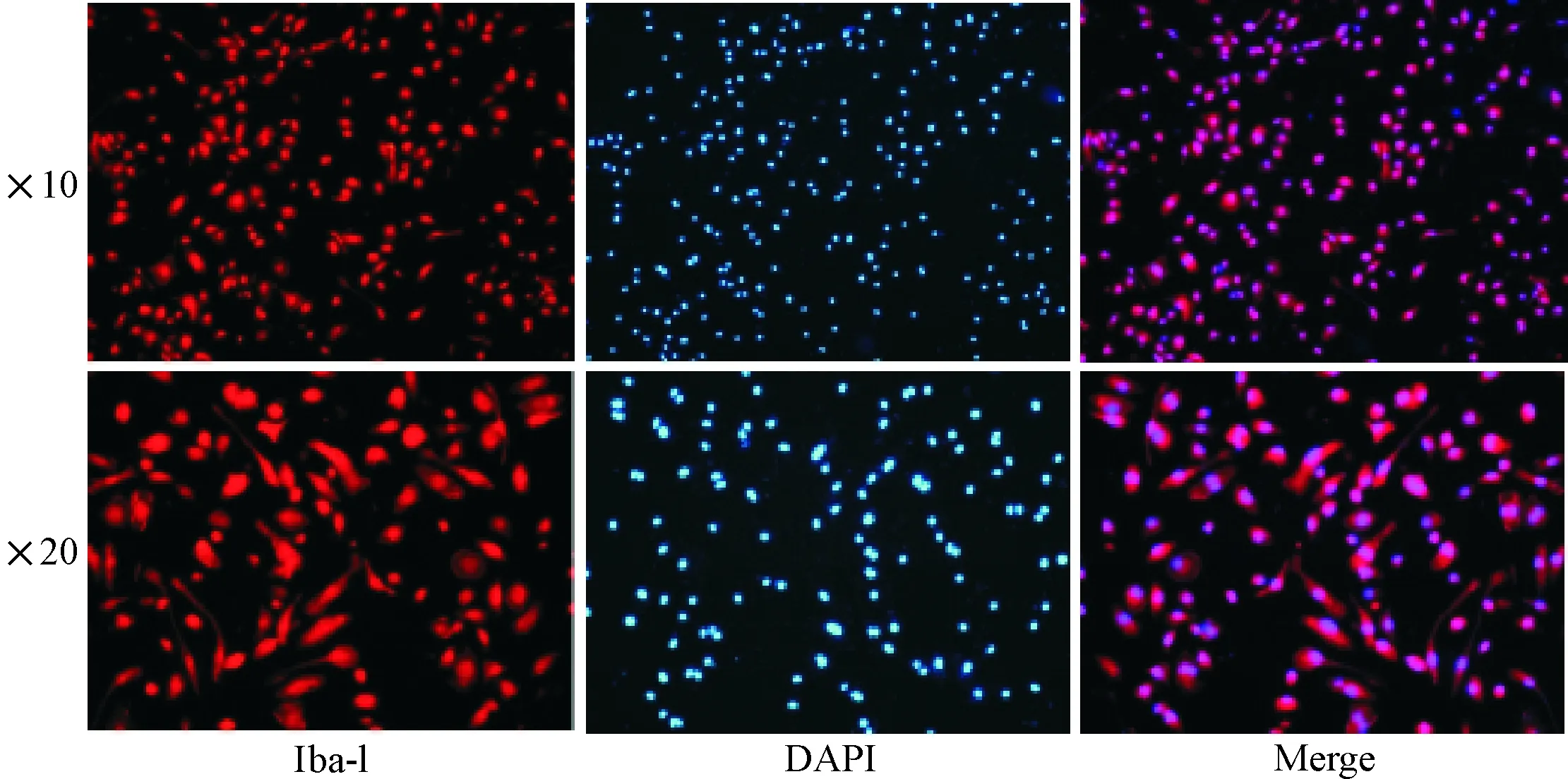
Figure 2.The specific marker Iba-1 expression of microglia by immunofluorescence staining.
图2 小胶质细胞中特异性标志物Iba-1的表达
2 造模浓度、时间和治疗浓度的确定
2.1 Aβ25-35对大鼠原代小胶质细胞存活率的影响 在细胞培养基中加入不同浓度的Aβ25-35(5、10、20、40、80 μmol/L),细胞活力明显下降,且呈时间与剂量依赖性(P<0.05),见表1。如图3所示,小胶质细胞诱导后6 h细胞活力开始下降,约24 h 下降达高峰值,此后为一平台,细胞活力变化不大。故选择造模时间为24 h,通过计算得到其半抑制浓度(IC50)为63.17 μmol/ L,为此选择Aβ25-35的造模浓度为40 μmol/ L。
2.2 姜黄素对大鼠原代小胶质细胞存活率的影响 观察不同浓度姜黄素(1.25、2.5、5、10、20 μmol/L)
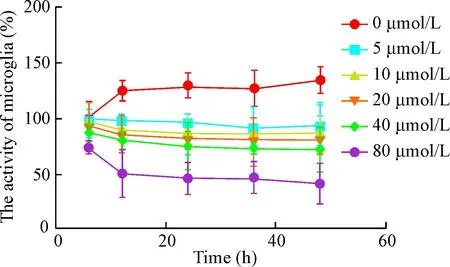
Figure 3.The effect of Aβ25-35at different concentrations on the activity of microglia at different time points. Mean±SD.n=16.
图3 Aβ25-35对小胶质细胞活力的影响
表1 不同浓度Aβ25-35作用不同时间对小胶质细胞活力的影响
Table 1.The effects of Aβ25-35on the viability of microglial cells at different concentrations and different time points (Mean±SD.n=16)
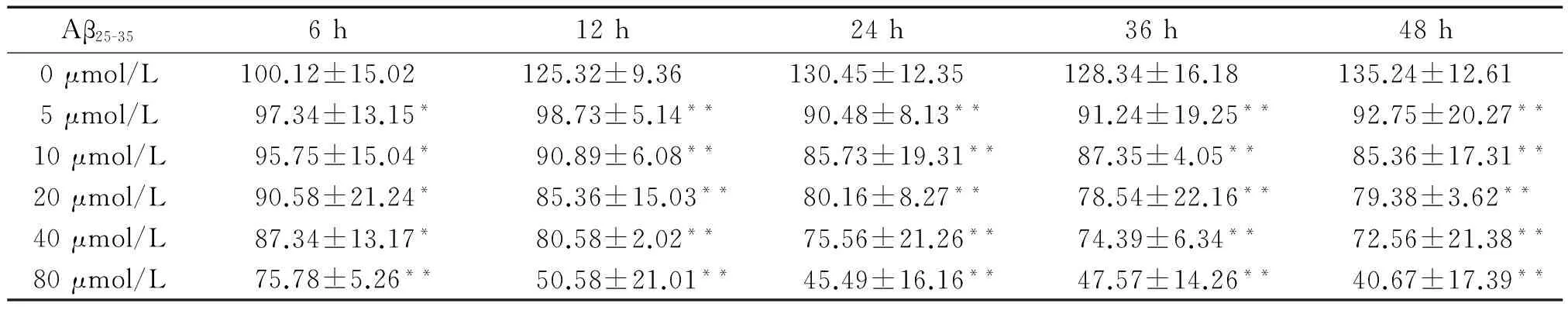
Aβ25-356h12h24h36h48h0μmol/L100.12±15.02125.32±9.36130.45±12.35128.34±16.18135.24±12.615μmol/L97.34±13.15*98.73±5.14**90.48±8.13**91.24±19.25**92.75±20.27**10μmol/L95.75±15.04*90.89±6.08**85.73±19.31**87.35±4.05**85.36±17.31**20μmol/L90.58±21.24*85.36±15.03**80.16±8.27**78.54±22.16**79.38±3.62**40μmol/L87.34±13.17*80.58±2.02**75.56±21.26**74.39±6.34**72.56±21.38**80μmol/L75.78±5.26**50.58±21.01**45.49±16.16**47.57±14.26**40.67±17.39**
*P<0.05,**P<0.01vs0 μmol/L group.
作用24 h后对小胶质细胞存活率的影响。如图4所示,20 μmol/L Cur对细胞的毒性明显强于阴性对照组和其它几组,抑制率可达51.7%。因此选择对小胶质细胞没有抑制作用的最高姜黄素浓度为10 μmol/ L,与空白对照组相比差异无统计学显著性。
3 倒置显微镜下各组小胶质细胞形态学改变
正常组小胶质细胞在孵育4 h左右即能贴壁,胞体较小,少量细胞有细小突起;Aβ25-35组和Aβ25-35+DMSO组贴壁速度明显慢于正常组,细胞出现聚集状态,胞体伸出一个或多个树枝状突起,连接周围细胞,突起粗大;Cur组和Aβ25-35+Cur组的细胞胞体肥大,核仁明显,细胞间以突触相连,见图5。
4 Aβ和姜黄素对大鼠小胶质细胞HMGB1表达的影响
与正常组相比,Aβ25-35活化诱导24 h后,HMGB1的表达明显升高(P<0.05),单纯姜黄素处理对HMGB1影响不明显。Aβ25-35+Cur组加入姜黄素共同孵育后,与Aβ25-35组相比,HMGB1明显下降(P<0.05),而DMSO与Aβ25-35(DMSO为姜黄素的溶剂)共同孵育后,HMGB1表达较Aβ25-35组差异无统计学显著性,见图6。
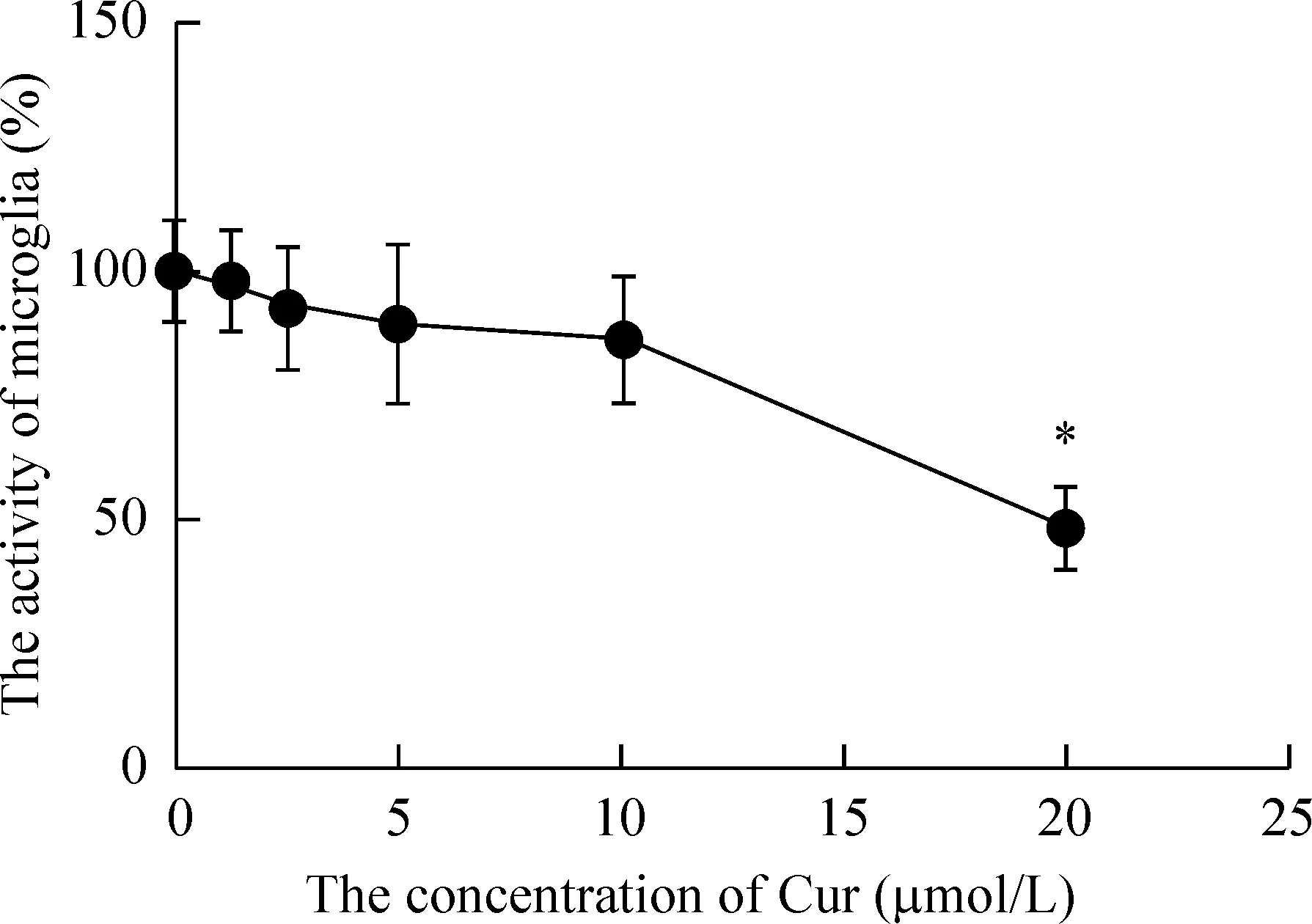
Figure 4.The effect of Cur at different concentrations on the activity of microglia cells. Mean±SD.n=15.*P<0.05vs0 μmol/L.
图4 Cur对小胶质细胞活力的影响
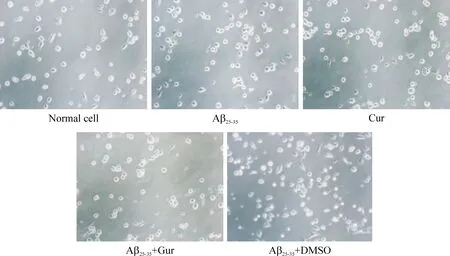
Figure 5.The morphological changes of the microglia under inverted microscope (×20).
图5 倒置显微镜下小胶质细胞的形态改变
5 Aβ和姜黄素对大鼠小胶质细胞RAGE、TLR4及NF-κB表达的影响
Aβ25-35活化诱导24 h后,RAGE、TLR4 and NF-κB的表达明显升高(P<0.01),单纯姜黄素处理对三者无明显影响,Aβ25-35和姜黄素共同孵育后,RAGE、TLR4和NF-κB均明显下降(P<0.05)。DMSO与Aβ25-35共同孵育后,RAGE、TLR4、NF-κB表达较Aβ25-35组差异无统计学显著性,见图6。
6 Aβ和姜黄素对大鼠小胶质细胞培养上清中HMGB1、IL-1β和TNF-α浓度的影响
与正常组相比,Aβ25-35活化诱导24 h后,上清液中的HMGB1、 IL-1β和TNF-α明显升高(P<0.01)。Aβ25-35与姜黄素共同孵育后,HMGB1、 IL-1β和TNF-α明显下降(P<0.01)。DMSO与Aβ25-35(DMSO为姜黄素的溶剂)共同孵育后,HMGB1、IL-1β和TNF-α较Aβ25-35单独处理组的差异无统计学显著性,见图7。
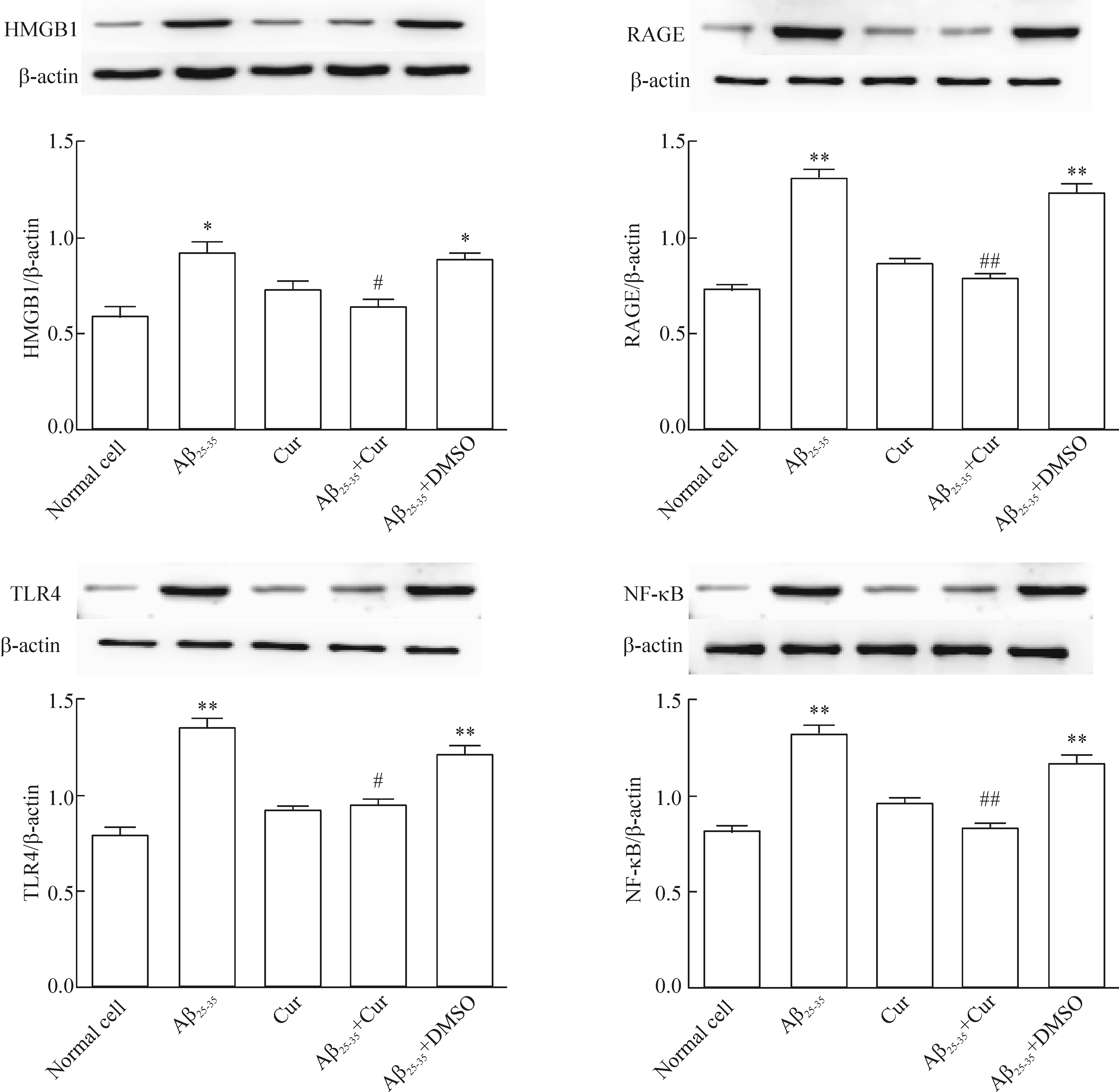
Figure 6.The protein levels of HMGB1, RAGE, TLR4 and NF-κB in the microglia with different treatments. Mean±SD.n=13.*P<0.05,**P<0.01vsnormal cell group;#P<0.05,##P<0.01vsAβ25-35group.
图6 各组HMGB1、RAGE、TLR4和NF-κB的蛋白水平比较
讨 论
人们一直认为Aβ沉积是导致AD的主要原因,但随着研究的深入,与 Aβ清除直接相关的MG逐渐被重视。在AD病程进展的不同阶段MG起到了不同的作用,在可见的Aβ形成之前MG的积聚是有益的,在AD的早期阶段MG起到了吞噬和清除Aβ的作用,从而保护大脑不受到Aβ的毒性损伤;随着病情的进展,MG对Aβ的清除能力逐渐下降[1],大量Aβ沉积使MG活化并增殖,并过量释放NO、TNF-α、IL-6等促炎因子,介导神经细胞的炎症损伤。因此,MG在AD的病情发展中起到了至关重要的作用。本研究采用原代小胶质细胞建立AD模型,相较于细胞株更贴近体内环境,能更好地模拟AD,因此更具说服力及研究价值。
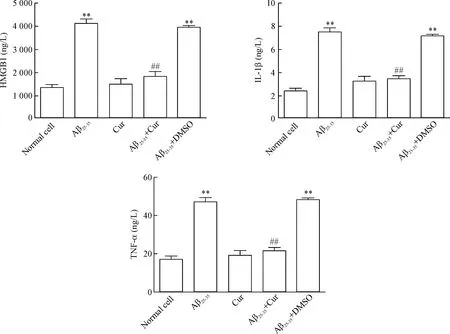
Figure 7.The releases of HMGB1, IL-1β and TNF-α in the culture supernatant in each group. Mean±SD.n=8.**P<0.01vsnormal cell group;##P<0.01vsAβ25-35group.
图7 各组上清液中HMGB1、IL-1β和TNF-α浓度比较
AD中Aβ的重要形式是Aβ1-40和Aβ1-42,Aβ斑块中最主要的成分是Aβ1-42,它更易于聚集,有很强的神经毒性,Aβ1-40是Aβ主要的可溶性形式,主要存在于血液循环之中[6]。Aβ25-35被认为是Aβ1-42的活性片段,于37 ℃水浴箱孵育7 d左右,即为“聚集”状态。但目前关于小胶质细胞与Aβ相互作用的资料却甚少。我们的CCK-8实验结果显示一定时间内小胶质细胞活性随着Aβ25-35浓度增大而减小,24 h后无明显变化。故选择24 h为造模时间,Aβ的造模浓度为40 μmol/L。
近年来的研究表明,HMGB1可能在记忆损害相关性疾病、慢性神经退行性变疾病及进行性神经炎症相关疾病中发挥关键作用[2]。临床研究证明,AD 患者颞叶皮质中的HMGB1水平升高[3]。在脑室内注射 Aβ建立的 AD 动物模型中,脑室内注射HMGB1加剧神经元的死亡,并延迟淀粉样蛋白的清除[4]。离体细胞实验也表明,原代培养的MG同时加入 Aβ1-42和HMGB1,Aβ1-42在细胞表面聚集增加,HMGB1 抑制MG对 Aβ1-42的吞噬作用[3-4]。HMGB1 还抑制MG对 Aβ1-40的降解,延迟 Aβ1-40的清除。以上研究均表明HMGB1 在 AD 发病机制中可能发挥重要作用,但其具体的机制至今尚不明确。HMGB1引起的损伤是通过 TLR4 和 RAGE 两者共同介导的[7]。RAGE是最早被确定的HMGB受体,两者结合通过激活 Ras 或 p38MAPK、ERK1/2,最终激活 NF-κB[8-9]。HMGB1与 TLR4结合后激活 MyD88、IL-1 受体相关激酶、TNF 受体相关因子等使IκB磷酸化降解从而激活NF-κB[10-11]。NF-κB 过度活化诱导神经细胞、胶质细胞诸多炎症因子及酶的表达如 TNF-α、IL-1β、iNOS 等,导致炎症级联反应引起神经元凋亡[12]。本研究用Western blot法检测发现,与正常组小胶质细胞相比,Aβ25-35模型组HMGB1、RAGE、TLR4和NF-κB的表达显著升高,说明Aβ增加了HMGB1的表达,促进了NF-κB通路活化。
姜黄素作为一种香料被广泛用于食品中。研究发现姜黄素促进AD患者巨噬细胞吞噬Aβ[13],破坏Aβ 纤维前体的稳定性[14],并且减少Aβ诱导的氧自由基产物水平。本研究发现,姜黄素是一种抗炎药物,能抑制小胶质细胞释放炎症介质。但是姜黄素在AD中的具体抗炎机制目前还不明确。本研究条件下,与Aβ25-35模型组相比,Aβ25-35+Cur治疗组的HMGB1、RAGE、TLR4、NF-κB的蛋白水平显著下降,提示姜黄素可能通过下调HMGB1的表达,抑制NF-κB信号通路来减弱小胶质细胞的炎症反应,从而对AD起到治疗作用。
总之,Aβ25-35可活化诱导大鼠原代小胶质细胞分泌IL-1β、TNF-α等炎症因子,姜黄素可减轻其细胞毒性和炎症反应,机制可能与下调HMGB1的表达,抑制NF-κB通路的促炎症反应有关。
[1] Hickman SE, Allison EK, Khoury JE. Microglia dysfunction and defective-amyloid clearance pathways in aging Alzheimer’s diease mice[J]. J Neurosci, 2008, 28(33):8354-8360.
[2] Fang P, Schachner M, Shen YQ. HMGB1 in development and diseases of the central nervous system[J]. Mol Neurobiol, 2012, 45(3):499-506.
[3] 范 悦,吴晓光,赵泓翔,等. 半支莲黄酮对Aβ25-35引起的大鼠皮层星形胶质细胞NOS、HPS70及apoE异常表达的影响[J]. 中国病理生理杂志,2014,30(2):359-363,379.
[4] Takata K, Kitamura Y, Tsuchiya D, et al. High mobility group box protein-1 inhibits microglial Abeta clearance and enhances Abeta neurotoxicity[J]. J Neurosci Res, 2004, 78(6):880-891.
[5] 叶莉莎,韩 园,刘启星,等. 姜黄素对阿尔茨海默病大鼠学习记忆及HMGB1和JNK表达的影响[J].中国病理生理杂志,2014, 30(6):1114-1118.
[6] Zhang L, Postina R, Wang Y. Ectodomain shedding of the receptor for advanced glycation end products: a novel therapeutic target for Alzheimer’s disease[J]. Cell Mol Life Sci, 2009, 66(24):3923-3935.
[7] Mazarati A, Maroso M, Iori V, et al. High-mobility group box-1 impairs memory in mice through both toll-like receptor 4 and receptor for advanced glycation end products[J]. Exp Neurol, 2011, 232(2):143-148.
[8] Webster SJ, Mruthinti S, Hill WD, et al. An aqueous orally active vaccine targeted against a RAGE/Aβ complex as a novel therapeutic for Alzheimer’s disease[J]. Neuromol Med, 2012, 14(2):119-130.
[9]Fang F, Lue LF, Yan S, et al. RAGE-dependent signaling in microglia contributes to neuroinflammation, Abeta accumulation, and impaired learning memory in a mouse model of Alzheimer’s disease[J]. FASEB J, 2010, 24(4):1043-1055.
[10]Walter S, Letiembre M, Liu Y, et al. Role of the toll-like receptor 4 in neuroinflammation in Alzheimer’s disease[J]. Cell Physiol Biochem, 2007, 20(6):947-956.
[11]赵 珊,马迎春,刘亚坤,等.姜黄素通过抑制内质网应激和JNK通路过度活化减轻小鼠肺缺血再灌注损伤[J]. 中国病理生理杂志,2013, 29(2):308-313.
[12]Song YS, Lee YS, Narasimhan P, et al. Reduced oxidative stress promotes NF-κ B- mediated neuroprotective gene expression after transient focal cerebral ischemia: lymphocytotrophic cytokines and antiapoptotic factors[J]. J Cereb Blood Flow Metab, 2007, 27(4):764-775.
[13]Zhang L, Fiala M, Cashman J, et al. Curcuminoids enhance amyloid-β uptake by macrophages of Alzheimer’s disease patients[J]. J Alzheimer s dis, 2006, 10(1):1-7.
[14]Yang F, Lim GP, Begum AN, et al. Curcumin inhibits formation of amyloid β oligomers and fibrils, binds plaques, and reduces amyloidinvivo[J]. J Biol Chem, 2005, 280(7):5892-5901.
(责任编辑: 林白霜, 余小慧)
Curcumin reduces neuroinflammation stimulated by Aβ25-35in primary rat microglial cells
LIU Xu-hua, WANG Xiao-qing, WANG Zhong-su, ZHAO Hang, QIAN Xiao-wei, CAO Hong, LI Jun
(DepartmentofAnesthesiology,TheSecondAffiliatedHospitalofWenzhouMedicalUniversity,Wenzhou325027,China.E-mail:lijun0068@163.com)
AIM: To investigate the effects of curcumin (Cur) on the expression of High mobility group box 1 protein (HMGB1), interleukin-1β (IL-1β), tumor necrosis factor-α (TNF-α) in amyloid-β (Aβ)-induced primary rat microglial cells. METHODS: Microglia were derived from the cerebral cortices of postnatal rat brains. The cells were identified by immunocytochemistry using mouse anti rat Iba-1 monoclonal antibody. A cell model using primary rat microglial cells incubated with Aβ25-35as an inflammation model of Alzheimer’s disease (AD) was set up. The morphological characters of primary rat microglial cells were observed. The concentration of Aβ25-35and the treatment concentration of curcumin were selected by CCK-8 assay. Cultured primary rat microglial cells were divided into 5 groups: normal cell group, Aβ25-35group, Cur group, Aβ25-35+Cur group and Aβ25-35+DMSO group. The expression of HMGB1, NF-κB, and receptor for advanced glycation end products (RAGE) was detected by Western blot. The levels of HMGB1, IL-1β, and TNF-α in the culture supernatant were measured by ELISA. RESULTS: The purity of primary microglias determined by Iba-1 immunofluorescence was more than 95%. The protein levels of HMGB1, RAGE and NF-κB were significantly increased after Aβ25-35stimulation. After treatment with Cur, the protein levels of HMGB1, RAGE and NF-κB were significantly decreased (P<0.05). The levels of HMGB1, IL-1β and TNF-α in the supernatant were significantly increased after Aβ25-35stimulation. Cur significantly decreased the level of HMGB1, IL-1β and TNF-α in the supernatant. CONCLUSION: Curcumin significantly inhibits neuroinflammation stimulated by Aβ25-35in primary rat microglial cells.
Alzheimer’s disease; Curcumin; Amyloid-β; Microglial; High mobility group box 1 protein
杂志网址: http://www.cjpp.net
1000- 4718(2016)09- 1635- 07
2016- 01- 25
2016- 07- 01
国家自然科学基金资助项目(No. 81271204);浙江省科技厅公益项目(No. 2016C37098)
△通讯作者 Tel: 0577-88002925; E-mail: lijun0068@163.com
R363.2; R749.1+6
A
10.3969/j.issn.1000- 4718.2016.09.017

