透明质酸对骨关节炎细胞模型中细胞蛋白多糖分泌功能的影响
赵 峰 何 薇 张国平 刘少俊 王 辉 石 硕
(河北医科大学第一医院骨科,河北 石家庄 050031)
透明质酸对骨关节炎细胞模型中细胞蛋白多糖分泌功能的影响
赵峰何薇1张国平刘少俊王辉石硕
(河北医科大学第一医院骨科,河北石家庄050031)
目的探讨透明质酸(HA)对体外培养的大鼠骨关节炎(OA)细胞增殖率及蛋白多糖分泌功能的影响。方法选取无特定病原体(SPF)级成年雄性SD大鼠1只,机械分离膝关节软骨,经胰蛋白酶、Ⅱ型胶原酶消化,CO2恒温培养,取第三代传代细胞,将其与DMEM培养液混合制成的细胞悬液移入细胞培养板中,分为三组,每组8个孔,接受不同的处理方法。模型组以白细胞介素(IL)-1β建立体外OA细胞模型;HA组造模外加入不同浓度(10、50、100、150 μg/L)的透明质酸(HA);对照组不加IL-1β和HA,均孵育72 h。分别采用四氮甲基唑蓝(MTT)法及二甲基亚蓝(DMB)比色法检测各组软骨细胞的增殖率及蛋白多糖的含量。结果模型组与HA组的细胞增殖率均显著低于对照组(P<0.05),而模型组与HA组比较无统计学差异(P>0.05);模型组与HA组(10、50 μg/L)的蛋白多糖含量均显著低于对照组,而HA 100、150 μg/L组的含量高于模型组(P<0.05),而两组与对照组相比均无统计学差异(P>0.05)。结论外源性HA可促进OA细胞对蛋白多糖的分泌功能,但对细胞增殖率无影响。
骨关节炎;透明质酸;蛋白多糖
骨关节炎(OA)病理基础是关节软骨中细胞减少和组织结构破坏〔1,2〕,研究表明,软骨中蛋白多糖(PG)减少是造成软骨组织结构破坏的重要原因〔3〕。透明质酸(HA)是一种酸性黏多糖,是关节滑液和软骨基质中的重要组分,在润滑关节、调节蛋白质和水电解质的扩散及运转、调节血管壁通透性、促进创伤愈合、抑制炎症反应等方面发挥重要作用;同时,HA也是PG组成的重要物质基础,对保证软骨组织形态结构的正常不可或缺。虽然美国骨科医师学会(AAOS)在最新的骨关节炎治疗指南中不推荐使用关节腔注射HA治疗OA,但近年来有观察发现,HA对改善OA患者的临床症状作用显著〔4〕,但其作用机制尚未完全阐明。本研究通过分析HA对PG分泌功能的影响,为探索OA的临床治疗方案及其作用机制提供新的线索。
1 材料与方法
1.1动物选取无特定病原体(SPF)级成年雄性SD大鼠1只,体质量120 g,由河北医科大学动物实验中心提供,合格证编号:DK0709-0165。于动物实验室自由饮食喂养,室温(25.0±2.0)℃,自然光照。
1.2方法
1.2.1大鼠软骨细胞的分离与培养将大鼠麻醉、处死,摘取膝关节软骨,手术过程注意无菌操作。将软骨剪成1 mm3左右的小碎块后,分别以胰蛋白酶和Ⅱ型胶原酶对软骨碎片消化1 h,得到软骨细胞悬液。将软骨细胞接种于DMEM培养液中(含10%胎牛血清),37℃ 5% CO2培养箱中培养,细胞贴壁后约2~3 d换液。待细胞汇集成片后弃去原培养基,以磷酸盐缓冲液(PBS)(含1%青链霉素)漂洗2遍,后加入0.25%的胰蛋白酶(含0.01%EDTA)摇匀置于恒温培养箱内消化3~5 min,传代培养,取第三代细胞待用。
1.2.2OA细胞模型的建立与分组以DMEM培养液(含0.5%胎牛血清)将第三代软骨细胞稀释成细胞悬液,浓度为4×107/L。吸取100 μl置于96孔板上。分别取8个孔用于空白对照组(对照组)及OA细胞模型组(模型组),另取32孔作为HA干预组(HA组)。其中,模型组及HA组均进行OA细胞模型建立:取1 μl白细胞介素(IL)-1β溶液(美国Sigma公司)加入各孔中(终浓度10 μg/L),混匀,37℃ 5% CO2培养箱中孵育72 h,弃上清。造模成功判定标准为显微镜下软骨细胞呈现胞质回缩,且胞内可见空泡。本次研究中40个孔均造模成功,成功率为100%。
1.2.3处理方法HA组在孵育前于各孔中加入100 μl不同浓度的HA(分子量为2×106U,美国Sigma公司),使HA的终浓度分别为10、50、100、150 μg/L,各浓度HA组均为8个孔;对照组不加IL-1β和HA,模型组不加HA,于培养箱内孵育72 h。
1.3观察指标
1.3.1四氮甲基唑蓝(MTT)法检测软骨细胞的增殖率于各孔依次加入20 μl 5 g/L的MTT试剂(美国Sigma公司)及100 μl培养液(不含血清),置于恒温培养箱中再孵育4 h,弃上清,后加入甲瓒溶液200 μl。以酶标仪测定各溶液光密度值(OD),设置主波长为570 nm,参比波长为690 nm。增殖率=(1-实验组OD值/对照组OD值)×100%。
1.3.2二甲基亚蓝(DMB)比色法检测软骨细胞中PG的含量取稀释的细胞悬液(浓度为1×108/L)接种于24孔板上,每孔加入1 ml DMEM液(含10%胎牛血清)后,恒温培养24 h。各组实验方法中除所加IL-1β及HA溶液均为10 μl外,其他处理方法同上。孵育72 h后分离上清。于每孔加入1 ml细胞悬液裂解细胞,反应完全后移入5 ml试管内。加入1 ml 32 mg/L DMB溶液(美国Sigma公司),充分混匀5 min后,以分光光度计比色(波长为525 nm)读取吸光度值。
由于硫酸软骨素是软骨中PG的主要组成成分,且其含量与DMB比色法读取的吸光度值呈良好的线性关系,因此,本研究以硫酸软骨素含量的吸光度值做标准曲线,绘制的标准曲线方程为Y=0.028X-0.147,R Sq Linear=99.9%,可作为PG的标准曲线。操作:取浓度为5、10、15、20、25、30 mg/L的硫酸软骨素标准液各1 ml,均加入DMB显色剂1 ml,混匀,5 min后读取各浓度液体于525 nm波长处的吸光度值,即得标准曲线。将所测软骨细胞溶液的吸光度值代入标准曲线方程计算得PG的含量。
1.4统计学方法应用SPSS14.0软件,正态分布、方差齐性资料进行单因素方差分析及两两比较的SNK-q检验。
2 结 果
模型组与HA组的细胞增殖率均显著低于对照组(P<0.05),而模型组与HA组比较均无差异(P>0.05)。模型组与HA组(10、50 μg/L)的PG含量均显著低于对照组,而HA组(100、150 μg/L)组均显著高于模型组(P<0.05),而与对照组相比均无统计学差异(P>0.05)。见表1。
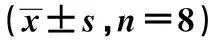
表1 HA对大鼠OA细胞增殖率和PG含量的影响
与对照组比较:1)P<0.05;与模型组比较:2)P<0.05
3 讨 论
OA是骨科常见的慢性疾病,以软骨的变性、破坏和骨质增生为主要特征,好发于中老年人群。目前OA的发病机制尚不明确,而细胞因子〔IL-1、肿瘤坏死因子(TNF)-α等〕是研究OA发病机制的重要因素,有研究认为,IL-1是OA产生的始动因子〔5〕,在促进软骨细胞凋亡、降解细胞外基质等骨代谢过程中发挥重要作用。本研究显微镜下观察显示,IL-1β可造成软骨细胞的形态变化,诱导OA细胞的产生。HA是一种由滑膜B细胞分泌的高分子黏多糖,在关节滑液和软骨基质的组成中必不可少,对于维持细胞及基质的稳定和平衡、润滑关节、营养和保护软骨、抑制炎症等具有重要作用〔6〕。有研究表明,关节液中HA含量的减低与OA的形成密切相关,可作为反映OA严重程度的重要指标〔7〕。此外,有研究发现,对OA患者注射外源性HA可显著缓解临床症状〔8〕,具有良好的治疗效果。其作用机制主要有:①对关节软骨应力进行覆盖、润滑和缓冲作用;②降低关节内炎症反应;③正反馈促进内源性HA的分泌〔9〕。此外,HA在细胞增殖、合成和分化等方面也具有促进作用〔10〕,而本研究未发现其在退变软骨细胞中的促增殖作用,这可能与本实验仅为体外实验,未形成体内软骨组织相似的细胞外环境有关。另外,HA是关节内PG的主干成分,PG链上的大量糖胺多糖支链(GAG)可外伸与阳离子和水分子结合,使关节及组织具有巨大的抗压力作用。同时,PG也是软骨基质的主要成分。因此,关节内PG含量的稳定对于维持软骨组织的结构和功能具有重要的支撑作用〔11〕。本研究结果显示,高浓度的外源性HA可增加退变软骨细胞中PG的含量,提示外源性HA可促进OA细胞中PG的合成和分泌。而研究未发现低浓度HA(10、50 μg/L)对PG的促分泌作用,提示低浓度HA对于PG的合成作用不显著。原因可能是低浓度HA合成的PG含量较低,还不足以对其合成作用形成正反馈。
1Tsonga T,Michalopoulou M,Malliou P,etal.Analyzing the history of falls in patients with severe knee osteoarthritis〔J〕.Clin Orthop Surg,2015;7(4):449-56.
2孟祥苗.葛根素对经IL-1β诱导的大鼠软骨细胞Ⅱ型胶原表达的影响〔D〕.福州:福建中医药大学,2014.
3Suutre S,Kerna I,Lintrop M,etal.Evaluation of correlation of articular cartilage staining for DDR2 and proteoglycans with histological tissue damage and the results of radiographic assessment in patients with early stages of knee osteoarthritis〔J〕.Int J Clin Exp Pathol,2015;8(5):5658-65.
4Altman RD,Manjoo A,Fierlinger A,etal.The mechanism of action for hyaluronic acid treatment in the osteoarthritic knee:a systematic review〔J〕.BMC Musculoskelet Disord,2015;16(1):321.
5霍雷.透明质酸钠注射配合自体富血小板血浆注射治疗膝骨关节炎的临床及实验研究〔D〕.苏州:苏州大学,2014.
6魏明波,吴燕丽.氨基葡萄糖联合透明质酸钠治疗颞下颌关节骨关节病的临床观察〔J〕.口腔医学研究,2013;29(6):563-4,568.
7Sasaki E,Tsuda E,Yamamoto Y,etal.Serum hyaluronic acid concentration predicts the progression of joint space narrowing in normal knees and established knee osteoarthritis-a five-year prospective cohort study〔J〕.Arthritis Res Ther,2015;17(3):283.
8Migliore A,Procopio S.Effectiveness and utility of hyaluronic acid in osteoarthritis〔J〕.Clin Cases Miner Bone Metab,2015;12(1):31-3.
9刘契,邓廉夫.骨关节炎相关细胞因子及蛋白的研究进展〔J〕.现代生物医学进展,2013;13(1):187-90.
10Wang Z,Wu G,Feng Z,etal.Microarc-oxidized titanium surfaces functionalized with microRNA-21-loaded chitosan/hyaluronic acid nanoparticles promote the osteogenic differentiation of human bone marrow mesenchymal stem cells〔J〕.Int J Nanomedicine,2015;10:6675-87.
11拉希德,刘世清.透明质酸对体外培养大鼠退变关节软骨细胞的影响〔J〕.武汉大学学报(医学版),2007;28(2):177-80,184.
〔2015-12-13修回〕
(编辑袁左鸣)
河北省2015年度医学科学研究重点课题(No.20150640)
赵峰(1978-),男,硕士,副主任医师,主要从事关节损伤与修复方面的研究。
R68
A
1005-9202(2016)18-4417-03;doi:10.3969/j.issn.1005-9202.2016.18.006
1河北医科大学第三医院手外科

