短葶山麦冬细胞悬浮培养技术的初步研究△
万学锋,赖钟雄,陈菁瑛
(1.福建省农业科学院 农业生物资源研究所 药用植物研究中心,福建 福州 350003;2.福建农林大学 园艺植物生物工程研究所,福建 福州 350002;3.福建省漳州市农业科学研究所,福建 漳州 363005)
短葶山麦冬细胞悬浮培养技术的初步研究△
万学锋1,2,3,赖钟雄2,陈菁瑛1*
(1.福建省农业科学院 农业生物资源研究所 药用植物研究中心,福建 福州 350003;2.福建农林大学 园艺植物生物工程研究所,福建 福州 350002;3.福建省漳州市农业科学研究所,福建 漳州 363005)
短葶山麦冬茎尖诱导的愈伤组织为松散型颗粒状,接种量为0.45 g达到最大增长量的时间短,四种碳源(蔗糖、葡萄糖、甘露醇和山梨醇)对短葶山麦冬悬浮细胞培养的影响差别不是很大,其中蔗糖的增殖率最高,达到252%,从成本上考虑,在以后的培养过程适合添加蔗糖作为碳源。短葶山麦冬悬浮细胞系的生长动态大致呈“S”形。短葶山麦冬悬浮细胞系培养选择的时间为10 d。
短葶山麦冬;悬浮细胞培养;增殖
短葶山麦冬Liriopemuscari(Desne.) Bailey为百合科山麦冬属植物,是《中华人民共和国药典》1995年版新增品种山麦冬的原植物之一,其干燥块根有养阴生津,润肺清心功效[1],有效成分麦冬多糖对增强免疫功能、保护脑缺血损伤、降血糖等具有重要的作用[2]。植物细胞悬浮培养(cell suspension culture)即单细胞群体或小的细胞聚集体在液体培养基中进行悬浮培养,它是从愈伤组织的液体培养的基础上发展起来的一种培养技术[3]。培养物可以接种在培养瓶中在摇床上培养,也可以在生物反应器中进行大规模培养。这些细胞和小的聚集体来自愈伤组织、某个器官或组织,甚至幼嫩的植株,通过物理或化学的方法进行分离而获得[4-5]。对具有药用价值的短葶山麦冬而言,进行细胞培养的研究对实现其药用成分麦冬多糖的工厂化生产具有重要意义,因此,本试验以短葶山麦冬茎尖诱导的愈伤组织[6]为起始材料,研究了短葶山麦冬悬浮培养体系建立与保持的关键因素,希望建立悬浮培养体系,以期为短葶山麦冬遗传转化合细胞突变体帅选提供优良的试验体系。
1 材料与方法
1.1 材料
以短葶山麦冬茎尖诱导的愈伤组织离体保持系为起始材料(图2A)
1.2 方法
1.2.1 悬浮培养体系的建立 挑选经过21 d愈伤组织培养,生长势好,稳定性相对一致的愈伤组织置于20 mL MS+0.5 mg·L-12,4-D中,附加蔗糖20 g·L-1的液体培养基中,在25 ℃、110 r·min-1的条件下培养,并进行观察。
1.2.2 接种量对悬浮培养的影响 选取已建立的细胞分散、生长旺盛的悬浮培养系,在MS+0.5 mg·L-12,4-D培养基中,比较不同接种量对悬浮细胞培养的影响。
1.2.3 碳源对悬浮培养体系的影响 选取已建立的细胞分散、生长旺盛的悬浮培养系,添加四种不同碳源(蔗糖、葡萄糖、甘露醇和山梨醇)的MS+0.5 mg·L-12,4-D培养基中,比较不同碳源对悬浮细胞培养的影响。
1.2.4 悬浮培养细胞系的生长 选取生长稳定,来源相同的悬浮培养细胞系,加入相同的液体培养基,每次移入材料采用5mL移液枪移入,比较不同碳源和接种量对短葶山麦冬悬浮培养细胞系的影响;在悬浮细胞培养中,以培养时间为横坐标,悬浮培养物的鲜重为纵坐标,绘制悬浮细胞生长曲线。
1.3 培养条件
悬浮培养细胞于50 mL三角瓶中,置于普通摇床中,转速12 h·d-1。试验每处理重复三次,采用DPS v9.50数据处理系统,对样本进行数据统计分析。
2 结果与分析
2.1 接种量对悬浮细胞系生长的影响
短葶山麦冬茎尖诱导的愈伤组织为松散型颗粒状,在转入液体培养基后很快分散,其中有的颗粒较大,不利于直接作为细胞悬浮培养的最终材料。因此,在初步培养的过程中,需要通过悬浮培养来选择剔除颗粒较大的细胞,经振荡后选择悬浮物上部细小的细胞继代培养,21~28 d后可建立稳定的悬浮培养物。经过继代培养后细胞能够满足悬浮培养的需要。
在MS+0.5 mg·L-12,4-D液体培养基15 mL上,每5 mL移液管里含有悬浮细胞约0.15 g,比较了不同接种量对短葶山麦冬悬浮细胞系生长的影响,见表1。
由表1可以看出,4个不同接种量对悬浮细胞培养生长表现为明显的区别。接种量为0.15 g时,培养基的材料过少,增殖达到最大增长量时所需要的时间过长,这样就势必会给材料带来培养细胞生活力下降;当接种量达到0.60 g时,所达到最大增长量时所需时间减少,但是培养基的营养元素不能满足继续增长的需求,限制了材料继续增殖,容易形成大细胞团,造成材料出现污染;当接种量在0.30 g和0.45 g时,能够满足液体培养基生长的需求,所增殖的细胞也具有良好的生长势,由于接种量为0.45 g所达到最大增长量的时间短,故选择0.45 g来进行悬浮培养。
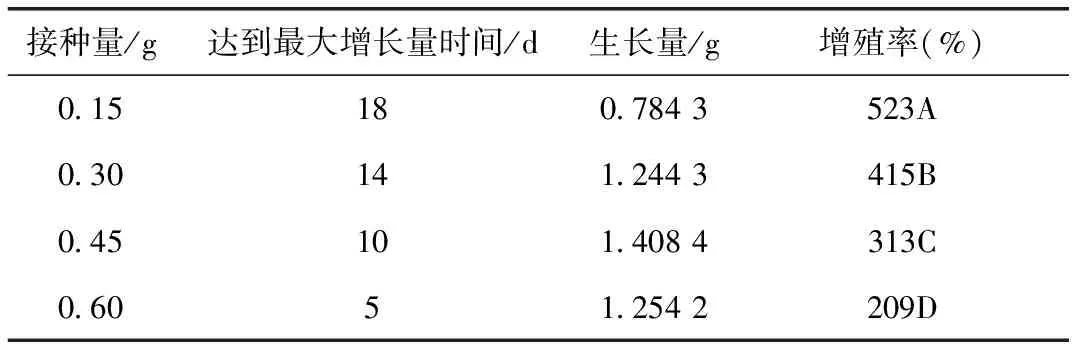
表1 不同接种量对短葶山麦冬悬浮培养细胞系生长的影响
注:达到最大密度时间以培养物鲜重不再增加时为准,生长量指达到最大密度时每个处理培养物的鲜重
2.2 不同碳源对短葶山麦冬悬浮培养细胞培养的影响
将不同碳源添加到悬浮细胞培养液中,培养20 d后,统计鲜重,比较不同的增殖率。结果见表2。

表2 不同碳源对短葶山麦冬悬浮培养细胞培养的影响
从表2中可出四种碳源对短葶山麦冬悬浮细胞培养的影响差别不是很大,其中蔗糖的增殖率最高,达到252%,高于其他三种碳源;添加甘露醇的增殖率最低,为202%。最高与最低的区别不算太大。从成本上考虑,在以后的培养过程适合添加蔗糖作为碳源,因为蔗糖的成本价最低。
2.3 短葶山麦冬悬浮细胞系生长曲线绘制
选取生长稳定、来源相同的悬浮培养细胞分为20瓶并进行编号,每隔2 d,共10个不同培养时期进行观察统计。每个时期共有鲜重0.9 g,分别加入MS+0.5 mg·L-12,4-D液体培养基15 mL进行培养,从第3 d开始依次40目不锈钢网滤去水分直接称鲜重,绘制悬浮细胞系的生长,见图1所示。

图1 短葶山麦冬悬浮细胞系的生长曲线
图1表明,短葶山麦冬悬浮细胞系的生长动态大致呈“S”形曲线。在2~6 d时生长缓慢,为延滞期,该时期细胞数目基本不增加(图2B);在6~14 d时,细胞生长迅速,其为对数期(图2C、D);14~20 d时,细胞数目有所增加,但随着培养液的消耗,生长速度减慢,细胞生长受到抑制。因此短葶山麦冬悬浮细胞系培养选择的时间为10 d(图2E)。

A.愈伤组织;B.细胞悬浮培养前期;C-D.中期;E.后期;F.悬浮培养过程中细胞污染死亡图2 短葶山麦冬悬浮培养体系
3 讨论
3.1 短葶山麦冬悬浮细胞培养体系的建立和保持
对于悬浮培养物的建立,起始材料的选择对试验的继续深入有着很关键的作用[7-8],短葶山麦冬松散的愈伤组织是建立优质的细胞悬浮培养物的理想的起始材料。经悬浮培养数代后,即可建立优质的细胞悬浮培养物,从而提高生长势。
在培养过程中,愈伤组织经多代(>8代)连续培养后,则出现衰退现象,生长势能力下降。因此有待于探索出能够获得高产优质的细胞悬浮培养物的培养机制。
3.2 接种量对生长的影响
当初步探索短葶山麦冬悬浮培养接种量大小时,选取了三个不同的生长量。生物产量随着接种量的增加而增大,但是随着接种量倍数的增加,生物产量的生长速率却反而下降。一般而言,加大接种量可提高生物产量,但是,由于一定量的培养液只能提供有限的营养成分,所以试验中随着接种量的增大,净增生物量却不一定增加。在悬浮培养过程中,要避免因为小细胞团形成大细胞团,这样会增加污染的概率。
3.3 悬浮培养的利用
悬浮培养可以时培养物均匀、充分的接触培养基,供给充足的养分,而且可以保持良好的通气状况,从而使培养物得到最大限度的生长。此外,液体悬浮培养具有接种量大、生长速率快、劳动强度小的特点,有利于组织细胞培养的规模化和工厂化。液体振荡培养广泛应用于细胞、原生质体、愈伤组织的培养及次生代谢产物的生产。短葶山麦冬悬浮培养在其他山麦冬离体培养中没有涉及到,本研究是短葶山麦冬第一次的细胞悬浮培养,短葶山麦冬块根具有药用价值,在进一步的研究中可以探讨,在悬浮培养环境条件下,探索次生代谢产物与悬浮培养的关系。
[1] 国家药典委员会.中华人民共和国药典:一部[S].北京:化学工业出版社,1995:19-131.
[2] 林晓,周强峰,徐德生.麦冬药理作用研究进展[J].上海中医药杂志,2004,38(6):59-61.
[3] 高文远,贾伟.药用植物大规模组织培养[M].北京:化学工业出版社,2005.
[4] 俞长河,陈振光.荔枝胚性悬浮培养物的建立、保持和优化原生质体分离的研究[J].热带作物学报,1998,19(3):16-20.
[5] 叶和春.水稻细胞悬浮培养及再生植株的研究[J].植物学报,1984,26(1):52-59.
[6] 万学锋,黄颖桢,赖钟雄,等.短葶山麦冬愈伤组织诱导与多糖积累动态研究[J].中药材,2012,35(2):171-175.
[7] 薛建平,石晶莹.怀牛膝愈伤组织悬浮培养及其多糖含量的初步研究,中国中药杂志,2008,33(21):2467-2469.
[8] 胡海英,赵亚美,阎晓磊,等.香花槐愈伤组织的诱导与细胞悬浮培养技术[J].北京林业大学学报.2007,29(5):26-30.
APreliminaryStudyofCellSuspensionsinLiriopemuscari(Desne.)Bailey
Wan Xuefeng1,2,3,LaiZhongxiong2,ChenJingying1*
(1.AgriculturalBio-resourcesInstitute,MedicinalPlantResearchCenterofFujianAcademyofAgriculturalSciences,Fuzhou350003,China;2.InstituteofHorticulturalBiotechnology,FujianAgricultureandForestryUniversity,Fuzhou350002,China;3.ZhangzhouinstituteofAgriculturalsciences,Zhangzhou363005,China)
The callus from stem was incompact,the inoculation amount of callus was 0.45 g.The difference among the four carbon sources (sucrose,glucose,mannitol and sorbitol) for suspension cell culture was not significant,sugar was the optimal carbon sources,and the highest growth rate was 252%,and sugar was the cheapest.The line of growth on suspension cells was approximately S-shaped.Suspension cultured cell needed 10 days to achieve the optimization.
Liriopemuscari(Desne.) Bailey;cell suspension culture;miacropropagation
2015-11-18)
福建省农科院药用植物科技创新团队建设项目(STIT-2-0351)
*
陈菁瑛,研究员,研究方向:药用植物资源与植物生物技术;E-mail:cjy6601@163.com
10.13313/j.issn.1673-4890.2016.8.017

