三七紫、绿地上茎植株抗氧化酶比活力和丙二醛含量对PEG6000模拟干旱胁迫的响应△
唐小华,赵昶灵*,余育启,陈中坚,文国松,孙艳,魏富刚,肖兴磊,李孙文
(1.云南农业大学 农学与生物技术学院,云南 昆明 650201;2.文山市苗乡三七实业有限公司,云南 文山 663000;3.云南农业大学 农科专业基础实验教学中心,云南 昆明 650201)
三七紫、绿地上茎植株抗氧化酶比活力和丙二醛含量对PEG6000模拟干旱胁迫的响应△
唐小华1,赵昶灵1*,余育启2,陈中坚2,文国松1,孙艳1,魏富刚2,肖兴磊2,李孙文3
(1.云南农业大学 农学与生物技术学院,云南 昆明 650201;2.文山市苗乡三七实业有限公司,云南 文山 663000;3.云南农业大学 农科专业基础实验教学中心,云南 昆明 650201)
目的探究三七地上茎积累花色苷对其干旱胁迫下抗氧化能力的效应。方法研究了PEG6000模拟干旱胁迫下三七一年生紫、绿地上茎植株叶可溶性蛋白质和丙二醛(MDA)含量及抗氧化酶比活力。结果在PEG6000模拟干旱胁迫下,紫、绿地上茎植株叶可溶性蛋白质含量、过氧化氢酶(CAT)和过氧化物酶(POD)比活力及MDA含量均增加、超氧化物歧化酶(SOD)比活力均下降,且绿茎植株叶可溶性蛋白质和MDA含量及紫茎植株叶CAT和POD比活力的升幅、绿茎植株叶SOD比活力的降幅均更大;PEG6000处理结束时,紫茎植株叶的可溶性蛋白质和MDA含量、CAT和SOD比活力均高于绿茎植株叶的,而紫、绿茎植株叶POD的比活力仍几乎相等;紫、绿茎植株叶可溶性蛋白质和MDA含量间的差异均仅达到显著水平,而CAT、POD和SOD比活力间的差异均未达到显著水平。结论一年生三七地上茎积累花色苷利于其叶可溶性蛋白质含量、CAT和POD比活力在干旱胁迫中的快速上升、滞缓干旱胁迫中SOD比活力下降和MDA含量的上升,并利于胁迫结束时叶高可溶性蛋白质含量、CAT和SOD比活力水平的维持。
三七一年生紫、绿地上茎植株;抗氧化酶比活力;可溶性蛋白质和丙二醛含量;PEG6000模拟干旱胁迫;响应
云南省文山州栽培三七Panaxnotoginseng的地上茎常因花色苷的积累而呈程度不同的紫色[1];一年生三七地上茎被划分为绿、绿紫过渡和紫3种[2]。现在,紫、绿(地上)茎三七已被登记为两个三七品种,即‘滇七一号’和‘苗乡三七一号’(云林园植新登第20150005号)。
文山州低纬高原环境是形成文山三七道地性的重要因素[3],干旱是文山州三七种植区的关键环境因子之一[4-5]。研究表明,干旱可诱导植物器官合成花色苷,而花色苷的积累可能对强化植物的抗旱性有利[6],其机理之一是:花色苷能强化细胞过氧化氢酶(CAT)、过氧化物酶(POD)和超氧化物歧化酶(SOD)等抗氧化酶的活性并减轻细胞脂质过氧化。但在不同植物中,花色苷强化抗氧化酶活性的程度不同[7],减轻细胞脂质过氧化的程度也不同[8]。三七紫、绿地上茎植株(即三七‘滇七一号’和‘苗乡三七一号’品种)抗旱性的差异则迄今仍为研究空白。
本文报道:文山一年生三七紫、绿地上茎植株抗氧化酶比活力和丙二醛(MDA)含量对聚乙二醇(PEG)6000模拟干旱胁迫的响应,可为三七花色苷生态功能的研究和三七抗旱力的评价提供参考。
1 材料与方法
1.1 大田试验和材料的采集与预处理
大田试验在“苗乡三七科技有限公司”(23°31′48″N,104°19′21″E)进行。三七垄宽150 cm、高30 cm,垄沟宽30 cm;棚顶及棚四周覆两层黑色聚乙烯遮阳网。从2014年7月1日至11月24日,每逢晴天、阴天或16:00~18:00没下雨的雨天,于当日17:00用手持塑料喷雾器对一年生三七紫、绿地上茎植株喷5% PEG6000模拟干旱[9],以叶面湿而无液滴掉落为度,对照喷自来水。6月30日、8月6日、9月12日、10月19日和11月25日分别随机选紫、绿地上茎植株各100株,每株采1片叶,置于纱布袋后立刻放入液氮;然后,将袋取出、击碎袋中叶片,加液氮将碎叶磨成粉,置-80℃备用。
1.2 三七叶抗氧化酶比活力的测定
三七叶可溶性蛋白质含量用考马斯亮蓝G250(Bio-Rad,USA)法测定[10],以牛血清白蛋白(BSA)(Sigma-Aldrich,St.Louis,USA)为标样,取叶粉0.200 0 g。CAT活性用紫外比色法测定[11],以每min内每克叶粉在A240变化0.1为1 U;POD活性用愈创木酚法测定[11],以每min内每克叶粉在A470变化0.01为1 U;SOD活性用氮蓝四唑法测定[11],以抑制NBT光还原的50%为1 U。CAT、POD和SOD的比活力=酶活性/可溶性蛋白质含量[mg·g-1(FW)]。
1.3 三七叶MDA含量的测定
MDA含量用硫代巴比妥酸比色法测定[12],在沸水浴中反应15 min,迅速冷却后在4000 r·min-1离心5 min,测定上清液的A450、A532和A600。
1.4 数据分析
试验均重复2次;将5次采样的测定结果取均值进行紫、绿地上茎植株间的比较;方差分析用SPSS17.0完成。
2 结果与分析
2.1 三七一年生紫、绿地上茎植株可溶性蛋白质含量对PEG6000模拟干旱胁迫的响应特征
未经PEG6000处理下,三七一年生紫、绿地上茎植株叶可溶性蛋白质含量分别为1.750和1.665 mg·g-1(FW),前者比后者高约5.06%(图1)。可见,非干旱胁迫下,三七一年生紫地上茎植株叶比绿地上茎植株叶积累更多可溶性蛋白质。在PEG6000处理下,紫、绿地上茎植株的可溶性蛋白质含量均上升,升幅分别约为1.55%和2.02%,后者约为前者的1.31倍;PEG6000处理结束时,紫茎植株的可溶性蛋白质含量约为绿茎植株的1.05倍(图1)。方差分析中,F0.01(1,4)=21.20>F品种≈13.18>7.71=F0.05(1,4),所以,紫、绿地上茎植株可溶性蛋白质含量间的差异仅达显著水平。
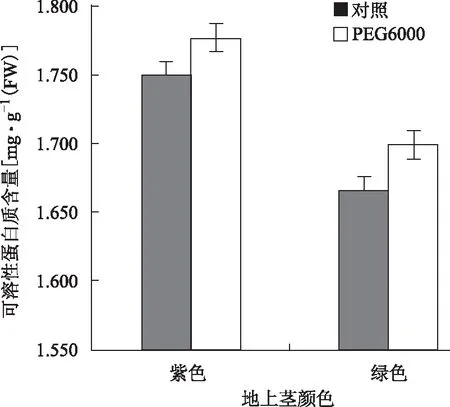
图1 三七一年生紫、绿地上茎植株可溶性蛋白质含量对PEG6000模拟干旱胁迫的响应
2.2 三七一年生紫、绿地上茎植株抗氧化酶比活力对PEG6000模拟干旱胁迫的响应特征
2.2.1 CAT比活力 未经PEG6000处理下,三七紫、绿地上茎植株叶CAT的比活力分别约为6.759和11.997 U·mg-1(蛋白),后者比前者高约77.494%(图2 A)。因此,三七一年生地上茎中积累花色苷会降低其叶CAT的比活力。在PEG6000处理下,紫、绿茎植株CAT的比活力均上升,升幅分别约为233.01%和30.98%,前者升幅约为后者的7.52倍;PEG6000处理结束时,紫茎植株CAT的比活力约为绿茎植株的1.43倍(图2 A)。方差分析中,F品种≈6.80<7.71=F0.05(1,4),所以,紫、绿茎植株叶CAT比活力间的差异未达显著水平。
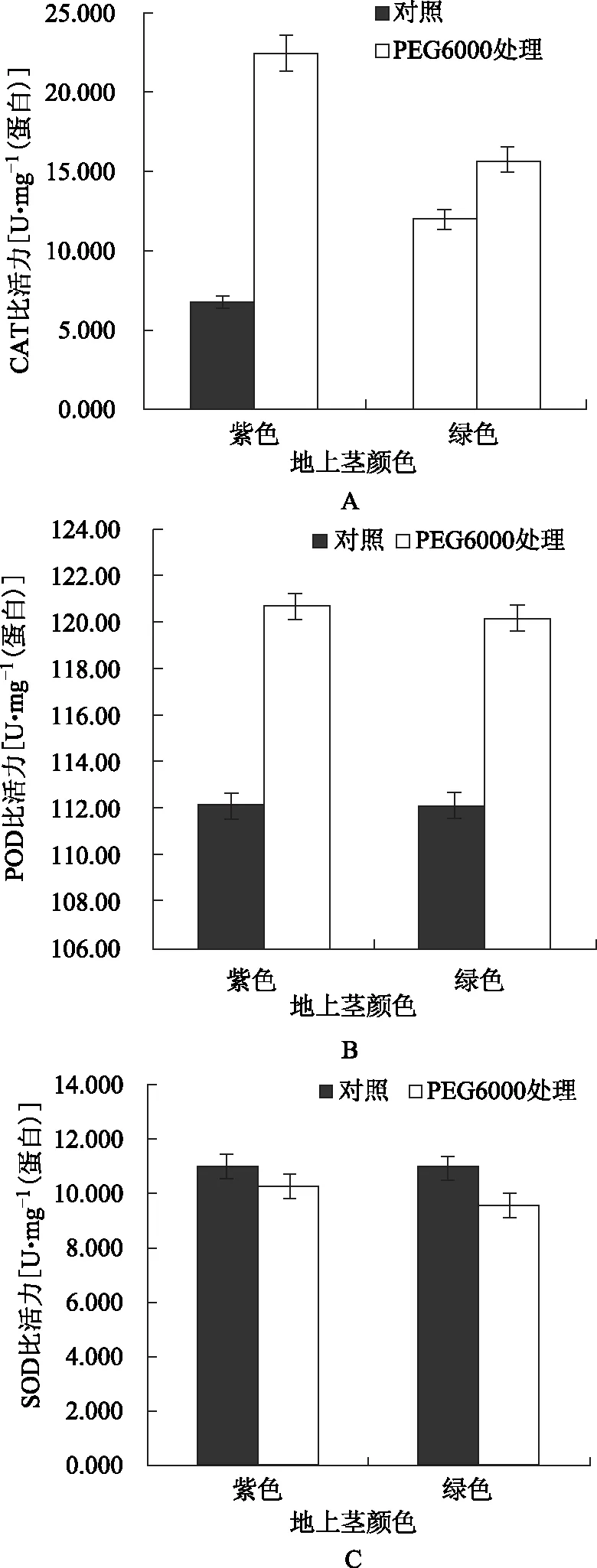
注:A.过氧化氢酶(CAT);B.过氧化物酶(POD);C.超氧化物歧化酶(SOD)图2 三七一年生紫、绿地上茎植株叶片抗氧化酶比活力对PEG6000模拟干旱胁迫的响应
2.2.2 POD比活力 未经PEG6000处理下,三七紫、绿地上茎植株叶POD的比活力分别约为112.176和112.139 U·mg-1(蛋白),前者仅比后者高约0.03%(图1 B)。可见,非干旱胁迫下,三七一年生地上茎中积累花色苷对其叶POD的比活力几乎无影响。PEG6000处理下,紫、绿茎植株POD的比活力均上升,升幅分别约为7.63%和7.17%;PEG6000处理结束时,紫茎植株POD的比活力仅比绿茎植株的约高0.47%(图1 B)。方差分析中,F品种≈0.06<<7.71=F0.05(1,4),所以,紫、绿茎植株POD比活力间的差异远未达显著水平。可见,不论干旱胁迫存在与否,三七一年生地上茎中积累花色苷对其叶POD的比活力均几乎无影响。
2.2.3 SOD比活力 未经PEG6000处理下,三七紫、绿地上茎植株叶SOD的比活力分别约为11.004和10.963 U·mg-1(蛋白),前者比后者高约0.37%(图2 C)。可见,非干旱胁迫下,三七一年生地上茎中积累花色苷仅导致其叶SOD比活力略微上升。PEG6000处理下,紫、绿茎植株SOD的比活力均下降,降幅分别约为6.68%和12.69%;PEG6000处理结束时,紫茎植株SOD的比活力仍约为绿茎植株的1.08倍(图2 C)。方差分析中,F品种≈0.54<7.71=F0.05(1,4),所以,紫、绿茎植株SOD比活力间的差异未达显著水平。
2.3 三七一年生紫、绿地上茎植株叶片MDA含量对PEG6000模拟干旱胁迫的响应特征
未经PEG6000处理下,三七紫、绿茎植株的MDA含量分别约为13.352和12.201 μmol·g-1(FW),前者比后者高约9.43%(图3)。可见,非干旱胁迫下,三七地上茎积累花色苷会增加其叶MDA含量。PEG6000处理下,三七紫、绿茎植株的MDA含量均上升,但绿茎植株的升幅约为紫茎植株升幅的6.83倍(图3)。方差分析中,F0.01(1,4)=21.20>F品种≈8.23>7.71=F0.05(1,4),所以,紫、绿茎植株MDA含量间的差异仅达显著水平。

图3 三七一年生紫、绿地上茎植株叶片丙二醛含量对PEG6000模拟干旱胁迫的响应
3 结论与讨论
本研究发现,无干旱胁迫时,一年生文山三七地上茎中积累花色苷会显著增加其叶的可溶性蛋白质和MDA含量、降低其叶CAT的比活力,并略微增加其叶SOD的比活力,但对其叶POD的比活力几乎无影响。干旱胁迫下,紫、绿地上茎植株叶可溶性蛋白质含量、CAT和POD的比活力及MDA含量均增加、SOD的比活力均下降,且绿茎叶可溶性蛋白质和MDA含量及紫茎叶CAT和POD比活力的升幅、绿茎叶SOD比活力的降幅均更大;干旱胁迫结束时,紫茎叶可溶性蛋白质和MDA含量、CAT和SOD的比活力均高于绿茎叶的,而紫、绿茎叶POD的比活力仍几乎相等;紫、绿地上茎植株叶可溶性蛋白质和MDA含量间的差异均仅达显著水平,而CAT、POD和SOD比活力间的差异均未达显著水平。所以,一年生三七地上茎中花色苷的积累利于其叶可溶性蛋白质含量、CAT和POD比活力在干旱胁迫中的快速上升、滞缓胁迫中SOD比活力下降和MDA含量的上升,并利于胁迫结束时叶高可溶性蛋白质含量、CAT和SOD比活力水平的维持。
在PEG6000模拟的干旱胁迫存在与否的条件下,一年生文山三七紫、绿地上茎植株叶可溶性蛋白质和MDA含量及抗氧化酶比活力的变化趋势及其对三七抗旱性的贡献不一致。无干旱胁迫下,紫茎植株的可溶性蛋白质含量约绿茎植株的1.05倍;可溶性蛋白是植物细胞的渗透调节物之一,故一年生三七的叶细胞因地上茎积累花色苷而具较低的渗透势(ψs)、更高的保水力[13]。干旱胁迫下,三七紫、绿茎植株的可溶性蛋白质含量均上升,且绿茎的升幅更大,这与5~20%PEG6000导致高山离子芥Chorisporabungeana试管苗叶可溶性蛋白含量上升的现象一致[14],但胁迫结束时紫茎的可溶性蛋白质含量仍高于绿茎的。因此,三七地上茎积累花色苷并没有提升其叶可溶性蛋白质含量在干旱胁迫下的升速,但利于叶在胁迫下仍维持较高的可溶性蛋白质含量,这利于植株耐旱力的强化[15]。非干旱胁迫下,三七地上茎中积累花色苷会降低其叶CAT的比活力,这与辛越对稠李属三种果实CAT比活力的研究结果一致[16]。干旱胁迫下,三七紫、绿茎植株CAT的比活力均上升,且紫茎的升幅更大;胁迫结束时,紫茎CAT的比活力远高于绿茎的。因此,三七地上茎积累花色苷既利于三七叶CAT比活力在干旱胁迫中的速升又利于胁迫结束时高CAT比活力水平的维持,这将利于减轻三七在干旱胁迫下的活性氧伤害[17]。非干旱胁迫下,三七地上茎中积累花色苷对其叶POD的比活力几乎无影响,这与李颖颖的研究结果相似[18];干旱胁迫下,紫、绿茎植株POD的比活力均上升,但紫茎的升幅略大,这意味着三七地上茎积累花色苷仅能增加其叶POD比活力在干旱胁迫下的升速。非干旱胁迫下,三七生地上茎中积累花色苷会导致其叶SOD的比活力略微上升,类似地,黄小霞[19]曾发现花色苷能显著提高肝脏SOD活性;干旱胁迫下,三七紫、绿茎植株SOD的比活力均下降,但紫茎的降幅约为绿茎降幅的一半,胁迫结束时,紫茎植株SOD的比活力仍高于绿茎的。可见,三七地上茎积累花色苷不仅能滞缓其叶SOD比活力在干旱胁迫下的下降而且利于SOD比活力在胁迫结束时仍维持在较高水平,这将贡献于干旱胁迫下三七叶细胞活性氧伤害的减轻[17]。非干旱胁迫下,三七地上茎积累花色苷会增加其叶片的MDA含量,这意味着花色苷在三七地上茎中的常态积累伴随着三七叶更严重的膜脂过氧化[20],原因暂时不明;干旱胁迫下,三七紫、绿地上茎植株的MDA含量均上升,且后者升幅约为前者升幅的6.83倍,这与高山离子芥C.bungeana试管苗叶MDA含量在PEG6000模拟干旱条件下升高的现象一致[14],可见,地上茎积累花色苷大大减轻了三七叶细胞在胁迫下的膜脂过氧化,这可能是因花色苷能直接充当抗氧化剂[21]。因此,文山三七一年生紫地上茎植株的抗旱性优于绿地上茎植株的。
[1] 赵昶灵,王颖,段承俐,等.三七块根紫色素的花色苷本质及其含量和总皂苷含量的正相关性[J].广西植物,2008,28(5):661-670.
[2] 陈中坚,王勇,曾江,等.三七植株的性状差异及其对三七产量和质量影响的调查研究[J].中草药,2001,32(4):357-358.
[3] 崔秀明,陈中坚.三七药材的道地性研究[M].昆明:云南科技出版社.2007:108.
[4] 陈宗瑜.云南气候总论[M].北京:气象出版社,2001.
[5] 尹鸿翔,林旺,张艺,等.持续干旱对三七产业发展的影响[J].中国药房,2010,21(27):2497-2499.
[6] 孙明霞,王宝增,范海,等.叶片中的花色素苷及其对植物适应环境的意义[J].植物生理学通讯,2003,39(6):688- 694.
[7] 李颖畅,孟宪军,孙靖靖,等.2008.蓝莓花色苷的降血脂和抗氧化作用[J].食品与发酵工业,34(10):44-48.
[8] Gould K S.Nature’s Swiss army knife:The diverse protective roles of anthocyanins in leaves[J].J Biomed Biotechnol,2004,5(2004):314-320.
[9] 陈郡雯,吴卫,郑有良,等.聚乙二醇(PEG6000)模拟干旱条件下白芷苗期抗旱性研究[J].中国中药杂志,2010,35(2):149-153.
[10] Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Anal Biochem,1976,72(1-2):248-254.
[11] 罗俊杰,欧巧明,叶春雷,等.重要胡麻栽培品种的抗旱性综合评价及指标筛选[J].作物学报,2014,40(7):1259-1273.
[12] 李合生.植物生理生化实验原理与技术[M].北京:高等教育出版社,2000.
[13] 肖强,郑海雷,陈瑶,等.盐度对互花米草生长及脯氨酸/可溶性糖和蛋白质含量的影响[J].生态学杂志,2005,24(4):373-376.
[14] 杨宁,王程亮,李宜珅,等.高山离子芥试管苗在PEG-6000模拟干旱条件下的生理响应[J].广西植物,2015,35(1):77-83,98.
[15] 毛桂莲,许兴.枸杞耐盐突变体的筛选及生理生化分析[J].西北植物学报,2005,25(2):275-280.
[16] 辛越.稠李属三种果实花色苷抗氧化活性研究[D].黑龙江:东北林业大学,2013.
[17] Tang X H,Zhao C L,Wen G S,et al.Physiological mechanism of anthocyanins to strengthen the drought tolerance of plants[J].Agric Sci Technol,2014,15(11):1935-1941.
[18] 李颖颖.红掌花PAL基因的克隆与花色苷含量的[D].海南:海南大学,2012.
[19] 黄小霞.三种植物来源花色苷稳定性及其抗氧化和降血脂活性比较研究[D].广州:华南农业大学,2010.
[20] 李合生.现代植物生理学:第3版[M].北京:高等教育出版社,2012:347,356.
[21] de Rosso V V,Morán Vieyra F E,Mercadante A Z,et al.Singlet oxygen quenching by anthocyanin’s flavylium cations[J].Free Radic Res,2008(42):885-891.
ResponsesofAntioxidaseSpecificActivitiesandMalondialdehydeContentsofPurpleandGreenAerialStemmedPanaxnotoginsengPlantstoDroughtStressSimulatedbyPEG6000
TANGXiaohua1,ZHAOChangling1*,YUYuqi2,CHENZhongjian2,WENGuosong1,SUNYan1,WEIFugang2,XIAOXinglei2,LISunwen3
(1.CollegeofAgronomyandBiotechnology,YunnanAgriculturalUniversity,Kunming650201,China;2.MiaoxiangSanqiIndustrialCorporationLtd.ofWenshanCity,Wenshan663000,China;3.TeachingCenteroftheBasicExperimentsofAgriculturalMajors,YunnanAgriculturalUniversity,Kunming650201,China)
Objective:To study the effects of the anthocyanin accumulation in the aerial stems ofPanaxnotoginsengon the antioxidative capacity ofP.notoginsengunder drought stress.MethodThe soluble protein and malondialdehyde (MDA) contents and the antioxidase specific activities of the leaves of one-year-old purple and green aerial stemmedP.notoginsengplants under the drought stress simulated by PEG6000 were determined.ResultUnder the drought stress simulated by PEG6000,the soluble protein contents,the specific activities of the catalase (CAT) and peroxidase (POD) and MDA contents of the leaves of one-year-old purple and green aerial stemmedP.notoginsengplants all increased and the specific activities of the superoxide dismutase (SOD) all decreased.Moreover,the increasing degrees of the contents of the soluble protein and MDA of the leaves of the green aerial stemmed plants and the specific activities of the CAT and POD of the leaves of the purple aerial stemmed plants,and the decreasing degrees of the specific activities of the leaf SOD of the green aerial stemmed plants were all much larger.When the PEG6000 treatment terminated,the contents of the soluble protein and MDA and the specific activities of the CAT and POD of the leaves of the purple aerial stemmed plants were higher than those of the green aerial stemmed plants,whereas the specific activities of leaf POD of the purple aerial stemmed plants almost remained equal to those of the green aerial stemmed plants.The differences of the contents of the leaf soluble protein and MDA of the purple and green aerial stemmed plants only reached the significant levels,and the differences of the specific activities of the CAT,POD and SOD all did not reach.ConclusionThe anthocyanin accumulation in the aerial stems of one-year-oldP.notoginsengfavors the rapid increases of the soluble protein content and the specific activities of the CAT and POD of the leaves during drought stress,slows the decrease of the specific activity of leaf SOD and the increase of the MDA content,and is beneficial to the maintenance of the high soluble protein content and specific activities of the CAT and POD at the end ofthe stress.
One-year-oldPanaxnotoginsengplants with purple and green aerial stems;specific activities of antioxidases;malondialdehyde content;drought stress simulated by PEG6000;response
2015-11-10)
国家自然科学基金(31060045;31260091;31460065)
*
赵昶灵,教授,硕士生导师,研究方向:花色苷的生态生理功能;Tel:(0871)65227213,E-mail:zhaoplum blossom7@163.com
10.13313/j.issn.1673-4890.2016.8.018

