核苷类似物替比夫定对免疫抑制小鼠细胞免疫功能的调节作用
顾宇峰 黄莉莉 孙伟 宗雪萍 谭晓慧 汤伟
核苷类似物替比夫定对免疫抑制小鼠细胞免疫功能的调节作用
顾宇峰 黄莉莉 孙伟 宗雪萍 谭晓慧 汤伟
目的 观察替比夫定对小鼠细胞免疫功能的调节作用。方法 BALB/C小鼠48只,随机分为3组:正常对照组、替比夫定组和环磷酰胺模型组。正常对照组与环磷酰胺模型组小鼠给予生理盐水(0.2 mL/只)灌胃,替比夫定组小鼠给予替比夫定(86.5 mg/kg)灌胃,每日1次,共35 d。自第29天起,环磷酰胺模型组、替比夫定组小鼠给予环磷酰胺(30 mg/kg)腹腔注射,每日1次,连续7 d。末次给药后第2天,处死所有小鼠并取标本待检。小鼠骨髓单个核细胞以GM-CSF(20 ng/mL)和IL-4(10 ng/mL)培养7 d以诱导树突状细胞(DC)。DC细胞表面分子MHC-Ⅱ、CD40的表达采用流式细胞仪检测。DCs与C57BL/6鼠T淋巴细胞混合培养4 d后,采用MTT比色法检测淋巴细胞增殖状况。小鼠血清中IL-4、IFN-γ浓度采用ELISA检测。结果 替比夫定组小鼠DC细胞表面分子MHC-Ⅱ、CD40的表达水平明显高于环磷酰胺模型组(PMHC-Ⅱ<0.05,PCD40<0.01)。DCs与脾T淋巴细胞混合例为1∶10、1∶20,替比夫定组小鼠DCs刺激淋巴细胞增殖能力均高于环磷酰胺模型组(P1∶10<0.01,P1∶20<0.05)。替比夫定组小鼠血清中IFN-γ的浓度高于环磷酰胺模型组(PIFN-γ<0.05),但两组的血清IL-4水平差异无统计学意义(PIL-4>0.05)。结论 替比夫定对细胞免疫功能具有一定的增强作用。
替比夫定;树突状细胞;IFN-γ;IL-4;慢性乙型肝炎
慢性乙型肝炎治疗的最基础和关键措施是有效地抑制体内的HBV复制乃至清除HBV,其已成为共识。核苷(酸)类似物由于具有抑制病毒复制速度较快、服用方便、副作用较少及治疗费用相对较低等优点而成为慢性乙型肝炎抗病毒治疗的最主要的选择。但患者长期服用此类药物后停药仍常有复发,如为HBeAg阳性患者治疗后未能实现HBeAg血清转换而停药则复发率更高。替比夫定的一些临床研究结果显示,持续接受替比夫定治疗2年、3年、4年后患者的HBeAg血清转换率分别为32%、46%、53.2%,且经该药治疗获得满意应答的患者停药60周和204周后的累积复发率仅为16.3%和23.3%[1-2]。为探究该药良好疗效的机制,一些学者进行了基础和临床研究。多位学者观察到以替比夫定治疗的慢性乙型肝炎患者可出现外周血调节性T细胞比例降低、树突状细胞成熟度改善及Th1类细胞因子水平升高等变化[3-5];另有学者报道,替比夫定可在体外促进感染3型鼠肝炎病毒小鼠巨噬细胞的TNF-α、IL-12 mRNA转录和细胞因子分泌[6];本研究组曾观察到替比夫定可提高环磷酰胺所致免疫抑制小鼠T、B淋巴细胞的增殖能力[7]。为进一步验证替比夫定是否具有免疫调节作用,本研究采用环磷酰胺诱导的免疫抑制小鼠模型,观察其对小鼠细胞免疫的影响。
资料和方法
一、材料与仪器
BALB/C小鼠(SPF级) 48只,雌性,体重(20±2) g,4~5周龄;C57BL/6小鼠(SPF级) 8只,雌性,体重(20±2) g,4~5周龄;均由南通大学实验动物中心提供,生产许可证号:SC×K(苏)2008-0010,使用许可证号:SC×K(苏)2007-0021。 环磷酰胺:江苏恒瑞医药股份有限公司(批号:10051821)。替比夫定:北京诺华制药有限公司生产(批号:x0243)。四甲基偶氮唑盐(MTT):购自美国Sigma公司。重组鼠粒细胞-巨噬细胞集落刺激因子(rmGM-CSF)、重组鼠白细胞介素-4(rmIL-4):均购自美国PEPROTECH公司。 藻红蛋白(PE)标记抗小鼠MHC-Ⅱ类分子抗体、CD40抗体:美国Biolegend公司。 IFN-γ、IL-4 ELISA试剂盒:上海依科塞生物制品有限公司。ELX800通用酶标仪(美国BioTek公司)、流式细胞仪(美国BECTON DICKINSON公司)。
二、方法
(一)动物分组与处理 48只小鼠随机分为正常对照组、环磷酰胺模型组与替比夫定组,每组16只。正常对照组与环磷酰胺模型组小鼠给予生理盐水(0.2 mL/只)灌胃,替比夫定组小鼠给予替比夫定溶液(86.5 mg/kg体重,0.2 mL/只)灌胃,每日1次,共35 d;自第29日起在灌胃后,环磷酰胺模型组、替比夫定组小鼠给予环磷酰胺30 mg/kg腹腔注射,每日1次,连续7 d,以制备小鼠免疫抑制模型[8]。于末次给药后第2天,对各实验小鼠以摘眼球法取血,分离血清,-80℃冰箱保存。
(二)小鼠骨髓来源树突状细胞(DC)的诱导与培养 处死小鼠后取股骨,用RPMI1640培养液冲洗骨髓腔,收集冲洗液体,去除红细胞,用完全培养液重悬细胞(2×106个/mL),分置于12孔培养板内,每孔2 mL,37 ℃、5% CO2、100%湿度下培养;24 h后全量换液,每孔加入GM-CSF(20 ng/mL)和IL-4(10 ng/mL),继续培养至第8天,收集悬浮细胞(即为DCs)。
(三)DC表面分子检测 收集培养至第8天的DC,PBS洗涤后重悬(5×105/mL);将DC细胞悬液加入流式管中,各流式管中分别加入MHC-Ⅱ-PE抗体、CD40-PE抗体,4℃避光孵育30 min;PBS洗涤后重悬;以流式细胞仪进行检测细胞表面分子MHC-Ⅱ、CD40的表达。
(四)混合淋巴细胞反应 收集培养至第8天的各组DCs,用PBS洗涤后以完全培养液重悬(5×105个/mL)。取C57BL/6小鼠,颈椎脱臼处死后取脾,常规方法制备脾细胞悬液,加入淋巴细胞分离液中,离心后吸取单个核细胞层,PBS洗涤后以完全培养液重悬(10×106/mL)。实验于96孔培养板中进行,每例设3个复孔:实验孔加入DCs和脾T淋巴细胞(DCs/T的比值分别为1∶10、1∶20),对照孔仅加入脾T淋巴细胞;37℃、5% CO2、孵育4 d。每孔加入20 μL MTT,再孵育4 h,弃上清,加入二甲基亚砜100 μL/孔,10 min后用酶标仪以570 nm波长测各孔OD值并计算各孔的DC刺激指数(SI):
SI=实验孔OD值÷对照孔OD值
(五)小鼠血清中IL-4、IFN-γ浓度的检测 采用双抗体夹心ELISA法,操作按试剂盒说明书进行。反应结束后于10分钟内用酶标仪以450 nm波长测各孔OD值。根据IL-4、IFN-γ标准品的浓度和相应OD值,求出IL-4、IFN-γ浓度回归方程分别为:y=-52.593x2+519.99x-9.3818(IL-4);y=30.633x2+406.22x+9.7033(IFN-γ)。将各小鼠血清标本的OD值分别代入回归方程计算出该标本的细胞因子浓度。
三、统计学分析
结 果
一、替比夫定对小鼠DC细胞表面分子表达的影响
收集培养第8天的DC,以流式细胞仪分析。3组小鼠DC细胞表面分子MHC-Ⅱ、CD40的表达水平均有明显差异(F(MHC-Ⅱ)=13.04,P<0.01;F(CD40)=21.21,P<0.01):正常对照组DC细胞表面分子MHC-Ⅱ、CD40的表达均高于环磷酰胺模型组和替比夫定组;替比夫定组小鼠DC细胞表面分子MHC-Ⅱ、CD40的表达均高于环磷酰胺模型组;详见表1。 图1为各组DC细胞表面分子的流式检测图。
二、替比夫定对DC体外刺激T淋巴细胞增殖能力的影响
3组小鼠DC刺激淋巴细胞增殖能力(DC刺激指数 SI)有明显差异(F(1∶10)=52.10,P<0.01;F(1∶20)=27.11,P<0.01):正常组小鼠DC刺激淋巴细胞增殖能力高于替比夫定组和环磷酰胺模型组;替比夫定组小鼠DCs刺激淋巴细胞增殖能力高于环磷酰胺模型组;详见表2。
三、替比夫定对小鼠血清中细胞因子IFN-γ、IL-4水平的影响
3组小鼠的血清中IFN-γ和IL-4浓度均有明显差异(F(IFN-γ)=15.12,P<0.01;F(IL-4)=12.52,P<0.01):正常对照组小鼠血清中IFN-γ的浓度高于替比夫定组和环磷酰胺模型组小鼠,替比夫定组小鼠血
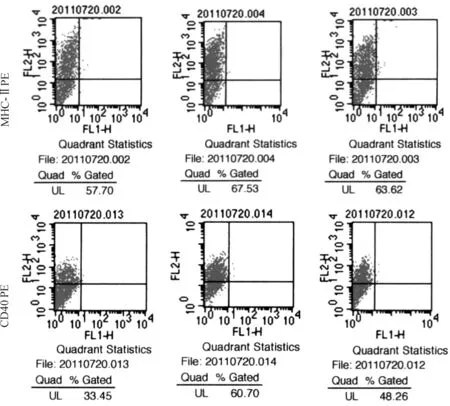
图1 各组DC细胞表面分子流式检测结果图
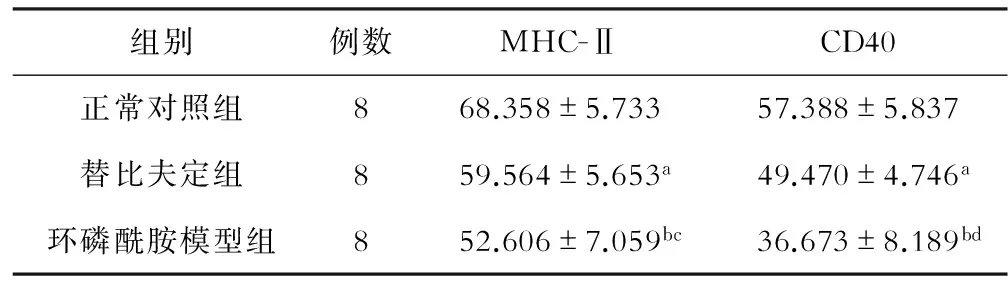
组别例数MHC-ⅡCD40正常对照组868.358±5.73357.388±5.837替比夫定组859.564±5.653a49.470±4.746a环磷酰胺模型组852.606±7.059bc36.673±8.189bd
注:aP<0.05,bP<0.01,与正常对照组比较;cP<0.05,dP< 0.01,与替比夫定组比较
表2 各组小鼠DC刺激脾淋巴细胞增殖能力(±s)
注:aP<0.05,bP<0.01,与正常对照组比较;cP<0.05,dP<0.01,与替比夫定组比较
表3 各组小鼠血清中IFN-γ、IL-4浓度(pg/mL,±s)
注:aP<0.05,bP<0.01,与正常对照组比较;cP<0.05,与替比夫定组比较
清中IFN-γ的浓度高于环磷酰胺模型组;与正常对照组比较,替比夫定组和环磷酰胺模型组小鼠血清中IL-4的浓度均较低,且差异均有统计学意义,但这两组之间的差异无统计学意义;详见表3。
讨 论
CHB的发病机制尚未完全阐明,但一致认为与病毒因素及宿主免疫功能密切相关。机体的免疫系统中参与清除HBV的机制包括细胞免疫和体液免疫,其中细胞免疫正常与否决定HBV感染机体后转归的最重要因素。大量研究资料发现,慢性乙型肝炎患者存在免疫功能缺陷,不能有效清除体内HBV而导致病毒持续感染[10]。
抗原提呈细胞(APC)具有捕捉处理抗原、并将抗原提呈给淋巴细胞,使后者活化、增殖并发挥免疫应答效应的重要功能。体内的DC按其发育分化程度可分为成熟DC和未成熟DC,二者的生物学特征有明显差异。成熟DC高表达MHC-Ⅱ类分子和CD40、CD80等,体外激发MLR能力和抗原提呈能力强。有研究发现,与正常人比较,CHB患者外周血DC细胞表面CD80、CD86和MHC-Ⅱ类分子等的表达不足,刺激T细胞增殖、自体CTL细胞毒作用的能力均明显降低,可能是CHB患者抗HBV特异性应答不足的重要原因之一[11]。本项研究中,观察到替比夫定治疗组小鼠DC细胞的MHC-Ⅱ和CD40等表面分子表达水平和刺激同种异体淋巴细胞增殖的能力均明显高于环磷酰胺模型组,提示该药不仅能够促进DC细胞的发育和分化,提高体内成熟DC水平,而且能够改善DC细胞刺激T细胞活化增殖的功能。
CD4+Th细胞是调节免疫应答的一类重要调节性细胞, CD4+T 细胞分为Thl 和Th2 两个亚群。Th1细胞主要分泌IL-2、IFN-γ等细胞因子,参与细胞毒性T 细胞(CTL) 介导的细胞免疫;Th2细胞的主要分泌IL-4、IL-6、IL-10等细胞因子,通过这些细胞因子下调Th1细胞的免疫调节作用。目前认为宿主免疫调控紊乱尤其是Th1/Th2反应失衡可能是导致HBV持续感染和慢性乙型肝炎的重要原因之一。曾氏等[12]研究发现:急性乙型肝炎患者相比,慢性乙型肝炎患者血清中的IL-2和IFN-γ水平明显降低而IL-4水平明显升高。 本实验中观察到,替比夫定组小鼠血清的Th1型细胞因子IFN-γ的含量明显高于环磷酰胺模型组,而Th2型细胞因子IL-4的血清水平在两组之间差异无统计学意义,此结果与王煜、朱斌等[3-4]的临床观察结果相似,提示替比夫定主要提高Th1细胞的免疫反应能力。
近年来发现,NK细胞不仅具有重要的抗病毒和抗肿瘤作用,还能够通过抗原呈递、分泌细胞因子及细胞直接接触等方式发挥免疫调节作用[13]。有研究者观察到,慢性HBV感染者外周血中NK细胞数较正常人明显减少,患者血清中HBV DNA水平与NK细胞水平成负相关,提示NK细胞的减少可能与HBV感染的慢性化有关[14]。在本课题组关于替比夫定免疫调节作用的前期实验研究中,观察到替比夫定治疗的小鼠的NK细胞杀伤活性明显高于环磷酰胺模型组[7],与吴氏[14]的临床研究结果相似,提示替比夫定对NK细胞的活性有一定的增强作用。
综上所述,替比夫定能够有效改善环磷酰胺所致免疫抑制小鼠细胞免疫功能,表明该药对机体的细胞免疫功能具有一定的增强作用。此可能是接受替比夫定治疗慢性乙型肝炎患者发生HBeAg血清转换率较高以及获得满意疗效后停药后复发率较低的重要原因。
[1] Wang Y, Thongsawat S, Gane E.J, et al. Efficacy and safety of continuous 4-year telbivudine treatment in patients with chronic hepatitis B. J Viral Hepatol, 2013, 20: e37-e46.
[2] Chen DB, Chen YM, Liu J, et al. Durability of efficacy after telbivudine off-treatment in chronic hepatitis B patients. J Clin Vir, 2014, 59: 50-54.
[3] 朱斌, 张平, 禹萌, 等. 替比夫定对HBeAg+慢性乙型肝炎患者外周血树突状细胞及淋巴细胞亚群的影响. 世界华人消化杂志, 2011, 19: 2577-2582.
[4] 王煜, 焦运, 彭晓明, 等. 替比夫定对HBeAg阳性慢性乙型肝炎患者细胞免疫应答的影响. 中华传染病杂志, 2011, 29: 623-624.
[5] 黄鸿菲, 何登明, 吴全新, 等. HBeAg阳性慢性乙型肝炎孕妇替比夫定治疗前后血清 Thl/Th2型细胞因子的水平变化. 临床肝胆病杂志, 2014, 30: 522-526.
[6] Wu ZG, Yan WM, Guo W. Telbivudine preserves T-helper 1 cytokine production and downregulates programmed death ligand 1 in a mouse model of viral hepatitis. J Viral Hepat, 2010, 17(Suppl.1): 24-33.
[7] 宗雪萍, 周跃, 汤伟, 等. 替比夫定对小鼠免疫功能的影响. 江苏医药, 2012, 38: 2798-2800.
[8] 谭晓慧, 李阳, 汪晓莺, 等. 季德胜蛇药对小鼠细胞免疫功能的影响. 中国临床医学, 2011, 18: 467-468.
[9] 汤伟, 孙伟红, 汪晓莺, 等. 肝素对慢性乙型肝炎患者树突状细胞免疫功能的作用. 中华肝脏病杂志, 2006,14: 233-234.
[10] 张敏, 杨丽莎, 彭德珍, 等. 慢性HBV感染不同免疫状态及乙型肝炎肝硬化外周血T、B细胞亚群和NK细胞的变化及意义. 实用医学杂志, 2014, 30: 3233-3236.
[11] Gehring AJ, Ann D’Angelo J. Dissceting the dendritic cell controversy in chronic hepatitis B virus infection. Cell Mol Immunol, 2015, 12: 283-291.
[12] 曾志励, 吴健林, 吴继周. 乙型肝炎患者外周血T淋巴细胞亚群比例和Th1/Th2细胞因子水平检测及其临床意义. 吉林大学学报:医学版, 2012, 38: 555-558.
[13] 王平忠, 黎志东, 于海涛, 等. NK细胞的活化及其介导的抗病毒作用. 细胞与分子免疫学杂志, 2012, 28: 330-332.
[14] 吴杭源, 尤德宏. 替比夫定对 e 抗原阳性慢性乙型肝炎患者外周血NK细胞水平的影 响. 现代中西医结合杂志, 2013, 22: 621-622.
(本文编辑:易玲)
江苏省高校自然科学研究面上项目(11KJB10008)
226001 江苏 南通大学附属医院感染性疾病科(顾宇峰,黄莉莉,宗雪萍,谭晓慧,汤伟);南通大学医学院病原生物系(孙伟)
汤伟,Email:tdfy16302@163.com
2016-05-11)
——以《推销员之死》对话选段为例

