水旱条件下水稻剑叶蒸腾与光合性状QTL分析
邹德堂,王江旭,王敬国,刘化龙,孙健,李承欣,李晨煦,赵宏伟
(东北农业大学农学院,哈尔滨 150030)
水旱条件下水稻剑叶蒸腾与光合性状QTL分析
邹德堂,王江旭,王敬国,刘化龙,孙健,李承欣,李晨煦,赵宏伟
(东北农业大学农学院,哈尔滨 150030)
研究抗旱品种小白粳子与不耐旱品种空育131构建含有207个株系的F9重组自交系群体,分别在水旱两种环境下作蒸腾速率、气孔导度、净光合速率表型与遗传分析。结果表明,水旱条件下水稻剑叶蒸腾速率、气孔导度和净光合速率表型值均呈极显著正相关,三者联系紧密。水旱条件下共定位到13个加性QTL,分布于2、3、5、6、7、9、11号染色体上,共解释68.7%表型变异。定位到12对上位性QTL,除第10号染色体均有分布,共解释106.2%表型变异。qE-9-2和qGS-9位于同一区间RM1328-RM409,水旱两种条件下仅检测到qPn-6-1一个净光合速率的QTL,且干旱条件下加性效应和贡献率均高于正常水分,qE-9-2、qGs-9、qPn-6-1、qE-6、qE-9-3和qGs-11-1所在区间均与之前报道基因位置重合或相近。
水稻;干旱;光合速率;蒸腾速率;气孔导度;QTL
邹德堂,王江旭,王敬国,等.水旱条件下水稻剑叶蒸腾与光合性状QTL分析[J].东北农业大学学报,2016,47(10):1-8.
Zou Detang,Wang Jiangxu,Wang Jingguo,et al.Analysis of quantitative trait loci for photosynthetic and transpiration traits of flag leaf in rice[J].Journal of Northeast Agricultural University,2016,47(10):1-8.(in Chinese with English abstract)
蒸腾作用是水稻水分代谢重要环节,影响水稻体内无机盐和矿质离子吸收和运输。气孔是水稻叶片气体进出主要通道,水稻气孔运动与叶片光合、呼吸和蒸腾密切相关,受环境影响[1-2]。净光合速率与蒸腾作用密不可分,与蒸腾速率、气孔导度等蒸腾性状共同影响水稻产量。
目前水稻气孔相关性状生理研究成果丰硕,王建林等研究气孔密度与孔径,气孔导度与气孔密度和气孔开度相关关系[3-6],陈温福等认为籼稻气孔密度和光合速率均大于粳稻[7-8]。由于受环境影响大、难以测量等因素制约,气孔性状遗传研究报道较少。近年来,关于水稻光合作用相关数量性状基因位点研究较多。Hu等在水旱条件下检测到光合速率位点qPR2、qPR10[9]。张强等利用98个BC1F5回交重组自交系定位到净光合速率、蒸腾速率QTL、qPn6、qTr-10[10]。胡茂龙等定位到qPn3、qPn4、qPn5[11]。但研究多局限在光合性状定位分析上,或仅在单一环境下研究光合与蒸腾的遗传基础。水旱条件下结合分析蒸腾作用与光合作用研究鲜有报道。
本研究采用天然雨养处理还原大田生产环境下的干旱条件,探究干旱胁迫与正常水分条件下水稻剑叶蒸腾速率、气孔导度、净光合速率相互关系及遗传基础,以期为水稻高光效育种、抗旱改良育种以及MAS分子辅助育种提供理论参考。
1 材料与方法
1.1 材料
粳稻空育131(K131)和旱稻小白粳子(XJ)构建的F9代重组自交系群体,共207个株系。空育131曾是黑龙江省广泛种植的高产粳稻品种,抗旱性较差,原产地日本。小白粳子是旱稻品种,抗旱性强,两亲本抗旱性差异较大,二者构建的重组自交系群体适合抗旱研究。
1.2 田间试验
207个重组自交系和亲本于2015年种植于东北农s业大学香坊实验实习基地,设置干旱处理和正常灌溉对照。由于我国东北部水资源分布不均,水稻生育前期降雨量相对较少,本试验干旱处理设置为天然雨养干旱[12-14]模拟大田生产旱情。全生育时期实验基地月平均降雨量448.0 mm,日平均气温14.5~33.5℃。干旱处理从分蘖期开始断水,完全依靠天然降雨供水,全程观测土壤水势,当水势低于-50 kPa时补水防止株系死亡[15]。试验材料于4月12日浸种,4月20日播种,5月25日移栽。4 m行长,两行区,株距10 cm,行距30 cm,每穴一株,常规水肥管理。
1.3 数据测量
断水后两周开始测量。蒸腾速率、气孔导度、净光合速率均由便携式光合仪CI-340测量(CID,Camas,WA,USA)。测量工作选晴天光线充足条件下完成,时间为9:30~11:30和13:00~15:00。为确保测量过程中叶室里CO2浓度稳定在(350±10)μmol·mol-1,仪器上连接气体缓冲系统。叶室内相对湿度40%,温度25℃。每株测量最上面3片剑叶,每个株系测量3株。
1.4 遗传图谱构建与数据分析
遗传图谱包括105个从www.gramene.org上筛选的SSR标记,利用MapMaker/EXP 3.0软件分析标记数据,采用Kosambi函数将重组率转换为遗传距离,MapChart 2.2软件绘制遗传连锁图。连锁图谱全长1 285.13 cM,平均图距12.23 cM。基因组DNA从207个F9RIL株系以及亲本中提取,采用改良CTAB法[16]。QTL定位采用QTL IciMapping v3.0完备区间作图法(ICIM),设定阈值为LOD≥2.5。QTL命名原则参照文献[17]。基本数据分析采用SPSS 13.0。
2 结果与分析
2.1 RIL群体表型分析
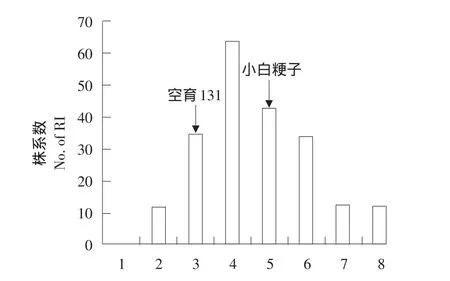
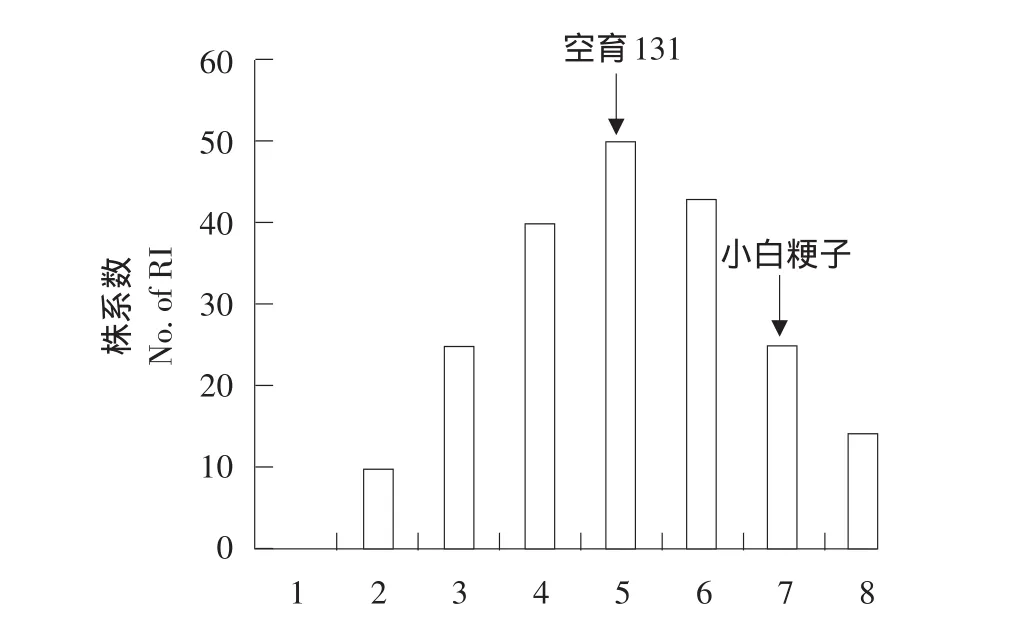
如表1所示,旱稻亲本小白粳子无论水旱条件,剑叶蒸腾速率、气孔导度、净光合速率三项指标皆明显高于不抗旱亲本空育131,两亲本抗旱性存在差异。对两亲本和群体来说,干旱条件下蒸腾速率和气孔导度均值相对正常水分条件下明显降低(空育131分别降低28.2%,24.3%;小白粳子分别降低21.1%,10.8%;群体分别降低9.4%,18.9%),然而净光合速率却有所不同,干旱条件下小白粳子均值反而升高20.2%,空育131和群体均值则均呈降低趋势。水旱条件下,蒸腾速率和净光合速率群体均值皆表现为超亲分离。各指标偏度和峰度均小于1,且符合正态分布(见图1),说明蒸腾速率、气孔导度、净光合速率为受多基因控制的数量性状,符合QTL作图标准。
2.2 水旱环境下各指标相关性分析
水稻剑叶蒸腾速率、气孔导度、净光合速率三者水旱条件下皆呈极显著正相关(见表2)。值得注意的是,净光合速率与蒸腾速率和气孔导度相关系数正常水分条件下为0.214**、0.220**,干旱条件下为0.522**、0.448**,均小于另两者之间在正常水分下相关系数0.469**和干旱下相关系数0.609**。说明水稻剑叶蒸腾速率与气孔导度之间相关更密切。另外在干旱条件下所有相关系数高于正常水分,说明极端条件下,植物自我保护机制可能使其生理生化活动进一步协同作用以维持生命。

表1 水旱条件下群体和两亲本蒸腾速率、气孔导度、净光合速率表型变异Table 1Phenotypic variation of traits related to transpiration rate,stomatal conductance and net photosynthetic rate in RIL lines and their parents under two water conditions
DS·E[mmol(H2O)m-2s-1]

WW·E[mmol(H2O)m-2s-1]
DS·Gs[mmol(H2O)m-2s-1]

WW·Gs[mmol(H2O)m-2s-1]

图1 水旱条件下群体与亲本频率分布Fig.1Frequency distribution of RIL lines and their parents under two water conditions

WW·Pn[μmol(CO2)m-2s-1]

表2 蒸腾速率、气孔导度、净光合速率之间相关性Table 2Relationship of transpiration rate,stomatal conductance,net photosynthetic rate.
2.3 蒸腾速率、气孔导度、净光合速率加性QTL分析
正常水分条件下共检测到加性QTL 7个,蒸腾速率QTL 3个、气孔导度QTL 3个、净光合速率QTL 1个(见表3)。这些加性QTL分别位于第2、3、5、6、7号染色体,LOD值为2.27~4.71,共解释表型变异37.98%,单个QTL可解释的表型变异为3.90%~9.58%。正常水分条件下只有气孔导度的两个QTL qGs-2-1和qGs-3-2增效等位基因来自空育131(-3.14,-3.31),其余均来自小白粳子。干旱胁迫下共检测到6个加性QTL,蒸腾速率QTL 3个、气孔导度QTL 2个、净光合速率QTL 1个。净光合速率QTL qPn-6-1两环境下均被检测到,且两种环境下均只检测到加性QTL,说明RM510-RM586区间内很有可能含有净光合速率的主效基因。蒸腾速率QTL qE-9-2和气孔导度QTL qGs-9位于同一标记区间RM1328-RM409(见表3,图2),表明此区间内可能含有同时控制两性状的基因。干旱条件下的加性QTL分别位于第3、6、9、11号染色体,LOD值为2.22~5.76,共解释表型变异41.07%,单个QTL可解释的表型变异为3.83%~10.85%。其中仅qGs-11-1和qE-3增效等位基因来自空育131(-4.96,-0.16),其他均来自小白粳子。除qPn-6-1外所有QTL仅在单一环境下检测到。
2.3 蒸腾速率、气孔导度、净光合速率上位性QTL分析
正常水分条件下检测到6对上位性QTL,其中蒸腾速率1对,气孔导度3对,净光合速率2对(见表4),涉及第1、2、3、7、8、11号染色体,单个上位性位点贡献率为3.24%~17.17%。6对上位性QTL中,3对是亲本型起增效效应,另外3对是重组型起增效效应。干旱胁迫下共检测到6对上位性作用位点,其中蒸腾速率3对,气孔导度2对,净光合速率1对(见表4),分别位于1、2、4、5、6、7、9、11号染色体,单个贡献率6.28%~12.99%。只有qGs-5-1-qGs-6和qE-2-qE-7-2为
亲本型起增效效应,其余则为重组型起增效效应。干旱条件下,气孔导度主效QTL qGs-11-1参与上位性互作。qGs-11-2作为上位性QTL同时参与水旱两环境下的上位性互作,说明加性效应和上位性效应同时控制气孔导度表型变异,以及非等位基因间互作的复杂性。

表3 水旱条件下蒸腾速率、气孔导度、净光合速率加性QTLTable 3Additive QTLs for stomatal conductance,photosynthetic rate,and transpiration rate under two water conditions

表4 水旱条件下蒸腾速率、气孔导度、净光合速率上位性QTLTable 4Epistatic QTLs for stomatal conductance,photosynthetic rate,and transpiration rate under two water conditions

图2 水旱条件下蒸腾速率、气孔导度、净光合速率加性QTL在连锁图谱上位置Fig.2QTL position for transpiration rate(E),stomatal conductance(Gs)and net photosynthetic rate(Pn), on the genetic linkage groups under two water conditions
3 讨论
研究结果显示,干旱胁迫下水稻剑叶蒸腾速率、气孔导度和净光合速率表型值相对正常水分条件均呈下降趋势,且三者互为正相关,和前人研究结果一致[10、18-19]。说明植株在干旱逆境下生长受到抑制,但蒸腾与光合协同作用代谢途径互通3个性状联系紧密。近年来由于分子标记技术迅速发展,育种工作者对水稻蒸腾与光合分子遗传也有一定研究。张强等利用日本晴和kasalath构建的BC1F5群体检测到控制蒸腾速率的QTL qPn-6和净光合速率QTL qTr-10[10]。Teng等通过DH群体检测到1个QTL与气孔导度相关,位于第4染色体上标记Y34LCDO456间[20]。Hu等以CSSL群体为材料,发现3个QTL与水稻剑叶净光合速率有关,位于第3、4、5号染色体上,1个QTL与水稻剑叶蒸腾速率有关,位于第1染色体的标记C970附近[21]。本研究利用大田模拟实际生产中的干旱灾害,在水旱条件下共定位到13个加性QTL,分布于2、3、5、6、7、9、11号染色体,可解释3.83%~10.85%表型变异。同时定位到12对上位性QTL,除第10号染色体均有分布,贡献率为3.24%~17.17%。干旱条件下检测到的蒸腾速率QTL qE-9-2和气孔导度QTL qGs-9位于同一区间RM1328-RM409,且在水旱条件下蒸腾速率和气孔导度表型值均呈正相关,说明该区间很可能存在1个或多个控制两性状的基因。此外,该区间还包含通过调控叶片远轴面厚壁组织细胞的程序化死亡控制水稻叶片卷曲的抗旱相关基因SLL1[22],同时与张强等[10]定位的净光合速率上位性QTL qPn9-3位置重合。揭示水稻光合作用相关的分子遗传网络复杂性和协同性,也从一定程度上证实qE-9-2,qGs-9准确性,而RM1328-RM409对水稻剑叶蒸腾速率,气孔导度以及蒸腾,光合相关基因精细定位、分离与克隆有一定参考价值。在水旱两种条件下净光合速率遗传分析中,分别只检测到qPn-6-1一个QTL,且两条件下加性效应一致,增效等位基因均来自抗旱亲本小白粳子,且干旱条件下加性效应和贡献率(1.37,10.35%)均高于正常水分(1.07,4.95%)。说明qPn-6-1是不受环境影响稳定表达的QTL,且在干旱胁迫下更活跃。此外,qPn-6-1与兴旺等定位到的单株有效穗数QPN-6-1位置重合[23],这可能是一因多效或紧密连锁引起。同时该区间内还包含1个调控籽粒淀粉和叶绿体大小基因SSG6,暗示qPn-6-1可能与水稻干物质积累及产量形成有一定联系,应进一步研究。目前水稻剑叶光合速率QTL研究较少[10-11,20]。本研究中仅在第6染色体定位到净光合速率QTL,与Teng和张强结果一致,但与胡颂平等结果不同,可能是由于所用群体和分子标记种类不同造成。可以推测,水稻第6号染色体与其光合速率遗传变异密不可分。本研究中qE-6和Xing等在2013年定位到的单株产量QTL qYP-6-2位置完全重合[16];qE-9-3和张强等报道的剑叶全氮含量QTL qTLN-9-10处于同一区间[10];qGs-11-1与胡茂龙等定位到的qTLN-11有共用区间[26]。具有不同功能的QTL同时存在或共用同一区间,说明其可能紧密连锁或这些区间存在一因多效。光合相关性状遗传网络复杂性尚需进一步探索。
[ 1 ] Casson S, Gray J E. Influence of environmental factors on stoma⁃tal development[J]. New Phytol, 2008, 178(1): 9-23. .
[ 2 ] Hetherington A M, Woodward F I. The role of stomata in sensing and driving environmental change[J]. Nature, 2003, 424(6951):901-908.
[ 3 ] 王建林, 于贵瑞, 王伯伦, 等. 北方粳稻光合速率、气孔导度对光强和CO2浓度的响应[J], 植物生态学报, 2005, 29(1): 16-25.
[ 4 ] Bergmann D C. Integrating signals in stomatal development[J].Current Opinion in Plant Biology, 2004, 7(1): 26-32.
[ 5 ] Maruyama S, Tajima K. Leaf conductance in japonica and indicarice varieties. I. Size, frequency, and aperture of stomata[J]. Japa⁃nese Journal of Crop Science, 1990, 59(4): 801-808.
[ 6 ] Ohsumi A, Kanemura T, Homma K, et al. Genotypic variation of stomatal conductance in relation to stomatal density and length in rice (Oryza sativa L. )[J]. Plant Production Science, 2007, 10(3):322-328.
[ 7 ] 陈温福, 徐正进, 张龙步, 等. 水稻叶片气孔密度与气体扩散阻力和净光合速率关系的比较研究[J] 中国水稻科学, 1990, 4(4):163-168
[ 8 ] Tsunoda S, Fukoshima M T. Leaf properties related to the photo⁃synthetic response to drought in upland and lowland rice varieties[J].Annals of Botany, 1986, 58(4): 531-539.
[ 9 ] Hu S P, Zhou Y, Zhang L, et al. Correlation and quantitative traitloci analyses of total chlorophyll content and photosynthetic rate of rice (Oryza sativa) under water stress and well-watered condi⁃tions[J]. Journal of Integrative Plant Biology, 2009, 51(9): 879-888.
[10] 张强, 王春明, 翟虎渠, 等. 水稻剑叶光合性状的QTL分析[J],江苏农业学报, 2008, 24(2): 114-122.
[11] 胡茂龙, 张迎信, 孔令娜, 等. 水稻光合作用及相关生理性状的QTL分析[J]. 作物学报, 2007, 33(2): 183-188.
[12] Gu J, Yin X, Zhang C. Linking ecophysiological modelling with quantitative genetics to support marker-assisted crop design for improved yields of rice (Oryza sativa) under drought stress[J]. An⁃nals of Botany, 2014, 114(3): 499-511.
[13] Prince S J, Beena R, Gomez S M. Mapping consistent rice (Oryza sativa L. ) yield QTLs under drought stress in target rainfed envi⁃ronments[J]. Rice, 2015, 8(1): 1-13.
[14] Saikumar S, Saiharini A, Patil V. Contrasting rice backcross in⁃bred lines (BILs) for grain yield and heading under lowland repro⁃ductive stage moisture stress[J]. European Journal of Agronomy,2015, 70: 85-97.
[15] Kumar R, Venuprasad R, Atlin G N. Genetic analysis of rainfed lowland rice drought tolerance under naturally-occurring stress in eastern India: heritability and QTL effects[J]. Field Crops Re⁃search, 2007, 103(1): 42-52.
[16] Xing W, Zhao H, Zou D. Detection of main-effect and epistatic QTL for yield-related traits in rice under drought stress and nor⁃mal conditions[J]. Canadian Journal of Plant Science, 2014, 94(4): 633-641.
[17] McCouch S R,Cho Y G,Yano M.Report on QTL nomenclature[J]. Rice Genet Newsl,1997,14(11):11-13.
[18] Wang S G,Jia S S,Sun D Z,et al.Genetic basis of traits related to stomatal conductance in wheat cultivars in response to drought stress[J].Photosynthetica,2015,53(2):299-305.
[19] 胡颂平,梅捍卫,邹桂花,等.正常与水分胁迫下水稻叶片叶绿素含量的QTL分析[J].植物生态学报,2006,30(3):479-486.
[20] Teng S,Qian Q,Zeng D L,et al.QTL analysis of leaf photosyn⁃thetic rate and related physiological traits in rice(Oryza sativa L.)[J].Euphytica,2004,135(1):1-7.
[21] Hu M L,Zhang Y X,Kong L N,et a1.Quantitative trait locus for photosynthesis and its related physiological traits in rice(Oryza sa⁃tiva L.)[J].Aeta Agro Sin,2007,33(2):183-188.
[22] Zhang G H,Xu Q,Zhu X D,et al.SHALLOT-LIKE1 is a KANA⁃DI transcription factor that modulates rice leaf rolling by regulat⁃ing leaf abaxial cell development[J].The Plant Cell,2009,21(3): 719-735.
[23] 兴旺.干旱胁迫下粳稻产量及相关性状的QTL定位及互作研究[D]哈尔滨:东北农业大学,2014
[24] Wang C,Yasui H,Yoshimura A,et al.Inheritance and QTL map⁃ping of antibiosis to green leafhopper in rice[J].Crop science, 2004,44(2):389-393.
[25] Su C C,Wan J,Zhai H Q,et al.A new locus for resistance to brown planthopper identified in the indica rice variety DV85[J]. Plant Breeding,2005,124(1):93-95.
[26] 胡茂龙,王春明,杨权海,等.水稻光合功能相关性状QTL分析[J].遗传学报,2005,32(8):818-824.
Analysis of quantitative trait loci for photosynthetic and transpiration traits of flag leaf in rice
ZOU Detang,WANG Jiangxu,WANG Jingguo,LIU Hualong,SUN Jian,LI Chengxin,LI Chenxu,ZHAO Hongwei(School of Agriculture,Northeast Agricultural University, Haribin 150030,China)
Take a F9RIL contain 207 lines derived from the upland rice XJ and drought sensitive variety K131 to do the phenotype and genetic analysis of transpiration rate,stomatal conductance and photosynthetic rate under normal irrigation and drought stress.The results showed that transpiration rate, stomatal conductance and net photosynthetic rate were positively correlated under both water conditions. Total 13 additive QTLs distributed on chrimosome 2,3,5,6,7,9,11 were detected under both water conditions,and 68.7%of the phenotypic variation were explained.Total 12 epistatic pairs were detected and could explain 106.2%of the phenotypic variation which distributed on all of the chrimosomes except the 10th. qE-9-2 andqGS-9 were located in the same interval RM1328-RM409.Only one QTLqPn-6-1 could be detected for Pn under both water condirions whose additive effects and contributions under drought stress were all higher than that under normal irrigation.The locations ofqE-9-2,qGs-9,qPn-6-1,qE-6,qE-9-3 and qGs-11-1 were nearby or coincided with previously reported genes.
rice;drought stress;photosynthetic rate;transpiration rate;stomatal conductance;QTL
S511
A
1005-9369(2016)10-0001-08
时间2016-10-26 16:28:00[URL]http://www.cnki.net/kcms/detail/23.1391.S.20161026.1628.002.html
2016-07-22
黑龙江省重大科技招标项目(GA14B102);黑龙江省粮食产能提升协同创新中心项目
邹德堂(1965-),男,教授,博士,博士生导师,研究方向为水稻遗传育种。E-mail:zoudt@163.com

