VPK合成、活性及吸收转运特性研究
袁淑杰,丁辉,姜媛媛,夏吾炯*
(1.哈尔滨工业大学化工与化学学院,哈尔滨 150001;2.哈药集团技术中心,哈尔滨 150025)
VPK合成、活性及吸收转运特性研究
袁淑杰1,丁辉2,姜媛媛2,夏吾炯1*
(1.哈尔滨工业大学化工与化学学院,哈尔滨 150001;2.哈药集团技术中心,哈尔滨 150025)
候选新药VPK是哈药集团技术中心自主研发治疗脑卒中的一类新药。VPK以长春西汀为母核,经水解、缩合、环化、成盐反应制备而成,经元素分析、核磁共振、高分辨质谱、X-射线粉末衍生,X-射线单晶衍射对化合物进行结构确证,经PDE1活性研究显示,VPK和长春西汀均对PDE1有抑制作用,其IC50值分别为17.40和1.97 μmol·L-1,VPK在脑卒中治疗领域疗效较好,采用Caco-2单层细胞模型测定候选药物VPK吸收及外排转运特性,结果表明,VPK在顶端到基底端(A-B)及基底端到顶端(B-A)方向均表现高渗透,该供试化合物是外排转运体底物可能性较小。
VPK;结构确证;PDE1;Caco-2细胞模型;吸收;转运;UPLC/MS/MS
袁淑杰,丁辉,姜媛媛,等.VPK合成、活性及吸收转运特性研究[J].东北农业大学学报,2016,47(10):25-33.
Yuan Shujie,Ding Hui,Jiang Yuanyuan,et al.Study on the synthesis and activity of VPK and on its absorption and transportation characteristics[J].Journal of Northeast Agricultural University,2016,47(10):25-33.(in Chinese with English abstract)
长春西汀(Vinpocetine)是从夹竹桃科小蔓长春花中提取的吲哚类生物碱长春胺经结构改造所得的衍生物[1-3],具有较高脂溶性,易通过血脑屏障形成较高浓度而发挥疗效。长春西汀不仅能选择性增加患者脑血流量,改善血液流变学参数,同时还可增加大脑神经元对缺氧缺血耐受性[4-6],主要治疗脑血管等相关疾病,包括缺血性及出血性脑血管疾病恢复期和急性期,血管性痴呆,认知功能障碍等[7-8]。虽然长春西汀已得到广泛应用,但仍存在如水溶性较差,口服片剂的生物利用度低,代谢稳定性差,容易被水解成活性较低的酸等问题。因此,为提高生物利用度和血脑屏障透过率,延长半衰期,哈药集团技术中心在长春西汀结构基础上,设计合成一系列长春西汀类衍生物。通过前期的活性和成药性筛选,获得候选新药VPK(见图1),有望在脑卒中治疗领域获得更好的治疗效果。
Caco-2细胞单层模型是一种广泛用于研究小肠吸收的模型[9-11],可在细胞水平提供药物分子透过小肠粘膜吸收、分布及转运等综合信息,与口服药物的体内小肠上皮细胞吸收过程相关性良好。Caco-2细胞系来自人体结肠腺癌细胞(The human colon carcinoma cell line),形态学、标志酶功能表达与渗透特征与小肠类似。利用Caco-2细胞单层模型,分析候选药物吸收和转运特性,可初步判断给药途径。
李谦等研究候选药物TW918在Caco-2细胞模型中的吸收、转运特性及作用机制[12],考查时间、pH及抑制剂等对TW918吸收影响,测定药物在不同转运时间双向转运速度,计算TW918表观渗透系数;徐小昆等建立体外Caco-2细胞模型,考查新补骨脂异黄酮的吸收转运机制[13];杨秀伟等利用Caco-2细胞模型研究羟基芍药苷等6个芍药苷类单萜糖苷吸收及双向转运[14]。目前,Caco-2细胞单层模型已成为新药研发中评价药物口服吸收最有效方法[15-17]。
建立Caco-2细胞单层模型,研究候选新药VPK吸收转运过程,测定穿过Caco-2细胞模型的双向渗透性,测试该化合物是否被外排转运,预测药物吸收,为制剂研发提供科学依据,为安全、有效临床应用奠定基础。
1 材料与方法
1.1 药品与试剂
1.1.1 活性检测用试剂
①反应缓冲液:10 mmol·L-1Tris-HCl,pH 7.5,5 mmol·L-1氯化镁,0.01%Brij35,1 mmol·L-1DTT和1%DMSO;
②酶底物:1 mol·L-1cAMP或cGMP(Ca2+-钙调蛋白作为PDE1A的辅助因子);
③检测试剂Transcreener®AMP2/GMP2抗体;AMP2/GMP2 AlexaFluor 633标记物(Life technolo⁃gy,美国)。
1.1.2 Caco-2细胞吸收和转运试验用试剂
VPK供试品(批号201408301,含量98.81%),由哈药集团技术中心研制;对照化合物阿替洛尔、普萘洛尔、地高辛及内标甲苯磺丁脲购自美国Sigma-Aldrich公司;MEM培养基、Trypsin、EDTA、胎牛血清(FBS)购自美国Gibco公司;L-谷氨酰胺、丙酮酸钠购自国药集团;青霉素-链霉素双抗购自美国HyClone公司;P-糖蛋白抑制剂Elacridar(GF120918A)购自加拿大TRC公司。
1.2 Caco-2细胞吸收和转运试验用细胞株
人结肠腺癌细胞系Caco-2细胞(产品编号:HTB-37)购自美国模式菌种收集中心(ATCC)。
1.3 仪器
1.3.1 合成及结构解析用仪器
玻璃反应瓶(5 L、3 L);旋转蒸发仪(上海耀裕仪器设备有限公司;元素分析仪(Vario ELⅢ,Elementar);飞行时间液质联用仪(G6224A,安捷伦);核磁共振谱仪(AV400,Bruker);X射线衍射仪(Bruker D8 Advance);X-射线单晶衍射仪(Bruker APEX-ⅡCCD)。
1.3.2Caco-2细胞吸收及转运试验用仪器
96孔细胞培养板(BD Inc.#359274);纯水仪(PURELAB Classic,ELGA,英国);生物安全柜(NU-425-400E,NuAir ClassⅡ;美国);液体处理工作站(PP-550DS,Apricot Designs Inc.,CA);恒温培养箱(Thermo HERA Cell 240,美国);M2e读板仪(Molecular Device,澳大利亚);Waters Aquity UPLC超高效液相色谱仪;API 4000三重四级杆质谱(美国AB Sciex公司)
1.4 Caco-2细胞吸收及转运分析条件
1.4.1 液相色谱条件
色谱柱为Acquity UPLC BEH C18,1.7 μm,2.1× 50 mm色谱柱;以含0.2%甲酸的水溶液为流动相A;以含0.2%甲酸的乙腈溶液为流动相B;进样体积:10 μL,流速0.6 mL·min-1,梯度洗脱程序见表1。
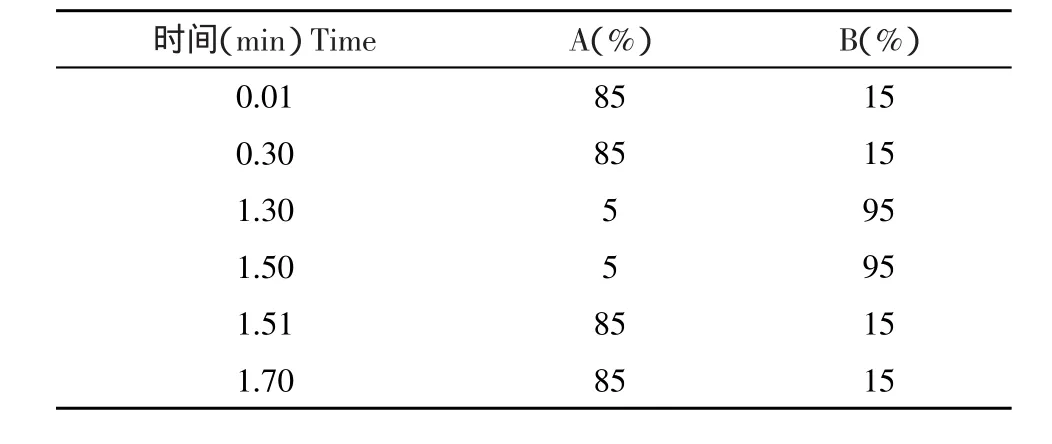
表1 液相梯度洗脱程序Table 1Procedure of liquid chromatography gradient elution
1.4.2 质谱条件
电喷雾离子源(ESI源);多反应监测;正离子模式;气帘气压力20 kPa,雾化器压力50 kPa,加热辅助气压力60 kPa,电喷雾电压5.5 kV,雾化器温度600℃,入口电压10 V,碰撞室出口电压15 V。
1.5 方法
1.5.1 合成方法
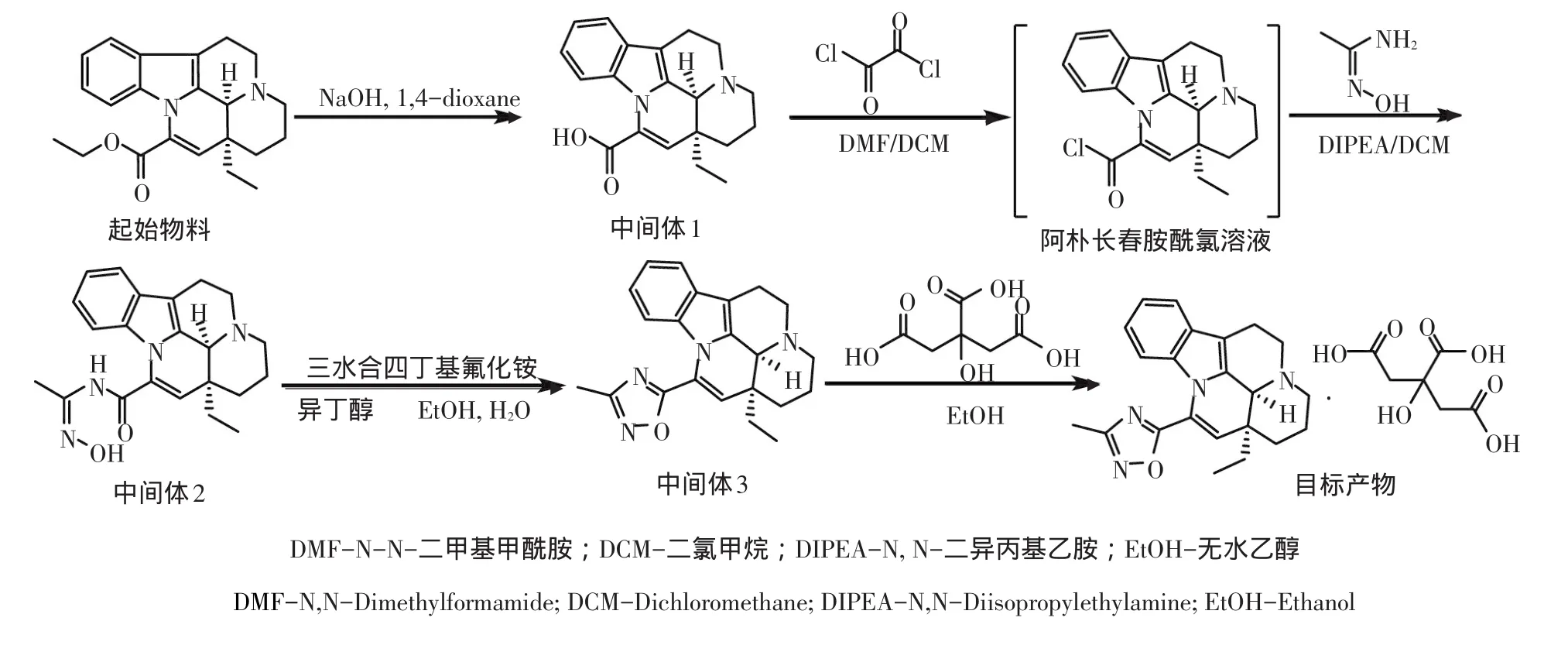
图2 VPK合成路线Fig.2Synthetic route of VPK
VPK合成路线见图2。
1.5.1.1 水解反应
分别将起始物料长春西汀酯500 g、水1 L,二氧六环4 L加入反应瓶,并加入NaOH 1.5 kg,在20~30℃温度下搅拌反应16 h,经过滤、干燥得中间体1。
1.5.1.2 缩合反应
将中间体1 200 g、二氯甲烷1.8 kg和DMF 1.8 g分别加入反应瓶,搅拌,调节温度至(5±5)℃。将草酰氯200 g加入反应瓶,在(10±10)℃条件下搅拌2 h,浓缩反应液,然后加入二氯甲烷1 L,得到阿朴长春胺酰氯二氯甲烷溶液。将DIEA 200 g、N-羟基乙脒50 g和二氯甲烷140 mL分别加入反应瓶,降温;将阿朴长春胺酰氯二氯甲烷溶液滴入反应瓶,搅拌30 min。加入水700 mL,分液,有机层用饱和食盐水700 mL洗涤,用无水硫酸钠干燥,并浓缩滤液。在搅拌条件下,向所得浓缩物中加入正庚烷5.1 L,继续搅拌20~30 min后,过滤、干燥即得中间体2 459 g,收率为80%~90%。
1.5.1.3 环化反应
将中间体2 218 g、三水合四丁基氟化铵130.8 g和异丁醇2.1 L分别加入反应瓶,升温至85~100℃,搅拌4~5 h。降温至50~60℃,转移至旋蒸瓶,在40~45℃减压浓缩;浓缩物中加入水2 L,在15~20℃搅拌0.5~1 h后过滤,收集滤饼,得到的固体在45~50℃真空干燥16 h。烘干后的固体转移到反应瓶,加入无水乙醇1.4 L和水450 mL,升温至85~95℃,搅拌20~30 min,热过滤,滤液静置析晶,抽滤所得固体在45~50℃下真空干燥4 h,得中间体3 125 g,收率为55%~65%。
1.5.1.4 成盐反应
在氮气保护下,将中间体3 111 g、无水柠檬酸66.6 g和无水乙醇1.7 L分别加入反应瓶,升温至(90±5)℃,搅拌0.5~1 h;降温至(25±5)℃,过滤,滤饼在45~50℃真空干燥,得目标产品153 g,收率为85%~95%,纯度达99.8%。
1.5.1.5 结构确证
得到产品VPK经元素分析、核磁共振、高分辨质谱、X-射线粉末衍生和X-射线单晶衍射,确认化合物结构。
1.5.2 PDE1活性研究方法
用新鲜配制的反应缓冲液稀释待测人源酶(购自Signal Chem)和底物;将酶溶液(浓度3 pmol·L-1)加入反应板孔;用Echo550将若干100%DMSO化合物溶液,按所需浓度加入含酶溶液微孔板,室温孵育10 min;加底物溶液至含酶和化合物溶液微孔板,起始反应;室温孵育1 h,同时震荡微孔板;加入检测混合物(示踪和抗体中的终止缓冲液)使酶反应停止,室温孵育90 min,同时震荡微孔板;用设备EnVision(PerkinElmer),Cy5 FP Ex FP 620,Em S-pol 688/P-pol 688,FP mirror D658 fp/ D688检测,用Ex/Em 620/688检测荧光偏振。
1.5.3 Caco-2细胞单层模型吸收和转运试验方法
1.5.3.1 细胞培养
细胞培养使用添加2 mmol·L-1L-谷氨酰胺,10%胎牛血清(FBS),100 U·mL-1青霉素-G以及100 mg·mL-1链霉素的MEM(Minimum essential media)培养基。细胞培养条件为37℃,5%CO2和95%相对湿度。待细胞长至80%~90%密集度,加入胰酶(0.05%,W/V)/EDTA(0.02%,W/V)消化液消化细胞种板。本试验采用第46代Caco-2细胞,将细胞以1×105细胞·cm-2密度接种Transwell-96孔板,并置于二氧化碳培养箱中培养22 d,期间每4~5 d更换1次培养基。
1.5.3.2 评估Caco-2细胞单层完整性
采用荧光黄外排试验(The lucifer yellow rejec⁃tion assay)测试Caco-2细胞层完整性。从顶端和基底端取荧光黄样品,采用M2e读板仪在425/528 nm(激发/发射)波谱处检测其相对荧光强度(RFU)。轻轻拍打,弃去细胞板内剩余溶液,加入含内标的乙腈溶液裂解细胞,轻轻振摇5 min后收集细胞裂解液。所有样品漩涡震荡后于20℃离心20 min,取上清用超纯水稀释储存于4℃,超高效液相色谱串联质谱(UPLC/MS/MS)分析测试。
1.5.3.3 双向转运试验
去除培养板中培养基,用预热转运缓冲液将细胞润洗2遍。将给药液和接收液分别加入对应的细胞板孔位,开始双向转运试验:顶端到基底端(A-B)和基底端到顶端(B-A)。将细胞板置于37℃,5%CO2和95%相对湿度条件下孵育120 min。
对于T0样品,取起始的给药液与转运缓冲液和含内标的乙腈溶液按一定比例混合。孵育120 min后,从给药端和接收端收集最终样品,同样与转运缓冲液和含内标的乙腈溶液按一定比例混合。
1.5.3.4 样品分析及数据处理
用超高效液相色谱串联质谱(UPLC/MS/MS)方法测定样品中VPK和对照化合物阿替洛尔(Atenolol)、普萘洛尔(Propranolol)及地高辛(Digoxin)浓度。
通过Analyst软件(版本号1.4.2)(AB Sciex, Framingham,MA,USA)采集和处理数据。以VPK与内标甲苯磺丁脲的峰面积比值对VPK浓度(nM)作线性回归分析。对于对照化合物地高辛,阿替洛尔和普萘洛尔,采用半定量分析方法,使用峰面积比(PAR)计算表观渗透系数(Papp,cm·s-1)和回收率数据。
表观渗透系数(Papp,cm·s-1)、回收率数据及外
排率数据使用如下公式计算。

式中,VR为接收孔中溶液体积(A面为0.075 mL,B面为0.25 mL);Area为细胞单层的相对表面积(0.0804 cm2);Time为孵育时间(s);C0为给药孔中药物起始浓度(μmol·L-1);VD为给药端体积(A面为0.075 mL,B面为0.25 mL);CD和CR分别为给药端和接收端最终浓度,Clysate为细胞裂解液中化合物浓度(μmol·L-1),VA为细胞裂解液体积(该试验中为0.075 mL)。
荧光黄透过率用以=下公式计算:
荧光黄透过率(%)

2 结果与分析
2.1 候选新药VPK合成
以长春西汀为起始原料,经水解、缩合、环化、成盐反应成功制备合成候选新药VPK,收率为85%~95%,纯度达99.8%。合成的VPK经元素组成分析、核磁共振、高分辨质谱、X-射线粉末衍射、X-射线单晶衍射确认结构。
2.1.1 药物元素组成
元素组成测试结果见表2,测定结果表明C、H、N含量实测值与理论值之差均<0.3%,元素组成与VPK样品分子式C22H24N4O·C6H8O7一致。
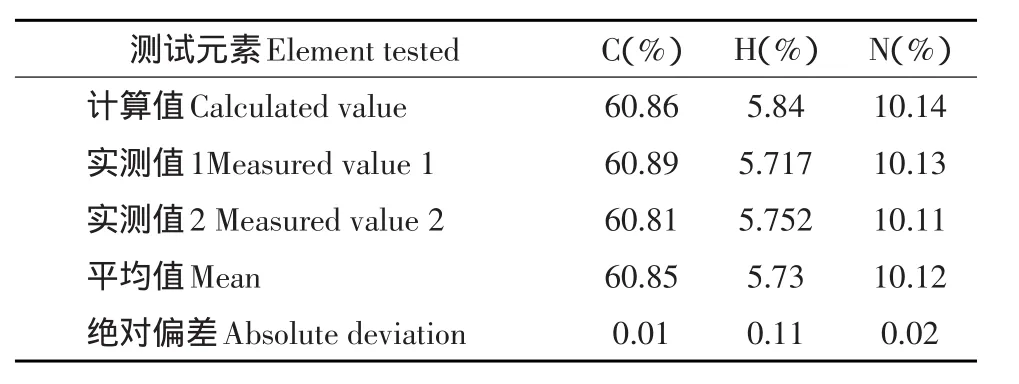
表2 VPK样品的元素组成测定结果Table 2Results of tests on the element composition of VPK
2.1.2 核磁共振(NMR)
测试溶剂为:氘代甲醇,温度为300 K。VPK
化合物编位见图3。氢谱测定结果见表3。

图3 VPK化合物编位Fig.3Numbering of positions of the compound VPK
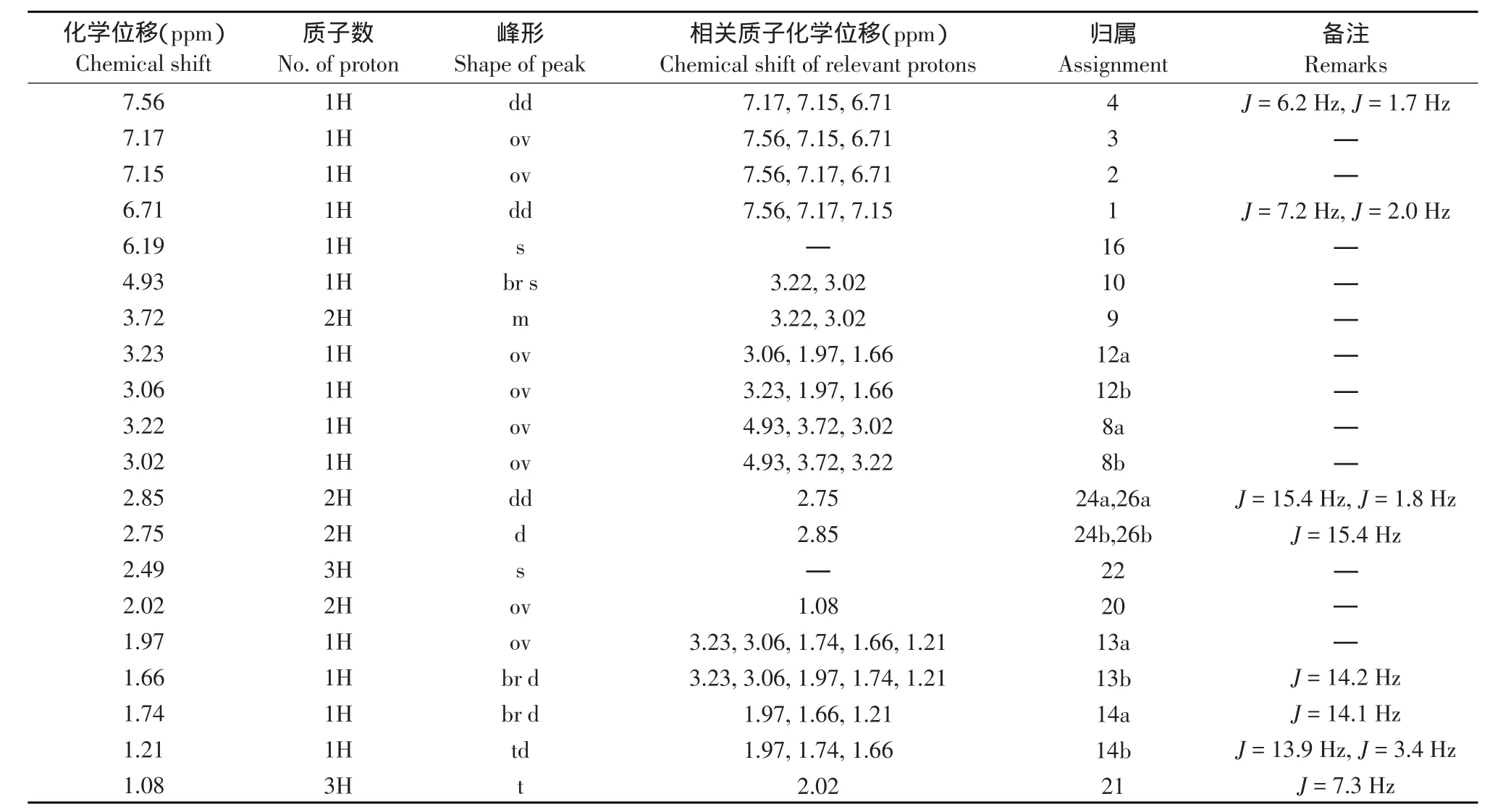
表3 VPK样品氢谱测定结果Table 3Results of the HNMR of VPK
2.1.3 高分辨质谱
本品[M+H]+峰质荷比计算值为361.2023,实测值为361.2024,相对误差为0.28,考虑到误差、不饱和度和分子组成的合理性,其对应分子组成应为C22H25N4O+;因此,本品分子组成应为C22H24N4O,与VPK样品游离碱分子组成一致。
2.1.4 X-射线粉末衍射
VPK的X-射线粉末衍射测定结果见图4。由图4可知,本品为结晶性粉末。
2.1.5 X-射线单晶衍射
VPK的游离碱测定X-射线单晶衍射,结果见图5~6。
由图5~6可知,本品分子式为C22H24N4O,相对分子质量为360.45,与样品游离碱的分子组成一致。可见本品分子结构图与样品游离碱结构相符。通过其晶体结构可以确定样品游离碱2个手性中心绝对构型,其立体结构41S,13aS。
2.2 PDE1活性研究
用DMSO作对照在AMP/GMP标准曲线上找出FP信号相对应酶活性,并转换成nmol·L-1产物浓度。使用GraphPad Prism分析并计算IC50值。试验结果见表4。结果表明,VPK和长春西汀对磷酸二酯酶均具有抑制作用,VPK对PDE1抑制作用是长春西汀8倍以上。
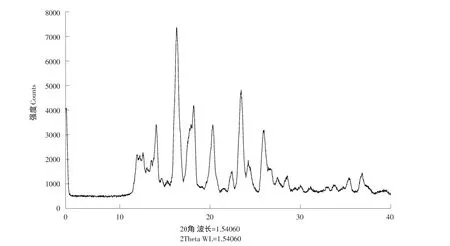
图4 VPK的X-射线粉末衍射测定结果Fig.4X-ray powder diffraction results of VPK
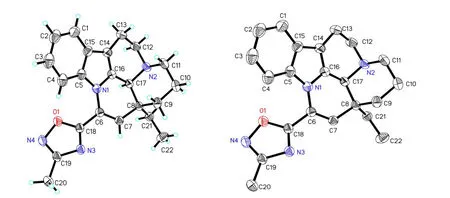
图5 VPK游离碱晶体结构椭球图Fig.5Rystal structure ORTEP of VPK free alkali

图6 VPK游离碱沿a轴晶胞堆积Fig.6Unit cell stacked plot of the VPK free alkali along axis a

表4 PDE1检测IC50测试结果Table 4IC50value of PDE1 detection
2.3 Caco-2细胞单层模型的吸收及转运
2.3.1 Caco-2完整性评价
荧光黄漏出标志物的跨膜通量作为测定Caco-2细胞模型的细胞完整性评价指标[18-20],荧光黄外排试验结果见表5。
表5结果表明,荧光黄透过率均<1%,符合可接受标准,Caco-2细胞层完整性良好。
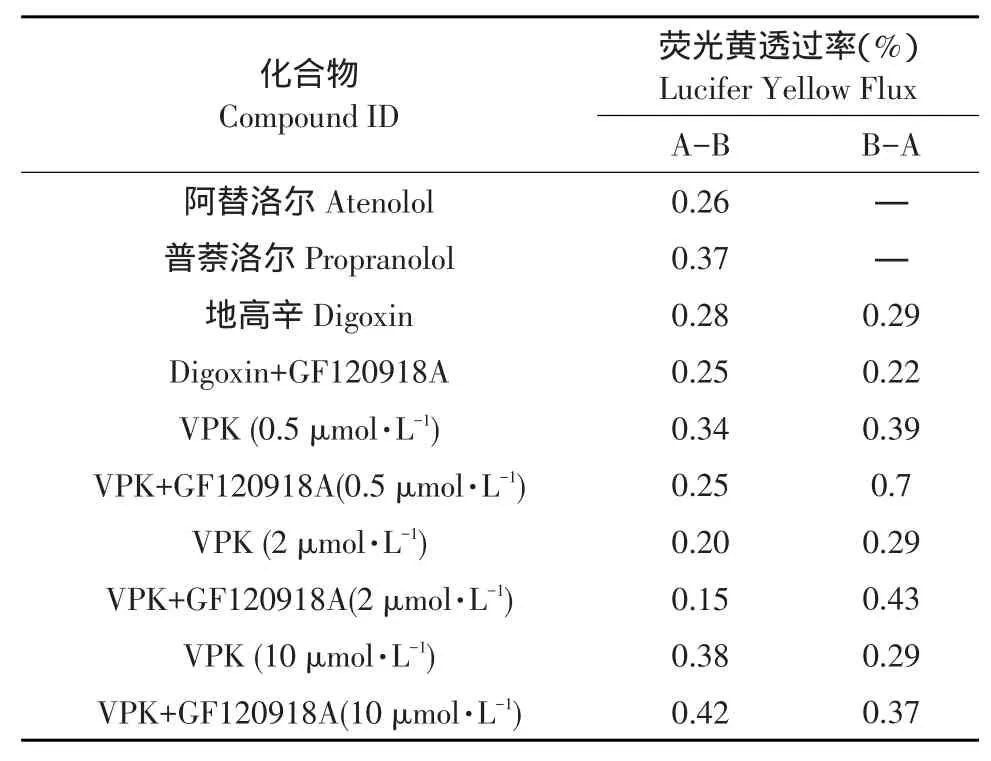
表5 荧光黄外排试验结果Table 5Resultsof Lucifer Yellow rejection assay
2.3.2 细胞功能特性评价
对照化合物和供试化合物的渗透性见表6。作为通过细胞旁路途径渗透的标记物,阿替洛尔通常表现低渗透性,该试验中阿替洛尔的平均表观渗透系数(Papp(A-B))为0.24×10-6cm·s-1。作为被动跨细胞渗透的标记物,普萘洛尔通常表现出高渗透性,该试验中普萘洛尔平均表观渗透系数(Papp(A-B))为24.68×10-6cm·s-1。作为外排转运标记物,地高辛通常表现较高外排率(Efflux ratio,ER),该试验中不加GF120918A(一种熟知的外排转运子抑制剂,如抑制P糖蛋白P-gp)时,地高辛平均表观渗透系数Papp(A-B)和Papp(B-A)值分别为0.02和8.05×10-6cm·s-1,外排率为502.55。加入GF120918A后,地高辛外排率降低至1.10。因此本
研究所用的Caco-2细胞功能特性合格。
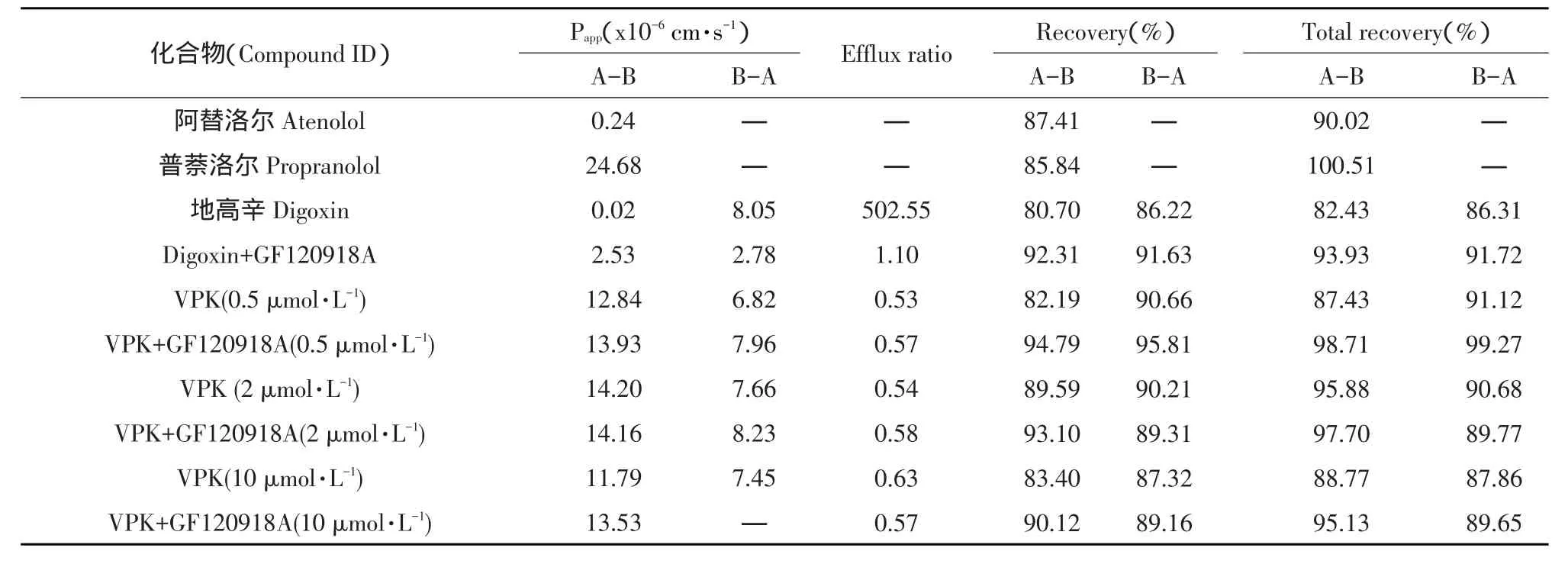
表6 对照化合物和供试化合物渗透性Table 6Permeability of control compound and test compound
2.3.3 候选新药VPK的双向通透性及外排
未添加GF120918A,在给药浓度为0.5、2和10 μmol·L-1时,VPK在A到B方向的表观渗透常数分别为12.84、14.20和11.79×10-6cm·s-1;在B到A方向表观渗透常数分别为6.82、7.66和7.45× 10-6cm·s-1;3个给药浓度外排率REa分别为0.53、0.54和0.63(均<2)。因此未观察到明显外排转运现象。VPK是外排转运体底物的可能性较小。
加入GF120918A,在给药浓度为0.5、2和10 μmol·L-1时,VPK在A到B方向表观渗透常数分别为13.93、14.16和13.53×10-6cm·s-1;在B到A方向表观渗透常数分别为7.96、8.23和7.65×10-6cm·s-1;3个给药浓度下外排率REi的数值分别为0.57、0.58和0.57。因此REa/REi值分别为0.93、0.93和1.11。
VPK在不同浓度,无论是否加入GF120918A样品溶液回收率82.19%~98.81%,总回收率87.43%~99.27%。总回收率达70%及以上为最佳,本试验中VPK在不同试验条件下均表现充足回收率。
综上所述,VPK在测试浓度为0.5、2和10 μmol·L-1时,在Caco-2细胞中表现高渗透性,该供试化合物是外排转运体底物的可能性较小。
3 讨论与结论
我国脑卒中发病率和致残率较高。长春西汀因对靶点磷酸二酯酶PDE1具有抑制作用,抑制cGMP水解,调节cGMP/cAMP平衡,双向调节血管张力,治疗脑卒中[21-22]。但长春西汀溶解度差,片剂生物利用度较低。基于脑卒中治疗现状及现有药物治疗效果不佳,本研究以长春西汀为母核,设计合成新型长春西汀衍生物VPK。通过与长春西汀对比,VPK具有更强的PDE1抑制作用,对脑卒中治疗效果应更好。
药物透过肠道壁的渗透性可用以评价药物在肠道的吸收情况,与此同时,肠壁细胞内侧存在药物外排泵,将已摄入细胞内的药物外排,对药物吸收和生物利用度产生影响[9,23]。基于Caco-2细胞单层模型,研究候选新药VPK的吸收和转运特性,在有或无P-糖蛋白抑制剂GF-120918A情况下,VPK双向给药,给药浓度为0.5、2和10 μmol·L-1。孵育120 min后,收集顶端、基底端和细胞裂解样品,采用液相色谱串联质谱(LC/MS/MS)检测供试化合物在样品中含量。采用荧光黄检测细胞单层完整性。结果显示,荧光黄和对照化合物的数据均符合可接受试验标准,表明该研究的测试系统功能完好。未添加GF120918A,在0.5、2及10 μmol·L-1给药浓度下,VPK在顶端到基底端(AB)方向表现出高渗透性(Papp>2.5×10-6cm·s-1,Papp为表观渗透系数),其表观渗透系数分别为12.84、14.20及11.79×10-6cm·s-1,基底端到顶端(B-A)方向表观渗透系数为6.82、7.66以及7.45× 10-6cm·s-1。相应地,在0.5、2以及10 μmol·L-1给药浓度下,VPK外排率均<2,分别为0.53、0.54及0.63,未观察到明显外排现象。加入GF-120918A时,VPK在顶端到基底端(A-B)方向表观渗透系数分别为13.93、14.16以及13.53×10-6cm· s-1,相应基底端到顶端(B-A)方向为7.96、8.23以及7.65×10-6cm·s-1。VPK外排率ER为0.57、0.58和0.57。综上所述,VPK在测试浓度为0.5、2和10 μmol·L-1时,在Caco-2细胞中表现高渗透性,该供试化合物是外排转运体底物的可能性较小。候选新药的高渗透性及非外排转运底物的特性表明,VPK具有良好的口服吸收和生物利用度,制剂开发难度较小。
[1] Ding J J,Li J F,Mao S R.Development and evaluation of vinpo⁃cetine inclusion complex for brain targeting[J].Asian Journal of Pharmaceutical Sciences,2015,10(2):114-120.
[2] 任骞,张杰.长春西汀药理作用机制研究进展[J].中草药,2013, 44(11):1517-1520.
[3] Cai Y J,Knight W E,Guo S J,et al.Vinpocetine suppresses path⁃ological vascular remodeling by inhibiting vascular smooth mus⁃cle cell proliferation and migration[J].Journal of Pharmacology and Experimental Therapeutics,2012,343(2):479-488.
[4] Feher G,Koltai K,Kesmarky G,et al.Effect of parenteral or oral vinpocetine on the hemorheological parameters of patients with chronic cerebrovascular diseases[J].Phytomedicine International Journal of Phytotherapy and Phytopharmacology,2009,16(2-3): 111-117.
[5] Tarnok K,Kiss E,Luiten P G,et al.Effects of Vinpocetine on mi⁃tochondrial function and neuroprotection in primary cortical neu⁃
rons[J].Neurochemistry International,2008,53(6-8):289-295.
[6] Jeon K I,Xu X,Aizawa T,et al.Vinpocetine inhibits NF-κB-de⁃pendent inflammation via an IKK-dependent but PDE-indepen⁃dent machanism[J].Proceedings of the National Academy of Sci⁃ences,2010,107(21):9795-9800.
[7] 杨雪梅,谭军.长春西汀治疗急性脑梗死的临床研究[J].中国新药与临床杂志,2011,30(4):269-271.
[8] Patyar S,Prakash A,Modi M,et al.Role of vinpocetine in cerebro⁃vascular diseases[J].Pharmacological Reports,2011,63(3):618-628.
[9] Volpe D A.Drug-permeability and transporter assays in Caco-2 and MDCK cell lines[J].Future Med Chem,2011,3(16):2063-2077.
[10] Li X Y,Chen D,Le C Y,et al.Novel mucus-penetrating lipo⁃somes as a potential oral drug delivery system:preparation,in vitro characterization,and enhanced cellular uptake[J].International Journal Nanomedicine,2010,6(1):3151-3162.
[11] 胡建春,侯佳,李月婷,等.赤芍提取物中两种主要成分在Caco-2细胞中的摄取特性研究[J].中国药理学通报,2016,32 (9):1329-1331.
[12] 李谦,杨育才,王立强.候选新药TW918在Caco-2细胞模型中的吸收和转运特性[J].中国新药杂志,2014,23(23):2781-2785.
[13] 徐小昆,陈志永,李卓清,等.新补骨脂异黄酮在Caco-2细胞模型中的吸收机制研究[J].中国中药杂志,2016,41(15):2922-2926.
[14] 杨秀伟,郭洁,徐嵬.芍药苷类化合物在人源肠Caco-2细胞单层模型中的吸收转运研究[J].中草药,2013,44(15):2097-2104.
[15] Abalos I S,Rodríguez Y I,Lozano V,et al.Transepithelial trans⁃port of biperiden hydrochloride in Caco-2 cell monolayers[J]. Environ Toxicol Pharmacol,2012,34(2):223-227.
[16] Li J,Volpe D A,Wang Y,et al.Use of transporter knockdown Ca⁃co-2 cells to investigate the in vitro efflux of statin drugs[J].Drug Metabolism and Disposition the Biological Fate of Chemicals, 2011,39(7):1196-1202.
[17] Lee W C,Peng C C,Chang C H,et al.Extraction of antioxidant components from Bidenspilosa flowers and their uptake by human intestinal Caco-2 Cells[J].Molecules,2013,18(2):1582-1601.
[18] 王格,严婷,傅诗情,等.基于Caco-2细胞模型研究FGFC1吸收和转运的特性[J].中药新药杂志,2016,25(9):1040-1045.
[19] 马美湖,黄晶.Caco-2细胞模型快速培养法的建立与评价[J].现代食品科技,2016,32(3):265-270.
[20] 祝欣刚,杨青.人结肠腺癌细胞系Caco-2单细胞层短期培养法及其评价[J].复旦学报:医学版,2012,39(1):68-73.
[21] 谢珺超,刘学源.长春西汀治疗神经系统疾病的研究进展[J].同济大学学报:医学版,2015,36(4):124-127.
[22] Sitges M,Chiu L M,Nekrassov V.Single and combinedeffects of carbamazepine and vinpocetine on depolarization-induced changes in Na+,Ca2+and glutamate release inhippocampal isolated nerve endings[J].Neurochemistry International,2006,49(1):55-61.
[23] He Y,Liu Y,Zeng S.Stereoselective and multiple carrier-mediated transport of cetirizine across Caco-2 cell monolayers with poten⁃tial drug interaction[J].Chirality,2010,22(7):684-692.
Study on the synthesis and activity of VPK and on its absorption and transportation characteristics
YUAN Shujie1,DING Hui2,JIANG Yuanyuan2,XIA Wujiong1
(1.School of Chemistry and Chemical Engineering,Harbin Institute of Technology,Harbin 150001,China;2.Technology Center of Harbin Pharmaceutical Group,Harbin 150025,China)
The candidate drug VPK was category 1 of chemical drugs for stroke which was selfdeveloped by Technology Center of Harbin Pharmaceutical Group.VPK was with vinpocetine as the mother nucleus and was obtained by reactions of hydrolysis,condensation,cyclization and salt-forming reaction. The structure of the compound was confirmed by elemental analysis,NMR,HRMS,X-ray powder diffraction, X-ray single crystal diffraction.Study based on the activity of PDE1 showed that both VPK and vinpocetine had inhibitory effects on PDE1,with the values of IC50at 17.40 and 1.97 μmol·L-1,respectively,suggesting that VPK had better effect in the treatment of stroke.The characteristics of absorption and efflux transportation of candidate drug VPK was determined with Caco-2 single-layer cell model and the results had shown that VPK showed high permeability both in the apical-basal(A-B)direction and in the basal-apical (B-A)direction.There was little chance that the test compound was the substrate for efflux transporter,or it was not the substrate for efflux transporter.
VPK;structural confirmation;PDE1;Caco-2 cell model;absorption;transportation;UPLC/ MS/MS
TQ460.7+2
A
1005-9369(2016)10-0025-09
时间2016-10-26 16:28:00[URL]http://www.cnki.net/kcms/detail/23.1391.S.20161026.1628.006.html
2016-08-31
黑龙江省抗肿瘤药物研制工程技术研究中心计划任务项目(GZ2013-45)
袁淑杰(1962-),女,研究员级高级工程师,博士研究生,研究方向为化学工程与技术。E-mail:yuan_yjy@163.com
*通讯作者:夏吾炯,教授,博士生导师,研究方向为有机合成(包括药物合成)和光化学反应。E-mail:xiawj@hit.edu.cn

