绿茶提取液纳米Ag的制备及表征
杨 辉, 任雁宇
(陕西科技大学 食品与生物工程学院, 陕西 西安 710021)
绿茶提取液纳米Ag的制备及表征
杨 辉, 任雁宇
(陕西科技大学 食品与生物工程学院, 陕西 西安 710021)
采用绿茶提取液制备AgNPs,借助UV-Vis跟踪检测反应液中Ag+的还原和Ag单质的生成过程;采用XRD、TEM对所得AgNPs进行组成、结构和表面形貌进行表征;通过FTIR分析探索AgNPs表面化学作用情况;测定了绿茶提取液还原性,对绿茶提取液制备AgNPs的机理进行了分析;采用抑菌圈试验验证所得AgNPs的抗菌性.结果表明:绿茶提取液制备AgNPs快速、简单,粒径10~15 nm,大小分布均匀,结晶度高;并对革兰氏阴性菌和革兰氏阳性菌具有较强的抑菌性能;绿茶萃取液具有很强的还原能力,易将Ag+还原成单质银,而其中所含的生物大分子则起到了分散剂的作用.
生物合成法; 纳米Ag粒子; 绿茶提取液; 抑菌性能表征; 抗氧化
0 引言
纳米Ag(Silver nanoparticles,AgNPs)具有尺寸效应、表面效应和隧道效应等特殊的性质,广泛应用于化工、食品、纺织、电子、建材和医疗卫生等领域[1,2],纳米Ag的制备方法有物理法、化学法、光催化法和生物合成法[3,4],其中生物合成法因具有高效、快速、稳定、简单易行、环境友好、无毒及价格低廉等诸多优点倍受人们关注和青睐[3,5].Vidhu V.K.等[6]用Macrotylomauniflorum提取液制备AgNPs;Ali M等[7]将Artemisia absinthium提取液与AgNO3按6∶4的体积比混合,反应后得到5~20 nm的AgNPs,粒径分布较宽;Ashokkumar S.等[8]用Tribulus terrestris提取液制备得到15~40 nm的AgNPs.此外,Murraya Koenigii[9],Mangifera Indica[10],Ziziphora tenuior[4]等植物提取液也被用来合成AgNPs粒子,研究了具体的合成过程,并对产物结构进行了表征,以上研究得到的物尺寸不均匀,分散性较差,缺乏对提取液中的有效成分作用的研究.
因此,本文采用绿茶萃取液还原AgNO3制备AgNPs,采用UV-Vis、 XRD、TEM手段对AgNPs合成过程进行跟踪监测,对产物组成、结构和表面形貌进行表征,通过FTIR分析探索AgNPs表面化学作用情况,采用抑菌圈试法检验所得AgNPs的抗菌性,测定绿茶提取液的还原性,对绿茶提取液制备AgNPs的机理进行分析.
1 实验部分
1.1 绿茶萃取液的制备
称取10 g绿茶放入装有100 mL超纯水的250 mL三角瓶中,80 ℃水浴30 min后,用10~15μm孔径的定性滤纸过滤,冷却,所得萃取液将作为还原剂和分散剂来制备纳米Ag材料.
1. 2 AgNPs的制备
取4份20 mL绿茶萃取液分别与4份不同浓度100 mL AgNO3(5、10、20、50 mmol/L,AR,天津市科密欧化学试剂有限公司)溶液在室温下混合,磁力搅拌10 min后,放入30 ℃的水浴中50 min.观察发现混合溶液的颜色由淡黄色逐渐变为深褐色,4份混合溶液还原反应持续了40 min,继续观察至90 min,溶液颜色再无任何变化后,将所得胶体分别记为S1、S2、S3、S4,将这4份胶体溶液10 000 r/min高速离心10 min后,所得沉淀分别用95%的乙醇溶液和超纯水清洗3~4次,然后在85 ℃下干燥8 h,得到AgNPs粉体.
1.3 绿茶萃取液总还原能力测定
将绿茶水提取液用乙酸乙酯萃取后,浓缩冷冻干燥,得到绿茶水提取物粉体,测定其对DPPH自由基的清除能力.用无水乙醇配制0.1 mmol/L的DPPH溶液,避光保存,Vc溶液作为对照.将样品配制成不同浓度(0.2~2.0 mg/mL)的溶液.取2 mL、0.1 mmol/L的DPPH溶液分别加入不同浓度的2 mL绿茶提物溶液中,剧烈震荡后室温下反应30 min,测定吸光度Ai,以乙醇作为空白对照组,自由基清除率按下式计算:
(1)
式(1)中:Ai为样品溶液和DPPH试剂混合液吸光值;Aj为样品溶液和空白溶剂混合液吸光值;Ac为DPPH试剂与空白溶剂吸光值.
1.4 AgNPs形成过程跟踪及产物表征
反应所得胶体溶液用紫外可见分光光度计(UV-vis,Unico Instrument,Shanghai)检测跟踪反应体系中银离子的还原和AgNPs的形成.所得AgNPs粉体采用X射线衍射(X-ray diffraction,XRD,D/max-2200PC,Rigaku)分析其晶体组成和结构;借助透射电子显微镜(transmission electron microscopy,TEM,FEI G2 F20 S-Twin,America)观察其形貌及大小.
1.5 AgNPs抗菌性能表征
利用抑菌圈法检验AgNPs对大肠杆菌(Escherichiacoli,E.coli)和金黄色葡萄球菌(Staphylococcusaureus,S.aureus)的抗抑菌性.用移液枪分别取活化培养后的E.coli和S.aureus各10μL,稀释10倍后各取50μL注射到2个LB营养琼脂培养基平板上,用涂布器涂抹均匀后分别依次放入编号1~5直径为5 mm的圆形无菌滤纸片.1~5号滤纸片分别含有不同浓度的AgNPs (7.23×10-6,2.89×10-5,5.79×10-5,1.16×10-4,4.63×10-4mol/L).将两个实验平板放在37 ℃的培养箱培养24 h后,测量抑菌圈的直径,以抑菌圈的直径为标准来衡量AgNPs的抑菌性.
2 结果与讨论
2.1 绿茶提取液还原性分析
DPPH是一种很稳定的自由基,其溶液在517 nm处有很强的吸收.自由基清除剂能使DPPH自由基单电子配对,溶液的吸光度减小,所以DPPH自由基吸光值的变化能定量地衡量抗氧化剂对其清除能力的强弱[11,12],这种强的清除自由基的能力可反映出提取液的强还原性.以Vc作为对照,测定绿茶水提取物溶液对DPPH自由基的清除能力.如图1所示,当样品溶液浓度小于0.2 mg/mL时,对DPPH自由基清除率小于25%,随着样品浓度的增加清除率逐渐增强,当样品浓度增加到1.5 mg/mL后,清除率达到90%以上,并且逐渐趋于平稳.与Vc对DPPH自由基的清除率相比,绿茶水提取物对其清除率更强,这说明绿茶提取液的抗氧化能力很强,表现出强的还原性,可提高Ag+的还原率.

图1 不同浓度的绿茶提取物溶液对 DPPH自由基清除率(以Vc作为对照)
2.2 AgNPs的UV-vis、TEM和XRD分析
2.2.1 AgNPs形成及形态分析
绿茶提取液与AgNO3溶液反应中,胶体溶液S1,S2,S3和S4的颜色渐渐加深,这是由于AgNPs的表面等离子体共振(Surface Plasmon Resonance,SPR)产生的,与块体的单质银不同,微小颗粒的Ag粉对光的反射能力差,却能吸收光线呈现黑色,反应中出现黑色表明Ag+被还原为Ag.研究表明,当纳米晶粒是球形或近似球形时,UV-vis的吸收峰只会出现单一的SPR共振带,而各向异性颗粒根据它们的形状会表现出两个或三个SPR共振带;且当SPR共振带较宽时表明溶液中合成的AgNPs粒子粒径分布较宽,反之亦然[6].
图2(a)显示:胶体溶液S1,S2,S3和S4在460 nm附近都有单一且显著的吸收峰,且随着AgNO3浓度的减小,UV-vis的吸收峰逐渐变窄,当AgNO3浓度为5 mmol/L时吸收峰较尖锐,因此,本文制备的AgNPs晶粒较小、分布均匀、且呈现球形或近似球形.图2(b)表明:当AgNO3浓度为5 mmol/L时,混合溶液反应进行到5 min时Ag+逐渐被还原为Ag单质,当反应进行到20 min时,反应基本已经完成,至40 min时,反应几乎没有变化,表明前20 min反应很快,此后,反应物浓度逐渐减小,速度随之慢慢降低.

(a)绿茶提取液与不同浓度的AgNO3反应所得纳米Ag胶体溶液的UV-Vis吸收峰
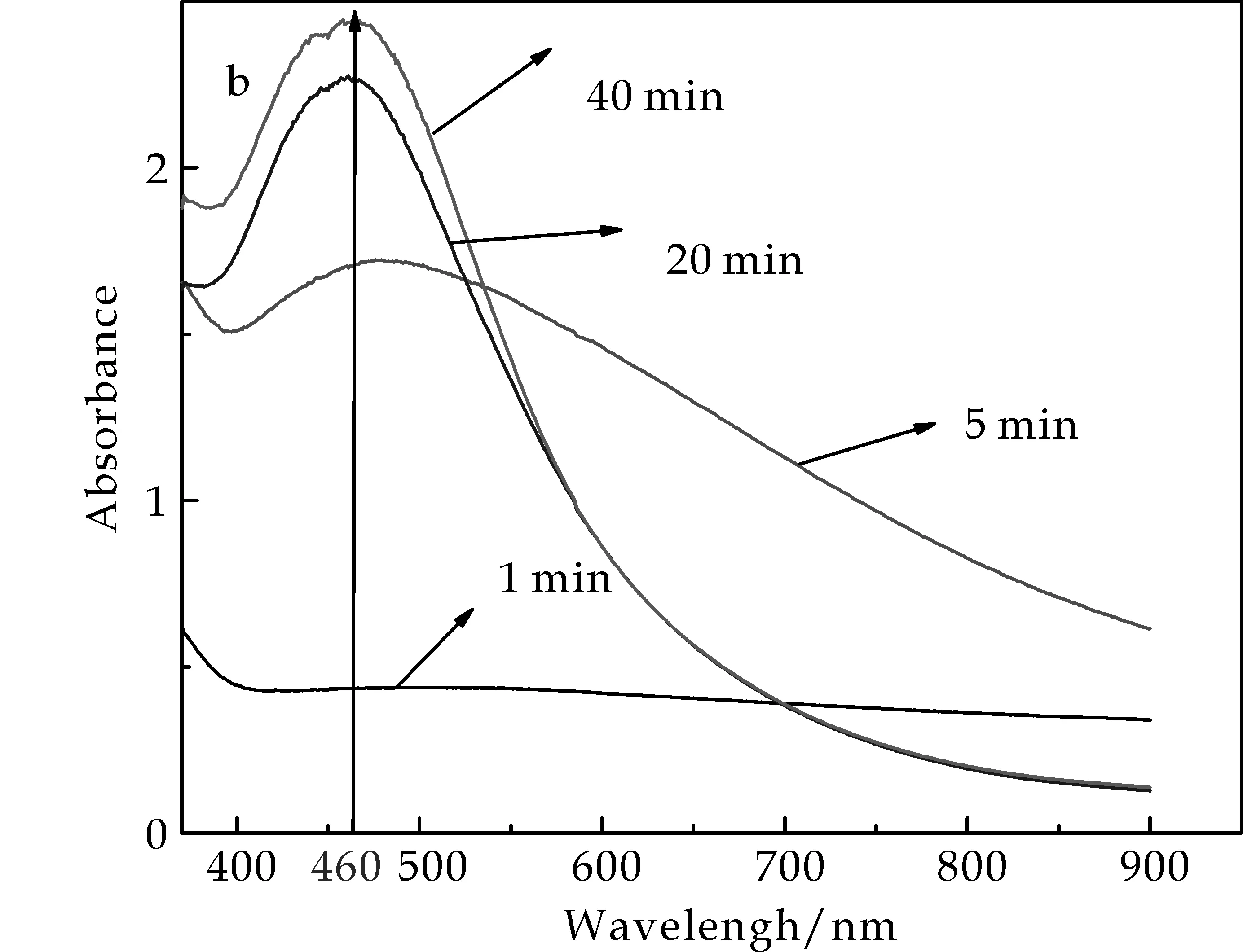
(b)绿茶提取液与AgNO3(5 mmol/L)混合溶液不同反应时间段的UV-Vis跟踪检测吸收峰图2 UV-Vis跟踪检测混合物反应图谱
2.2.2 AgNPs的XRD、TEM分析
图3是所得AgNPs的TEM图.图3(a)表明所合成的纳米Ag粒子粒径均匀分散,呈球形和近似球形,粒径尺寸10~15 nm;图3(b)是高分辨率下的纳米Ag粒子的TEM图片,从图中可以看到单个纳米晶粒有明显的晶格条纹,且晶格条纹之间的距离为0.23 nm,这与纯净纳米Ag的面心距(0.235 nm)接近(JCPDS file No. 04-0783)[13],这表明所合成的AgNPs高度结晶.
图4为所得AgNPs晶体的XRD衍射图谱.图中五个吸收峰位置与纯纳米Ag的标准谱JCPDS file no.04-0873完全对应,表明所得晶体为纯纳米Ag.以(111)晶面衍射参数采用Debye-Scherrer′s公式计算,AgNPs粒子平均尺寸为13.6 nm.这与XRD检测结果与TEM结果一致.Sun Q等[14]和Babu S等[15]用绿茶提取液制备得到的纳米Ag粒子尺寸分别处于20~90 nm和5~30 nm,都存在纳米晶粒尺寸较大和分布不均匀等缺点.与之相比,本研究改变料液比、硝酸银浓度、绿茶提取液与硝酸银溶液混合比例,反应温度及其它条件后所制备的AgNPs晶粒尺寸更小且分布更均匀,粒子间分散且结晶度较高,说明本实验条件更适合AgNPs合成.

(a)用绿茶提取液合成AgNPs的TEM图片

(b)高分辨率下AgNPs的TEM图片(由图可得AgNPs的单个纳米晶体晶格条纹间距是0.23 nm)图3 TEM检测所合成的AgNPs结果
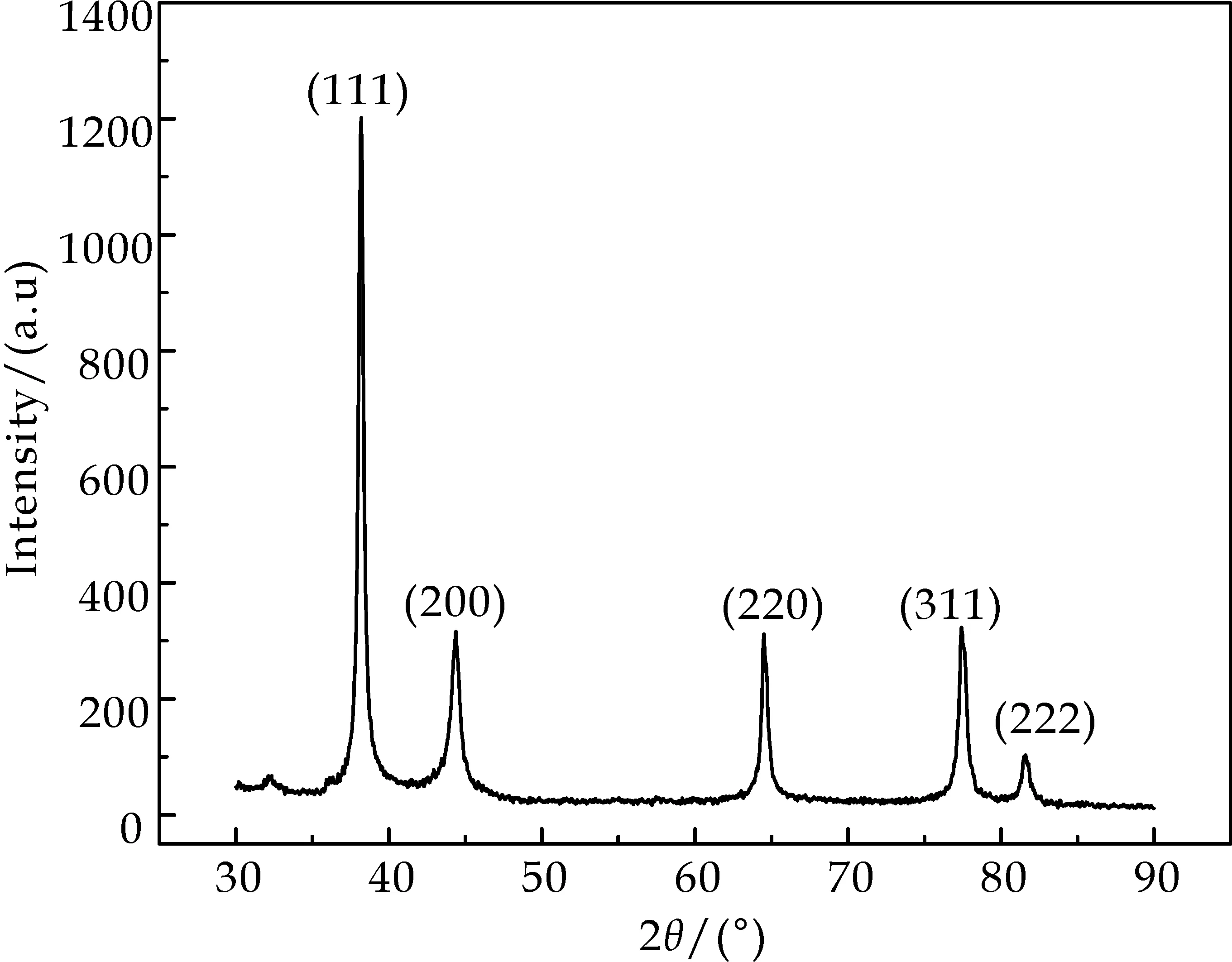
图4 所得纳米Ag级粉体的XRD衍射图谱
2.2.3 AgNPs与提取液中生物大分子作用分析
绿茶提取液中含有茶多酚、维生素、氨基酸等物质,其中含有具有强的还原性羟基,使银离子被还原成银,而含有氨基、羰基的生物大分子从理论上分析能够与银和银离子形成较强络合作用,使得提取液中的生物大分子包裹在AgNPs颗粒表面,起到分散和保护作用[14].分散保护作用的实质是纳米Ag颗粒被生物大分子包裹其表面自由能降低,导致团聚过程在体系能量降低方面是不利的.因为体积相同的条件下球形具有最小的表面积,纳米Ag颗粒呈球形有利于其处在低能量状态,不易团聚,所以,合成的纳米Ag粒子为稳定分散的晶粒.
如图5所示,FTIR分别检测合成AgNPs前和反应后的绿茶取液分别对应图中a、b两条图谱曲线.从图5可以看到,a曲线在3 372.72 cm-1处有一个很强的吸收峰,这是由于酰胺基团中的N-H键伸缩振动引起的,b曲线中此峰吸收变弱且红移至3 390.48 cm-1,这是说明N-H键与银离子发生络合作用.a曲线在1 699.27 cm-1处是萃取液中黄酮类和酰胺类的C=O的伸缩振动吸收,在1 457.32和1 239.14 cm-1处的吸收是因为芳香族氨基团的C-N伸缩振动或者是-C-N的伸缩振动;b曲线在1 699.27 cm-1处吸收减弱,说明在反应溶液中,C=O被氧化;在1 457.32和1 239.14 cm-1处的吸收红移或消失,说明C-N或-C-N与银离子发生络合作用.a曲线在1 619.12和1 036.93 cm-1处分别是来自绿茶萃取液中蛋白质、多酚的C-OH和烯烃中的C-H伸缩振动吸收峰;b曲线在1 616.09 cm-1处蓝移至1 625.30 cm-1,说明烯烃可能发生取代反应,电子诱导效应导致的;在1 036.93 cm-1吸收峰消失,说明蛋白质、多酚的C-OH被氧化[16].因此,FTIR分析表明在AgNPs合成过程中,绿茶萃取液中酰胺基团、氨基、羰基和多酚类化合物等起还原、分散和保护作用.也与参考文献[9,14]的报道一致.
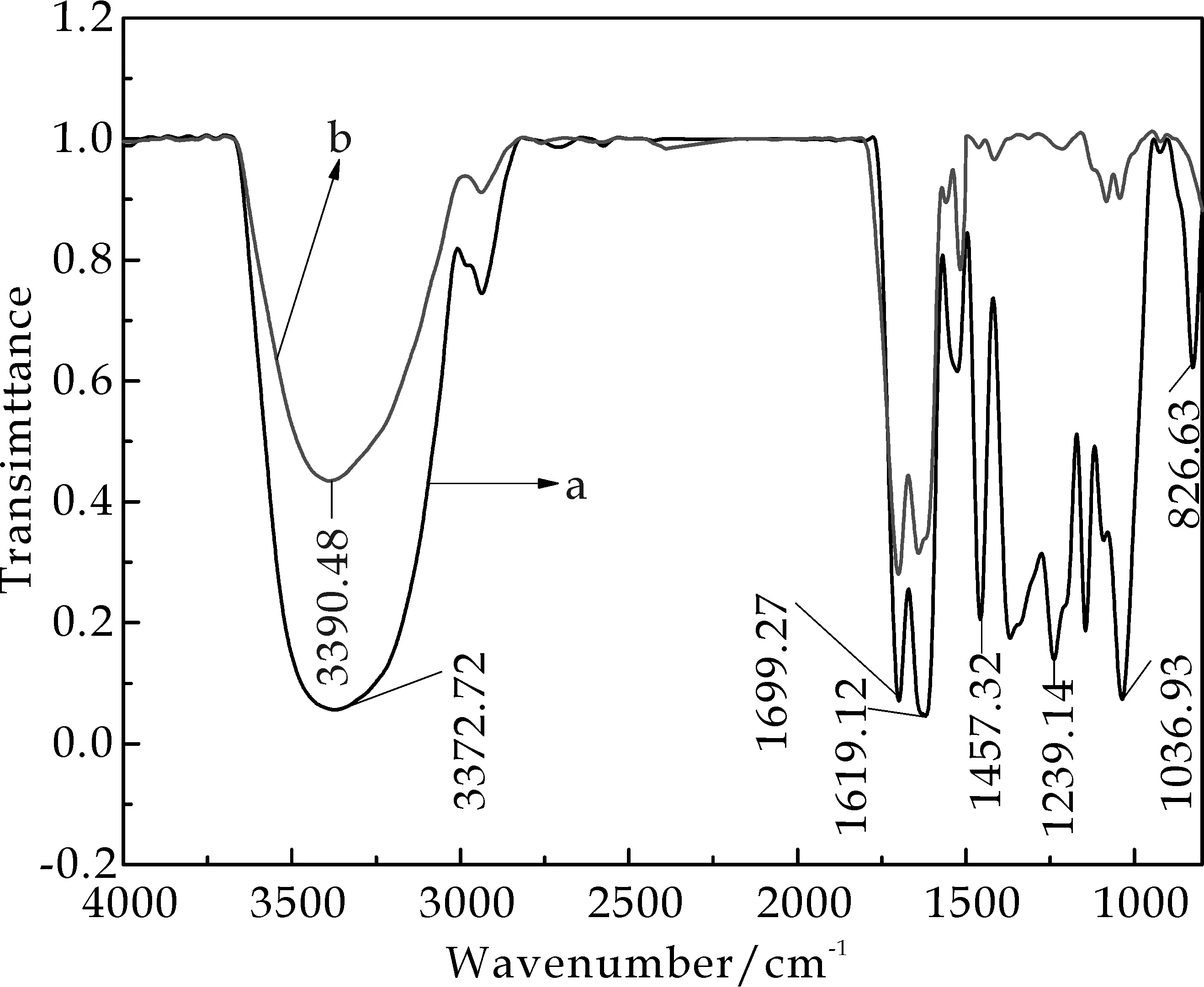
a:合成纳米Ag前; b:合成纳米Ag后图5 FTIR分析检测绿茶萃取液成分 在合成AgNPs前后的变化
2.3 AgNPs的抑菌性能表征
AgNPs的抑菌效果如图6所示.1~5号滤纸片含有AgNPs的浓度分别为7.23×10-6,2.89×10-5,5.79×10-5,1.16×10-4,4.63×10-4mol/L.从图6可知,随着AgNPs溶液浓度的逐渐增大,其对E.coli和S.aureus的抑菌圈直径明显增大,在试验范围内,对E.coli和S.aureus的最小抑菌浓度为7.23×10-6.纳米Ag材料对E.coli和S.aureus的最大抑菌圈直径分别是12.50 mm (图6(a))和12.70 mm (图6(b)).抑菌机理可能是AgNPs具有很小的半径,吸附能力强,可与细胞组成中的磷脂、蛋白质、DNA中官能团,如氨基、羰基、氧负离子、双硫键等形成络合作用,对细胞的破坏能力极强,所以AgNPs对革兰氏阴性菌和革兰氏阳性菌有很强的抑制作用.
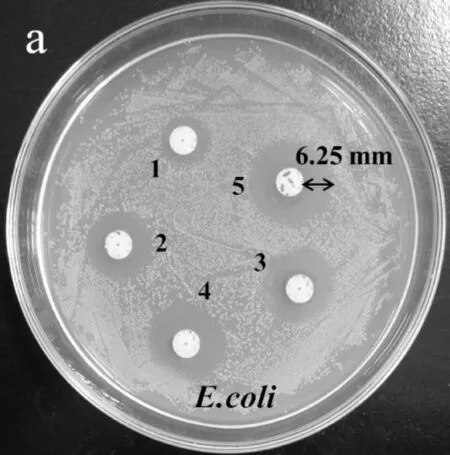
(a)AgNPs对E.coli的抗菌效果图
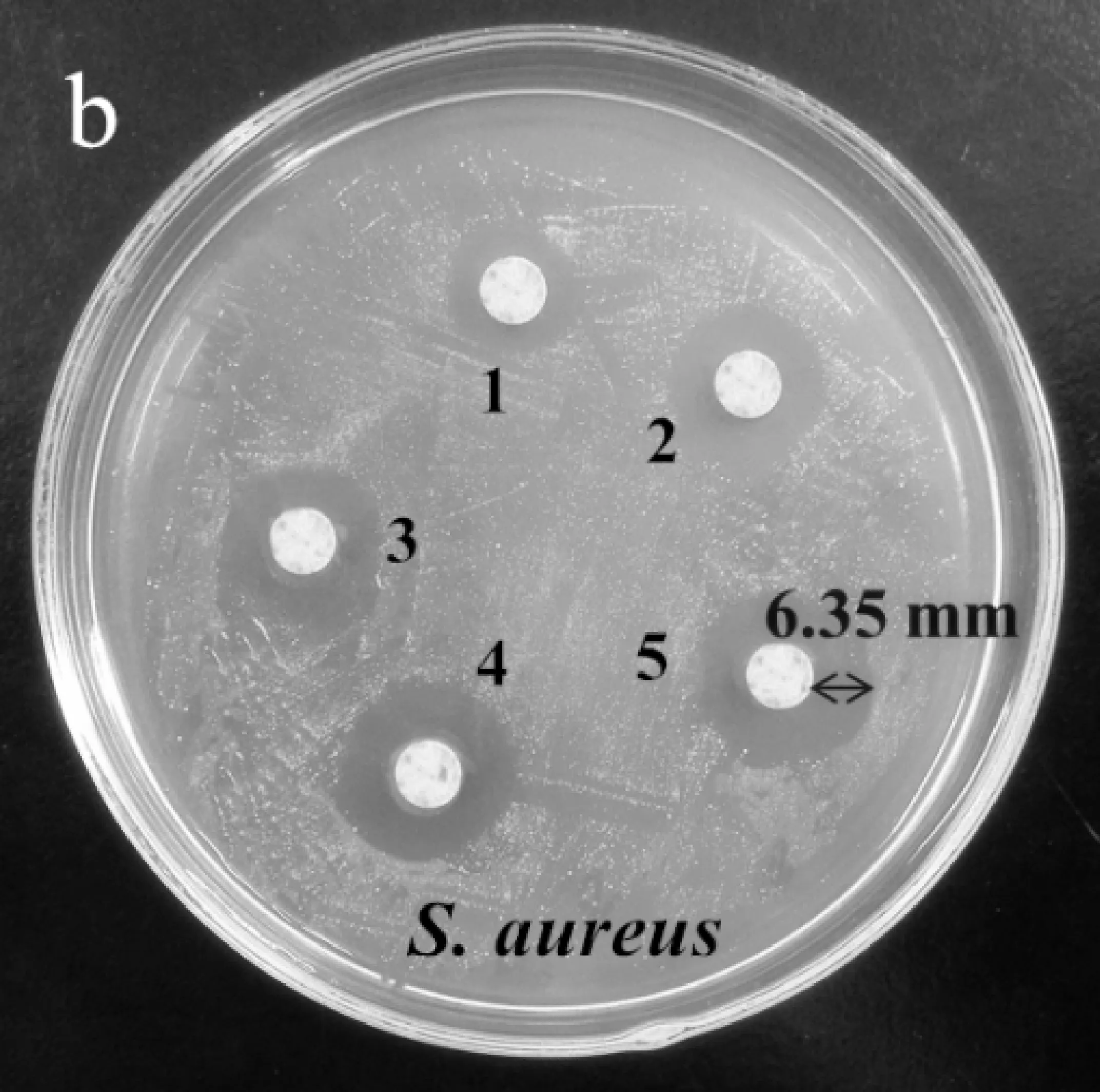
(b)AgNPs对S.aureus的抗菌效果图图6 AgNPs对E.coli和S.aureus的抗菌效果图
3 结论
绿茶提取液与AgNO3在温和条件下可合成AgNPs,XRD和TEM检测分析表明当AgNO3浓度为5 mmol/L时,用绿茶萃取液可合成结晶度好、球形、尺寸介于10~15 nm的纳米Ag粒子.抗氧化实验分析表明绿茶萃取液中生物大分子具有很强的抗氧化能力,表现出的强还原性,可将AgNO3溶液中几乎所有的Ag+还原成银单质,对此,UV-Vis跟踪观测反应体系中Ag+的还原进程得到了证实;FTIR分析表明绿茶萃取液中含有酰胺基团、氨基、羰基和多酚类化合物等起到了还原、分散和保护作用;抑菌实验结果表明所得纳米Ag材料对革兰氏阳性菌和革兰氏阴性菌有较强的抑菌作用.茶提取液大分子物质组成复杂,分散稳定机理还需进一步研究.
[1] Abrigo M,Mcarthur S L,Kingshott P.Electrospun nanofibers as dressings for chronic wound care:Advances,challenges,and future prospects[J].Macromolecular Bioscience,2014,14(6):772-792.
[2] Marin S,Vlasceanu G M,Tiplea R E,et al.Applications and toxicity of silver nanoparticles:A recent review[J].Current Topics in Medicinal Chemistry,2015,15(16):1 596-1 604.
[3] Ponarulselvam S,Panneerselvam C,Murgan K,et al.Synthesis of silver nanoparticles using leaves of catharanthus roseus linn.G.don and their antiplasmodial activities[J].Asian Pacific Journal of Tropical Biomedicine,2012,2(7):574-580.
[4] Sadeghi B,Gholamhoseinpoor F.A study on the stability and green synthesis of silver nanoparticles using Ziziphora tenuior (Zt)extract at room temperature[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2015,134:310-315.
[5] Pandey S,Mewada A,Thakur M,et al.Biogenic gold nanoparticles as fotillas to fire berberine hydrochloride using folic acid as molecular road map[J].Materials Science & Engineering C:Materials for Biological Applications,2013,33(7):3 716-3 722.
[6] Vidhu V K,Aromal S A,Philip D.Green synthesis of silver nanoparticles using macrotyloma uniflorum[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2011,83(1):392-397.
[7] Ali M,Kim B,K D B,et al.Green synthesis and characterization of silver nanoparticles using artemisia absinthium aqueous extract-A comprehensive study[J].Materials Science & Engineering C:Materials for Biological Applications,2016,58:359-365.
[8] Ashokkumar S,Ravi S,Kathiravav V,et al.Synthesis,characterization and catalytic activity of silver nanoparticles using tribulus terrestris leaf extract[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2014,121:88-93.
[9] Philip D,Unni C,Aromal S A,et al.Murraya Koenigii leaf-assisted rapid green synthesis of silver and gold nanoparticles[J].Spectrochimica Acta Part A:Molecular and biomolecular spectroscopy,2011,78(2):899-904.
[10] Philip D.Mangifera indica leaf-assisted biosynthesis of well-dispersed silver nanoparticles[J].Spectrochimica acta Part A:Molecular and biomolecular spectroscopy,2011,78(1):327-331.
[11] Rajaraman D,Sundarajan G,Rajkumar R,et al.Synthesis,crystal structure investigation,DFT studies and DPPH radical scavenging activity of 1-(furan-2-ylmethyl)-2,4,5-triphenyl-1H-imidazole derivatives[J].Journal of Molecular Structure,2016,1 108:698-707.
[12] Musa K H,Abdullah A, AlL-haqi A.Determination of DPPH free radical scavenging activity:Application of artificial neural networks[J].Food Chemistry,2016,194:705-711.
[13] Philip D.Rapid green synthesis of spherical gold nanoparticles using Mangifera indica leaf[J].Spectrochimica Acta Part A:Molecular and biomolecular spectroscopy,2010,77(4):807-810.
[14] Sun Q,Cao X,Li J,et al.Green synthesis of silver nanoparticles using tea leaf extract and evaluation of their stability and antibacterial activity[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2014,444:226-231.
[15] Babu S,Claville M O,Ghebreyessus K.Rapid synthesis of highly stable silver nanoparticles and its application for colourimetric sensing of cysteine[J].Journal of Experimental Nanoscience,2015,10(16):1 242-1 255.
[16] Wu Y,Zeng S L,Wang F F,et al.Heterogeneous fenton-like oxidation of malachite green by iron-based nanoparticles synthesized by tea extract as a catalyst[J].Separation and Purification Technology,2015,154:161-167.
【责任编辑:蒋亚儒】
Preparation mechanism and characterization of monodisperse silver nanoparticles synthesized by green tea leaf extract
YANG Hui, REN Yan-yu
(School of Food and Biological Engineering, Shaanxi University of Science & Technology, Xi′an 710021, China)
In this project,green tea extract was used to synthesize AgNPs.UV-Vis was employed to detect and track the reduction of Ag+and the forming process of AgNPs.The synthesize AgNPs with desirable physical and biological properties was characterized using TEM and XRD.FTIR spectroscopy was used to analysis to determine capping of biomolecule on the AgNPs surface of plant extract.Reduction properties of green tea extract were analyzed to study the mechanism of redox reaction.Antibacterial activity of the AgNPs was determined.The results showed that the biosynthesis method of AgNPs is easy and simple.The size of AgNPs between 10~15 nm and it takes spherical shapes and good crystallinity,and has strong antibacterial activity against gram positive bacteria and gram negative bacteria.Antioxidant experiment results showed that green tea extract has strong reduction capacity, able to reduct Ag+into Ag easily, and the biological macromolecules of the extract have stabilizing agent properties.
biosynthesis; silver nanoparticles; green tea leaf extract; antibacterial active; antioxidant
2016-09-23
陕西科技大学学术带头人团队计划项目(2013XSD19)
杨 辉(1960-)男,陕西西安人,教授,博士生导师,研究方向:材料合成、发酵工程
1000-5811(2017)01-0124-05
TB383.1
A

