水蓼化学成分抑菌和抗氧化活性研究
马养民, 李梦云, 郭林新, 乔 珂, 范 超
(陕西科技大学 化学与化工学院 教育部轻化工助剂化学与技术重点实验室, 陕西 西安 710021)
水蓼化学成分抑菌和抗氧化活性研究
马养民, 李梦云, 郭林新, 乔 珂, 范 超
(陕西科技大学 化学与化工学院 教育部轻化工助剂化学与技术重点实验室, 陕西 西安 710021)
为了研究从水蓼中分离得到的11个化合物的抑菌活性及其中部分化合物的抗氧化活性,采用96孔板二倍稀释法进行抑菌活性测试,以最小抑菌浓度(MIC)考察各化合物的抑菌能力强弱;通过DPPH法测定自由基清除率,利用origin 70拟合出标准曲线,计算各化合物的IC50,以此反映其抗氧化能力大小.实验结果显示从水蓼中分离出的11个化合物对各细菌表现出不同程度的抑制作用,其中黄酮类化合物的抑菌效果较好,槲皮素对金黄色葡萄球菌的抑制作用最好,最小抑菌浓度为31.3μg·mL-1;所检测的化合物均表现出良好的抗氧化活性,其中槲皮素、没食子酸和鞣花酸的抗氧化能力强于Vc.结果表明从水蓼中分离得到化合物有良好的抑菌和抗氧化活性,其中黄酮类化合物的活性强弱因其结构的不同而表现出明显的差异,烯醇式结构较多的化合物表现出较强的抗氧化能力.
水蓼; 化学成分; 抑菌活性; 抗氧化活性; 构效关系
0 引言
蓼属(Polygonum)是蓼科(Polygonacea)中的药用大属[1].全世界约300余种,我国有120多种,秦岭产8属,52种,6变种.在我国,约有81种蓼属植物供药用,且广布于全国各地.其大多具有活血止痛、清热解毒、散结消肿、收敛止泻、顺气解痉、通经利尿等功效[2].诸多常用的著名中草药如何首乌(P.multiforumThunb.)、虎杖(P.cuspidatumSieb. Et Zucc.)、红蓼(又名荭草,P.orientaleL .)、拳参(P.bistortaL .)皆出于蓼属[3].另有一部分为民间习用药材.
水蓼(PolygonumhydropiperL.)是蓼属一年生草本植物,在我国大部分地区均有分布,来源相当广泛[4].其味辛,冷,无毒,内用可治疗风湿关节痛、疥癣、痢疾、腹泻、脚气、肠胃炎、功能性子宫出血、跌打肿痛,外用可治皮肤湿疹、毒蛇咬伤等[5].水蓼具有抗微生物、杀虫、抗氧化、抗肿瘤等多种生物活性[6],在植物源农药[7],兽药,医药及食品添加剂等方面均有应用.但目前国内外对水蓼的研究多集中在该植物主要化学成分的基础研究,对其所含化学成分活性的研究较少.因此本文通过对从水蓼中分离得到的11种化合物进行体外生物活性检测,以期为进一步开发利用水蓼的药用植物资源奠定一定的理论基础.
1 材料与方法
1.1 材料
(1)仪器及试剂:超净工作台(ZHJH-C11098),上海智城分析仪器制造有限公司;手提式蒸汽压力灭菌锅(YX-2803),江阴滨江医疗设备有限公司;恒温培养箱(DH5000B),天津泰斯特仪器有限公司;酶标分析仪(DNM-9602A),北京普朗新技术有限公司;costar 96孔酶标板(3590),美国Corning Costar公司;baygene 移液枪(S200),北京百晶生物技术有限公司;所用试剂均为国产分析纯.
(2)测试菌:革兰氏阳性菌:金黄色葡萄球菌(Staphylococcusaureus)和乳链球菌(Streptococcuslactis)以及革兰氏阴性菌:绿脓杆菌(Pseudomonasaeruginosa)和大肠杆菌(Esherichiacoli).
(3)肉膏蛋白胨培养基:牛肉膏12.0 g,琼脂8.0 g,蛋白胨24.0 g,氯化钠12.0 g,水1 200 mL,pH 7.0~7.2,121 ℃灭菌20 min.
1.2 方法
1.2.1 提取与分离鉴定
干燥水蓼全草13.1 Kg粉碎后用95%酒精浸泡,回流提取4次,合并提取液,减压蒸馏浓缩后得浸膏1.0 Kg.加水使其悬浮,分别用石油醚、乙酸乙酯、正丁醇萃取,回收萃取溶剂后得到四个部分:石油醚萃取物92.0 g,乙酸乙酯萃取物81.8 g,正丁醇萃取物59.9 g,萃取后水溶性部分284.0 g.石油醚、乙酸乙酯及正丁醇萃取物通过硅胶柱色谱洗脱后,石油醚相得到6个组分(Fr.A1~A6),乙酸乙酯相得到8个组分(Fr.B1~B8),正丁醇相得到7个组分(Fr.C1~C7).再经多次硅胶柱层析、凝胶柱层析、重结晶等手段从Fr.A4和Fr.A5中分别分离纯化得到化合物1和化合物2;Fr.B1~B5中分离纯化得化合物3~9;Fr.C3和Fr.C4中分别分离得到化合物10和化合物11.通过NMR、MS等波谱手段对以上化合物进行结构鉴定后,依次确定为β-谷甾醇(1)、aniba dimer A(2)、琥珀酸(3)、槲皮素(4)、没食子酸(5)、胡萝卜苷(6)、槲皮素-3-O-β-D-葡萄糖苷(7)、槲皮素-3-O-β-半乳糖苷(8)、山柰酚-3-O-β-半乳糖苷(9)、富马酸(10)、鞣花酸(11),其中化合物2、9、10和11为首次从水蓼中分离得到.
1.2.2 抑菌活性测试
参照文献[8],用DMSO分别溶解待测化合物,依次配成质量浓度为1 000μg·mL-1的溶液.将牛肉膏蛋白胨液体培养基加入到96孔板每行的第1至11孔中,每孔100μL.向第1孔中加入100μL待测样品溶液,混合均匀后吸取100μL加入到第2孔中,再从第二孔吸取100μL加入到第3孔中混合均匀.如此连续稀释至第10孔,从第10孔中吸取100μL弃去.第11孔和第12孔分别作为培养基和DMSO溶剂阴性对照.第1~10孔中化合物的质量浓度依次为500、250、125、62.5、31.3、15.6、7.81、3.91、1.95、0.98μg·mL-1.用牛肉膏蛋白胨液体培养基配制浓度为106CFU·mL-1活性测试菌菌悬液,向96孔板每孔中加入100μL菌悬液.青霉素钠作为革兰氏阳性菌的阳性对照,硫酸链霉素作为革兰氏阴性菌的阳性对照,每组样品设置3个平行组.将96孔板置于37 ℃培养箱中培养24 h,观察并记录实验结果.
1.2.3 抗氧化活性测试
参照文献[9-11] ,用甲醇将待测化合物依次配成质量浓度为2 000μg·mL-1的溶液,同时配制200μg·m-1的DPPH甲醇溶液.首先向96孔酶标板的第一排和第二排每孔中依次加入100μL甲醇,其次,在两排的第一孔中各加入100μL待测样品,每排第1孔混合均匀后吸取100μL加入到第2孔中,再从第2孔吸取100μL加入到第3孔混合均匀,按此法操作至第11个孔,吸取100μL溶液弃去,最后一孔不加样品作为空白对照.最后,向第一排每孔中加入100μL配制好的DPPH溶液,第二排每孔中加入100μL甲醇.将上述96孔酶标板放置在室温、避光条件下反应30 min后将酶标仪波长设置成517 nm测定其吸光度.以Vc作为阳性对照.
计算自由基清除率:自由基清除率=[1-(Ai-Aj)/A0]×100%,其中Ai为DPPH溶液加待测样品溶液的吸光度;Aj为甲醇溶液加待测样品溶液的吸光度;A0为甲醇溶液加DPPH溶液的吸光度.因所测定化合物的浓度和其对DPPH自由基的清除率呈线性关系,故以自由基清除率为纵坐标,样品浓度为横坐标可建立量效关系曲线,通过量效关系曲线可求出自由基清除率为50%时样品的浓度(IC50).
2 结果与讨论
2.1 抑菌活性测试结果
抑菌活性大小由最小抑菌浓度(MIC)来判断,最小抑菌浓度越小表示其抑菌活性越好,实验结果如表1所示.

表1 单体化合物抑菌活性测试结果
实验结果表明,所测定的化合物对金黄色葡萄球菌、乳链球菌、大肠杆菌以及绿脓杆菌均有一定的抑制作用.首次分离得到的化合物2、9、10和11对不同细菌的抑制作用因其结构不同而表现出一定的差异.不同黄酮类化合物对革兰氏阳性菌的抑制作用强于革兰氏阴性菌.槲皮素对金黄色葡萄球菌最小抑菌浓度最小,为31.2 μg·m-1,表明其抑菌效果最好.当槲皮素上3-OH基团被糖苷取代后抑菌活性有所下降且对不同的细菌影响效果不同.相关研究[12,13]表明黄酮类化合物3-OH基团对该化合物的抑菌活性有一定的影响,实验结果与此结论相符.
2.2 抗氧化活性测试结果
以IC50值来衡量样品对自由基的清除能力,IC50值越小表示其抗氧化能力越强,实验结果如表2所示.
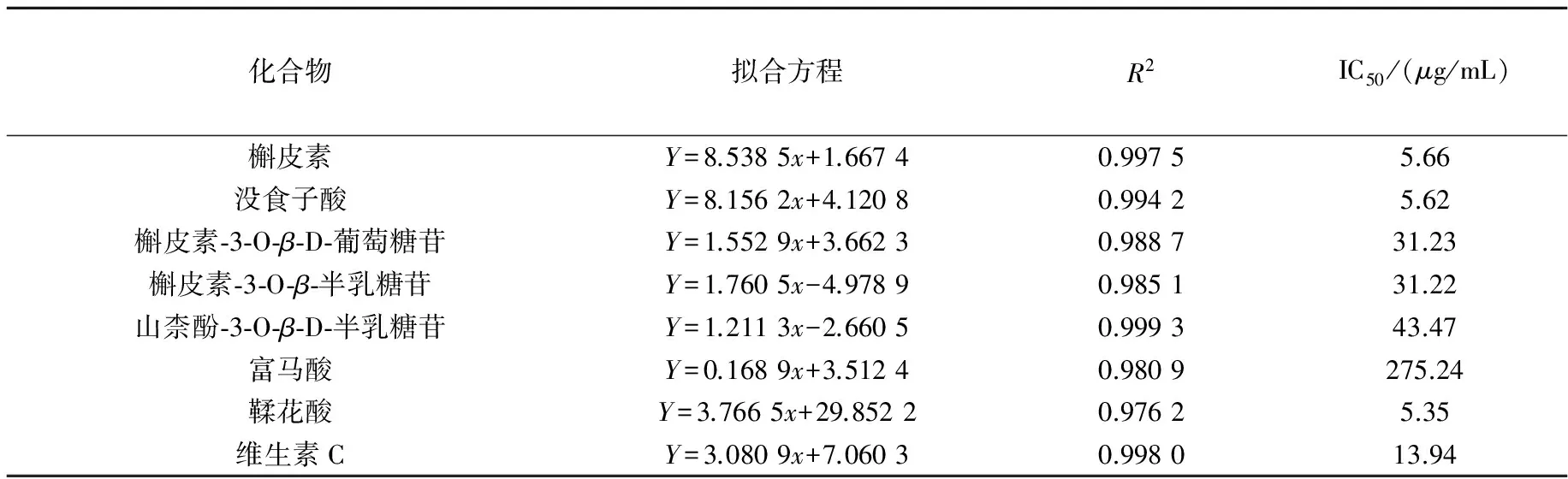
表2 单体化合物抗氧化活性测试结果
实验结果表明,所测定的化合物均有良好的抗氧化活性,首次从水蓼中分离得到的鞣花酸的抗氧化能力强于维生素C,山柰酚-3-O-β-D-半乳糖苷的抗氧化能力也相对较好.此外,槲皮素和没食子酸的抗氧化活性显著,当槲皮素上3-OH被糖苷取代后抗氧化能力有所降低, 槲皮素苷类化合物失去3′-OH时,抗氧化能力也有所下降.从化合物结构上出发(化合物结构如图1所示),分析化合物抗氧化构效关系如下文所述.
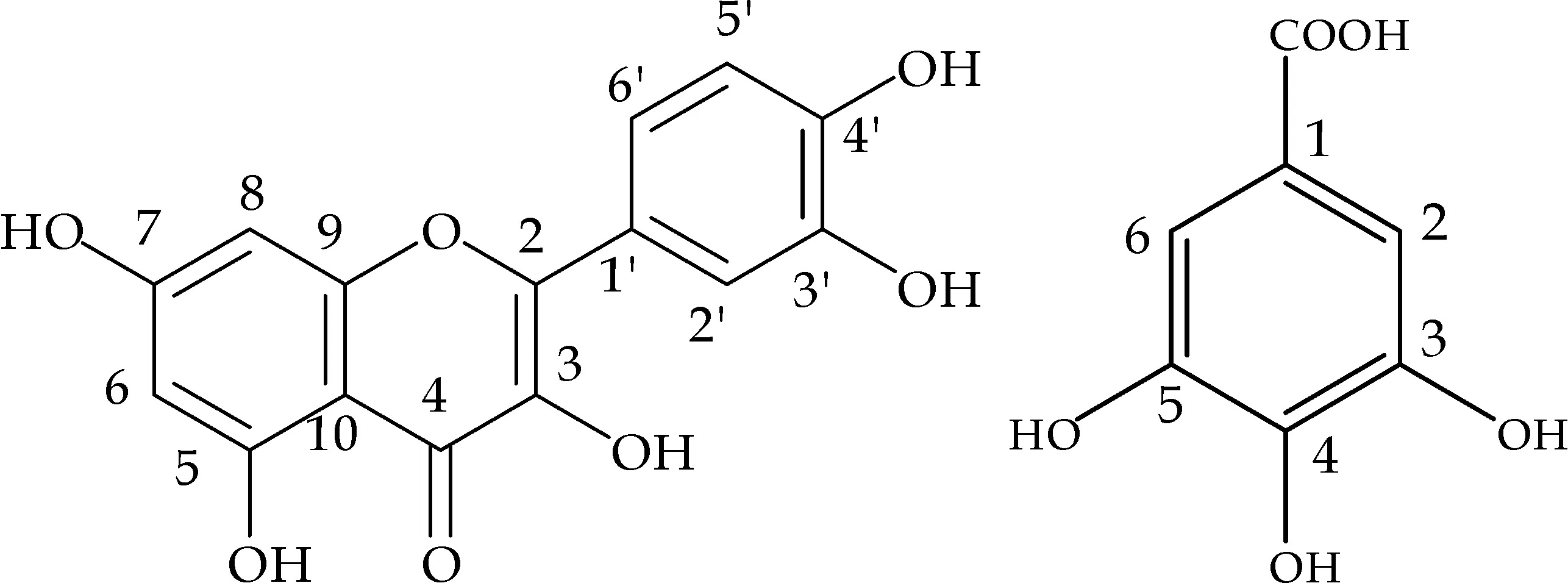
(a)槲皮素 (b)没食子酸
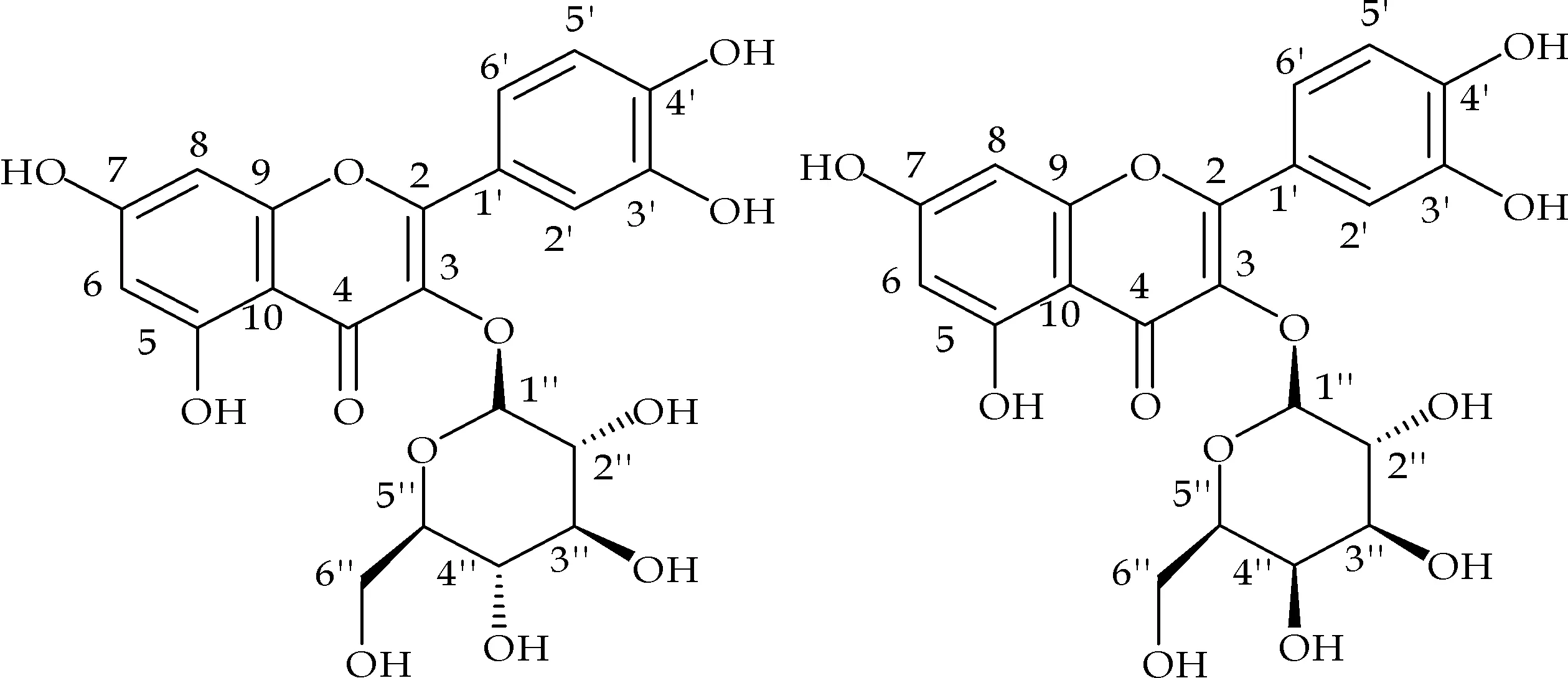
(c) 槲皮素-3-O-β- (d) 槲皮素-3-O-β- D-葡萄糖苷 半乳糖苷
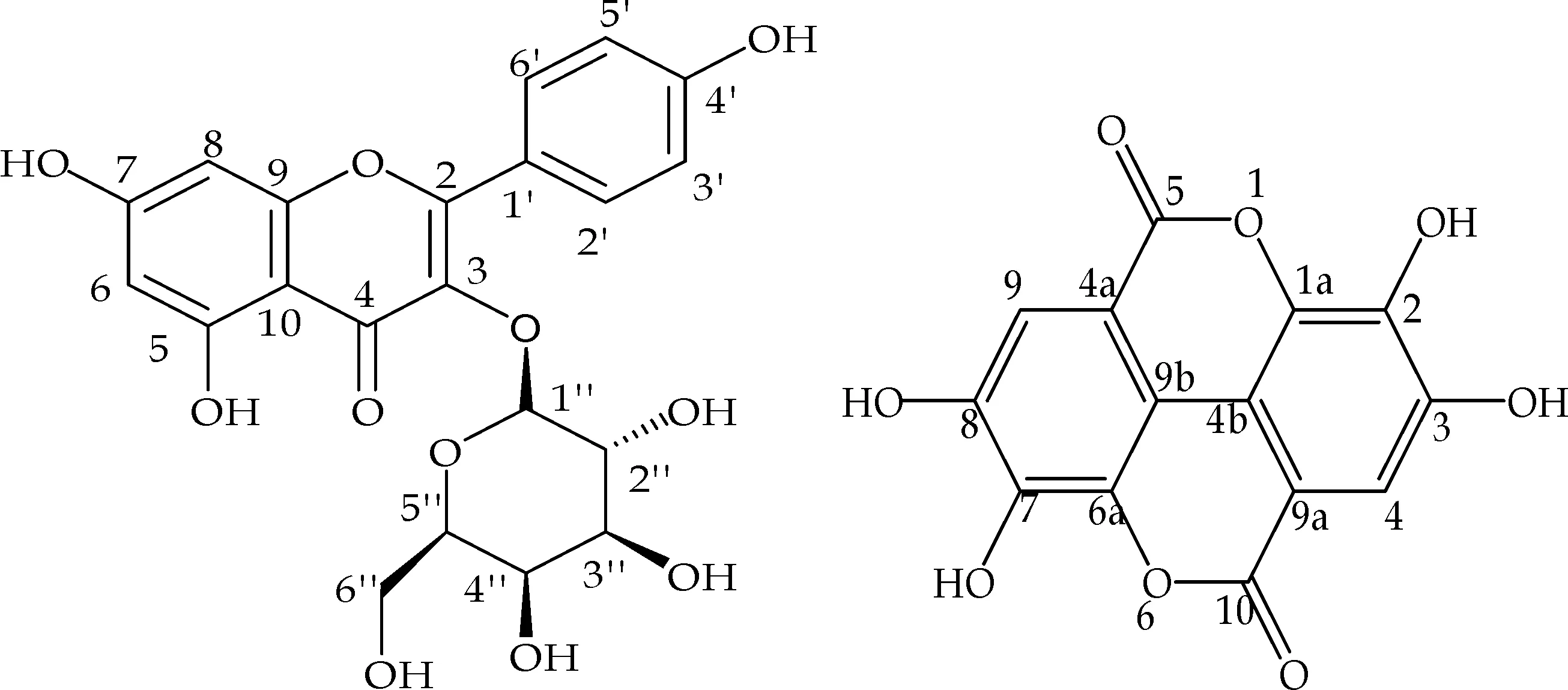
(e) 山柰酚-3-O-β- (f)鞣花酸 D-半乳糖苷图1 各化合物结构
槲皮素、没食子酸以及鞣花酸的抗氧化能力相当,原因可能在于三者结构中所具有的酚羟基的比例相当.槲皮素苷和山奈酚苷在结构上的差别在于山柰酚苷比槲皮素苷在C环3′位上少了一个羟基,从而不难理解两者抗氧化能力上的差异.
抗氧化能力槲皮素>槲皮素-3-O-β-D-葡萄糖苷=槲皮素-3-O-β-半乳糖苷>山柰酚-3-O-β-D-半乳糖苷,可能是由于C环3位上的苷化降低了酚羟基在化合物中的比例,同时增大了空间位阻,减弱了其他酚羟基上氢的活性,从而使它对超氧自由基O2·的清除作用减弱[14,15].
3 结论
对水蓼中分离得到的化合物单体的体外抑菌和抗氧化活性研究表明,黄酮类化合物有较好的抑制细菌生长的作用,同时具有非常显著的抗氧化作用.首次从水蓼中分离得到的化合物也表现出一定的抑菌活性,且具有良好的抗氧化活性.弥补了秦岭地区水蓼活性研究方面的不足,为进一步开发和利用水蓼的药用植物资源奠定了一定的理论基础.
[1] 王慧春.蓼属植物的黄酮类化合物研究[J].青海草业,2008,17(3):38-41.
[2] 王开金,张颖君,杨崇仁.蓼属植物的化学成分与生物活性研究进展[J].天然产物研究与开发,2006,18(1):151-164.
[3] 王玉萍,王庆艳,王玉漾.中国蓼属药用植物综述[J].时珍国药研究,1996,7(3):47-48.
[4] 王 珂,侯元同,高召兰,等.中国蓼族(蓼科)植物区系的研究[J].广西植物,2007,27(2):197-202.
[5] 杨新周,郝志云,朱以常,等.辣蓼不同部位的抗氧化活性[J].江苏农业科学,2014,42(2):284-285.
[6] 曾维爱,谭济才,谭 琳,等.辣蓼的应用及其功效[J].中国农学通报,2006,22(8):369-372.
[7] 曾维爱,周国生,邓正平,等.蓼科杀虫植物——辣蓼[J].中国农学通报,2008,24(10):450-452.
[8] 黄红泓,甄汉深.中草药辣蓼近年来的研究进展[J].中国民族民间医药,2013,22(1):38-40.
[9] 杨秀芳,王改利,马养民,等.水杨梅中化学成分活性的究[J].陕西科技大学学报(自然科学版),2014,32(1):123- 127.
[10] 曾维才,石 碧.天然产物抗氧化活性的常见评价方法[J].化工进展,2013,32(6):1 205-1 213,1 247.
[11] 陈玉霞,刘建华,林 峰,等.DPPH和FRAP法测定41种中草药抗氧化活性[J].实验室研究与探索,2011,30(6):11-14.
[12] 张金桐,宋仰弟.黄酮类化合物的生物活性与电子结构关系的量子化学研究[J].山西农业大学学报,1993,13(2):137-140,185.
[13] Liao H R,Chang Y S,Yang L L,et al.QSAR analysis of the lipid peroxidation inhibitory activity with structure and energetics of 36 flavonoids derivatives[J].Journal of the Chinese Chemical Society,2006,53(6):1 251-1 261.
[14] 陆 曦,王 磊,魏 红,等.黄酮类化合物抗氧化活性的构效关系[J].食品科学,2006,27(12):233-237.
[15] Rong Y,Wang Z,Wu J,et al.A theoretical study on cellular antioxidant activity of selected flavonoids[J].Spectrochimia Acta Part A:Molecular & Biomolecular Spectroscopy,2012,93:235-239.
【责任编辑:陈 佳】
Antibacterial and antioxidant activity of the chemical compositions ofPolygonumhydropiperL.
MA Yang-min, LI Meng-yun, GUO Lin-xin, QIAO Ke , FAN Chao
(College of Chemistry and Chemical Engineering, Key Laboratory of Auxiliary Chemistry & Technology for Chemical Industry, Ministry of Education, Shaanxi University of Science & Technology, Xi′an 710021, China)
To study on the antibacterial activity of the 11 compounds isolated fromPolygonumhydropiperL. and some compounds′ antioxidant activity was measured by microdilution method on 96-well plates. The minimum inhibiting concentration (MIC) was used for evaluating the degree of antibacterial ability of each compound.The antioxidant capacity was measured by the DPPH radical-scavenging rate.The curves were plotted and the IC50of compounds was determined by using origin 70 software,with IC50expressing antioxidant capacity of different compounds.The results showed that the 11 compounds fromPolygonumhydropiperL. manifested different degree of antibacterial activity,and the flavonoids had good antibacterial effect,quercetin showed the best activity to restrain the growth of theStaphylococcusaureuswith MIC value of 31.3μg·mL-1.The compounds detected showed good antioxidant activity,and the antioxidant effect of quercetin, gallic acid and ellagic acid are better than vitamin C.Results indicate that these compounds isolated fromPolygonumhydropiperL. have good antibacterial and antioxidant activity.The different activity of flavonoids is because of their different structures.The more enol structure in the flavonoids,the stronger antioxidant capacity it has.
PolygonumhydropiperL.; chemical compounds; antibacterial activity; antioxidant activity; QSAR
2016-11-19
国家公益性行业(林业)科研专项项目(200904004)
马养民(1963-),男,陕西咸阳人,教授,博士生导师,研究方向:天然产物化学及有机合成
1000-5811(2017)01-0120-04
R932
A

