具有α-葡萄糖苷酶抑制性益生乳酸菌的筛选
吕嘉枥, 张军蒙, 余 芳, 田延楚
(陕西科技大学 食品与生物工程学院, 陕西 西安 710021)
具有α-葡萄糖苷酶抑制性益生乳酸菌的筛选
吕嘉枥, 张军蒙, 余 芳, 田延楚
(陕西科技大学 食品与生物工程学院, 陕西 西安 710021)
通过对从发酵果蔬中初筛得到的18株乳酸菌益生性能中的产酸、耐受人工胃肠液能力的研究,得出18株乳酸菌所产总酸为0.8%到3.2%之间,其中有2株植物乳杆菌的总酸在3%以上,3株乳酸菌在1%以下.模拟人体内环境进行人工胃液、肠液耐受性实验中,存活率低于20%的有3株菌株,其余15株菌存活率都处于20%以上的水平.接下来进行α-葡萄糖苷酶抑制性研究,最终检测到这18种益生乳酸菌对α-葡萄糖苷酶都有不同的抑制效果,从5.71%到37.48%不等,其中抑制率最高的乳双歧杆菌1号菌株达到了37.48%,最低的为鼠李糖乳杆菌1号为5.71%.最终筛选出乳双歧杆菌1号菌株、干酪乳杆菌2号菌株、植物乳杆菌2号菌株、未培乳酸菌1号菌株为具有良好益生特性与α-葡萄糖苷酶抑制性的4株益生乳酸菌.
乳酸菌; 人工胃液; 人工肠液;α-葡萄糖苷酶
0 引言
益生菌( Probiotics) 是指经摄取适当量后通过改善肠道菌群平衡对宿主的身体健康发挥有效作用的活性微生物[1].益生菌的益生特性包括很多种,其中对胃肠液的耐受性是其比较基本的益生特性,乳酸菌作为益生菌中代表性的分支在自然界中大量存在,乳酸菌产生的有机酸能降低肠道内的pH和Eh(氧化还原电势),使肠道处于酸性环境[2],但只有具备胃肠液耐受性的乳酸菌才能定植在人体的肠道中.所以筛选出具有胃肠液耐受性的乳酸菌是益生乳酸菌研究的一个重要方面.
有的益生乳酸菌由于对小肠上的α-glucosidase活力有抑制作用,可延缓碳水化合物的消化和吸收,从而降低餐后高血糖[3].近年来,已有许多种益生乳酸菌被证实当应用于动物模型和临床试验中对糖尿病具有预防或治疗的作用.益生乳酸菌有利于控制体内葡萄糖代谢过程中相关产物的分解与合成,维持机体血糖平衡[4].益生乳酸菌引起了越来越多国内外研究者的青睐,具有巨大的研究价值和应用潜力.但目前国内对于乳酸菌降糖作用的研究较少[5],所以筛选具有α-葡萄糖苷酶抑制性作用的益生乳酸菌对于益生乳酸菌的降血糖作用研究能够提供一定的基础.
本研究对从陕西、甘肃等地区采集的自然发酵产品如发酵果蔬、发酵乳样品筛选分离得到的18株乳酸菌,模拟人体内环境测试其对人工胃液与人工肠液的耐受性及产酸特性.通过改进反应体系后研究益生乳酸菌对α-葡萄糖苷酶的抑制性,从而筛选出具有α-葡萄糖苷酶抑制性作用的益生乳酸菌.
1 材料与方法
1.1 材料
1.1.1 试验用菌株
从陕西、甘肃等地区采集的自然发酵产品如发酵果蔬、发酵乳样品初筛得到18株乳酸菌,植物乳杆菌1号(Lactobacillusplantarum简称LP01),植物乳杆菌2号(Lactobacillusplantarum简称LP02),植物乳杆菌3号(Lactobacillusplantarum简称LP03),植物乳杆菌4号(Lactobacillusplantarum简称LP04),嗜酸乳杆菌1号(Lactobacillusacidophilus简称LA01),鼠李糖乳杆菌1号(Lactobacillusrhamnosus简称LCR01),未培乳酸菌1号(Unculturedlactobacillus简称UL01),未培乳酸菌2号(Unculturedlactobacillus简称UL02),保加利亚乳杆菌1号(Lactobacillusbulgaricus简称LB01),粪链球菌1号(Enterococcusfaecalis简称EF01),副干酪乳杆菌1号(Lactobacillusparacasei简称LCP01),干酪乳杆菌1号(Lactobacilluscasei简称LC01),干酪乳杆菌2号(Lactobacilluscasei简称LC02),嗜热链球菌1号(Streptococcusthermophilus简称ST01),哈尔滨乳杆菌1号(Lactobacillusharbinensis简称LH01),哈尔滨乳杆菌2号(简称LH02),罗伊氏乳杆菌1号(Lactobacillusreuteri简称LR01),乳双歧杆菌1号(Bifidobacteriumanimalissubsp.lactis简称BA01).陕西科技大学食品与生物工程学院保藏.
1.1.2 培养基与试剂
(1)培养基:MRS肉汤培养基,MRS固体培养基.
(2)试剂:胃蛋白酶(1∶10 000)、胰蛋白酶(1∶250),来源于黑曲霉的α-葡萄糖苷酶(10万u/g),对硝基苯基-α-D-吡喃葡萄糖苷(PNPG).
1.1.3 仪器与设备
Leica-DM750生物显微镜,AC-0629普通光学显微镜,超净工作台,XW.80A旋涡混合器,DHP9080电热恒温培养箱,LS-C50L型立式压力蒸汽灭菌锅,UV-2600紫外可见分光光度计,HC-3018R冷冻离心机,pH计,恒温水浴箱, MK3酶标仪.
1.2 方法
1.2.1 乳酸菌益生性能的研究
(1)酸度的测定:接种1%的菌种后48 h后用0.1 mol/L NaOH进行滴定后换算酸度,计算方法参考文献[6].
(2)乳酸菌在体外模拟人体胃肠环境耐受性试验样液:人工胃液与人工肠液依据中国药典进行制备[7].
①乳酸菌耐受人工胃液试验:将制取的菌悬液调整至109cfu/mL,取1 mL加入9 mL制取的人工胃液中[8],充分混匀后取1 mL混合液稀释到一定梯度,使用高层琼脂柱法测其0 h的活菌数,同时放置于37 ℃下培育3 h后取出,再次测其活菌数,通过与0 h的活菌数之比计算出存活率.公式如下:

100%
(1)
②乳酸菌耐受人工肠液试验:将上述在人工胃液里培育3 h后的乳酸菌菌液吸取1 mL加入9 mL的人工肠液中并在37 ℃下培育,使用高层琼脂柱法[8],分别测定其在0 h、2 h、6 h的活菌数,与0 h的活菌数进行对比,同上计算其存活率.
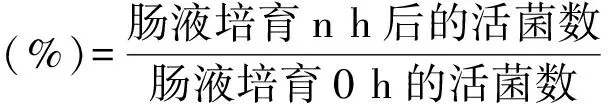
100% (n=2、6)
(2)
1.2.2 益生乳酸菌对α-葡萄糖苷酶抑制性研究
(1)α-葡萄糖苷酶抑制性试验反应体系的确定
首先使用紫外分光光度计进行测定,最后再等比例缩小反应体系.
①底物浓度的确定:确定反应体系为3.5 mL,其中1 mLPBS,将底物1mLPNPG浓度稀释为以下梯度,25、20、15、10、5、4、3、2、1、0.5 mmol/L,体系中其它条件暂定,20 U/mLα-葡萄糖苷酶溶液0.5 mL,反应30 min后加1 mL1 moL/L Na2CO3终止反应1 min,在405 nm下测其OD值.
②酶液用量的确定:酶活力20 U/mLα-葡萄糖苷酶溶液,在以上反应体系中加酶液量分别为:0.3,0.4,0.5,0.6,0.7 mL,反应30 min后再在405 nm下测其吸光度.
③反应时间的确定:分别在反应10、20、30、40、50 min后再在405 nm下测其OD值.
④菌体浓度的确定:确定以上条件后,其他条件不变,每株乳酸菌将制取的菌悬液密度分别调整为1×109、1×108、1×107、1×106、1×105cfu/mL,测试每株菌在浓度为多少时可以使吸光度值在以上反应体系中达到可置信区间.
(2)益生乳酸菌对α-葡萄糖苷酶抑制性试验
①菌悬液的制备:将筛选出的菌种接种到液体MRS培养基中进行连续活化三代后使用,然后在转速为4 000 r/min温度为4 ℃的条件下进行离心10 min,倒掉上清液取沉淀用0.85%的生理盐水进行重悬,制取菌悬液.
②确定了反应体系后等比缩小反应体系,按照计量顺序添加反应物,在总体积210μL的体系中,添加50μL PBS(0.1 mol/L pH6.8),再加入50μL 20 mmol/L的对硝基苯酚-α-D-吡喃葡葡糖苷(PNPG)溶液及25μL待测乳酸菌的菌悬液,将混合物于37 ℃孵化10 min,加入30μLα-葡萄糖苷酶溶液20 U/mL继续反应20 min,加入50μL 1 mol/L Na2CO3作为反应终止液,将反应液于405 nm处测其吸光值,吸光值与对硝基苯酚PNP的游离量成正比,反应体系中采用pH6.8的0.1 mol/L PBS作为α-葡萄糖苷酶溶液及待测样品的空白对照,进行反应后计算益生乳酸菌对α-葡萄糖苷酶抑制性,其抑制率计算公式如下:
α-葡萄糖苷酶酶活抑制率(%)=
(3)
式(3)中:A为样品组含有样品溶液以及α-葡萄糖苷酶溶液;B为样品空白组含有样品溶液不含α-葡萄糖苷酶溶液;C为对照组不含有样品溶液含α-葡萄糖苷酶溶液;D为空白组不含有样品溶液以及α-葡萄糖苷酶溶液.
2 结果与讨论
2.1 乳酸菌的益生特性的研究
2.1.1 产酸特性的研究
菌株以1%的接种量接种之后,48h后测定其发酵液的总酸,通过每株菌产酸量对比得出该菌的产酸特性,其结果如图1所示.

图1 菌株培养液48 h酸度
从图1中可以看出,18株菌株在48 h的产酸能力,菌株48 h的产酸试验中,LC01与LC02的总酸均在3%以上,属于高产酸性乳酸菌[9],菌株48 h产酸能力较低的有EF01、ST01、BA01、LH01四株菌株.产酸能力也是益生菌益生性能评价的一个重要指标[10],所产的酸可以使肠道pH降低,并且可以有效地抑制肠道内有害菌群的生长.产酸能力可作为筛选具有α-葡萄糖苷酶抑制性作用的益生乳酸菌的一个参考指标.
2.1.2 乳酸菌耐受人工胃液研究
将1 mL菌悬液加入9 mL人工胃液之后,分别在0 h和3 h测定其活菌数,存活率的结果如图2所示.
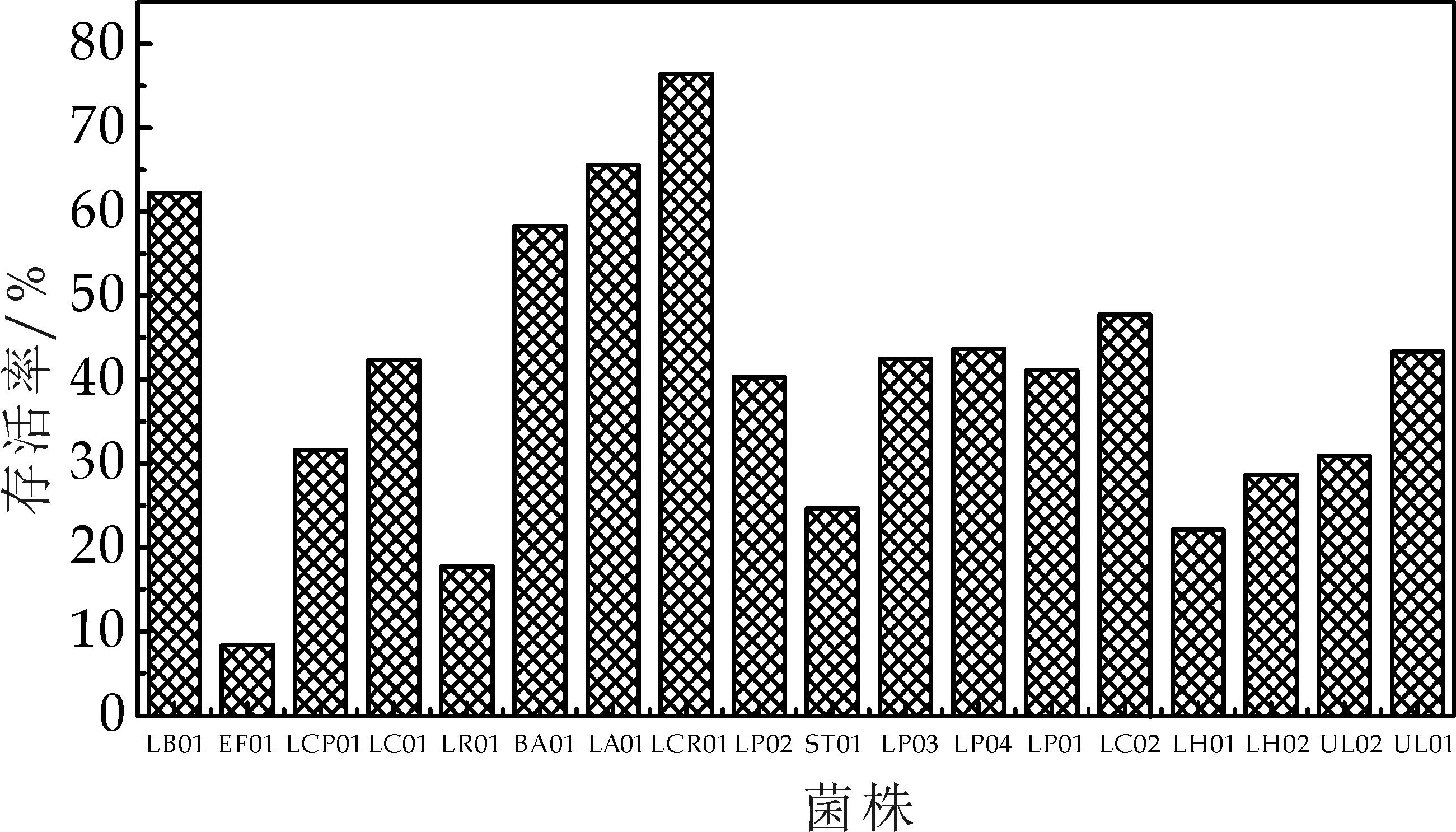
图2 菌种耐受人工胃液
菌株耐受胃液能力的试验中,EF01和LR01存活率分别为8.37%与17.75%,剩余16株乳酸菌存活率均在20%以上,活菌数均在108cfu/mL以上.菌株LB01、LA01、LGG01存活率均达到了60%以上.菌株进入消化道之后,胃液中较低的pH会使一部分菌体死亡,而菌株进入肠道定植是其发挥作用的前提,所以存活率越高的菌株越有发挥作用的可能.通过体外模拟人体肠胃液的试验可以筛选出较有价值的菌株[11].
2.1.3 乳酸菌耐受人工肠液研究
将从人工胃液培育之后的菌株胃液混合液1 mL加入9 mL人工肠液,分别在0 h、2 h、6 h测定其活菌数,存活率的结果如图3所示.
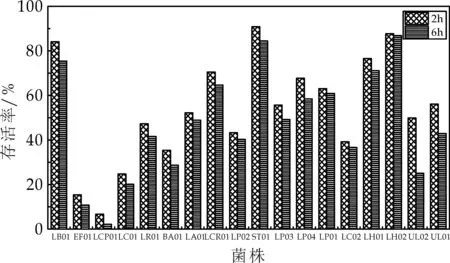
图3 菌种耐受人工肠液结果
由图3中可知,菌株耐受肠液能力的试验中,EF01菌株2 h和6 h的存活率分别为15.38%和10.73%,LCP01分别为6.67%与2.16%,剩余16株乳酸菌存活率均在20%以上,活菌数均在108cfu/mL以上.菌株LB01、ST01、LH02存活率均达到了75%以上.
在以上模拟人体内环境耐受性试验中,EF01对于胃液与肠液耐受性均比较敏感.LCP01对于人工胃液耐受性一般,对于人工肠液较为敏感,6 h存活率仅为2.16%,LR01耐受胃液能力较低为17.75%.
2.2 益生乳酸菌对α-葡萄糖苷酶抑制性研究
2.2.1α-葡萄糖苷酶抑制性试验反应体系的确定
(1)底物浓度的确定
从图4可以看出,当底物浓度达到20 mmol/L后吸光度值不再增加,所以20 mmol/L为该体系底物浓度.
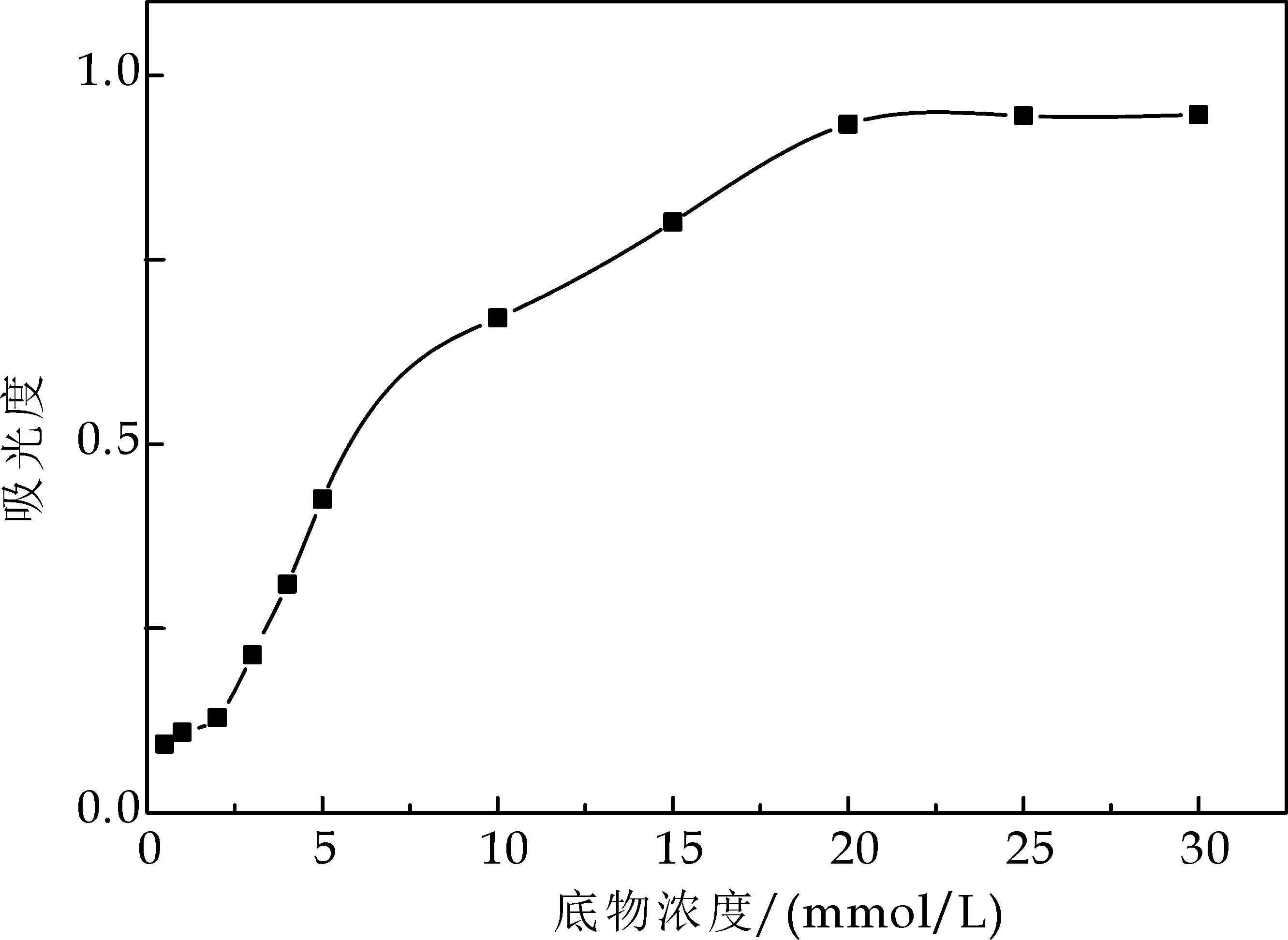
图4 底物浓度
(2)酶液量的确定
由图5可知,当酶液量达到0.6 mL时其吸光度值基本保持稳定,选择0.6 mL为体系中的酶液量.
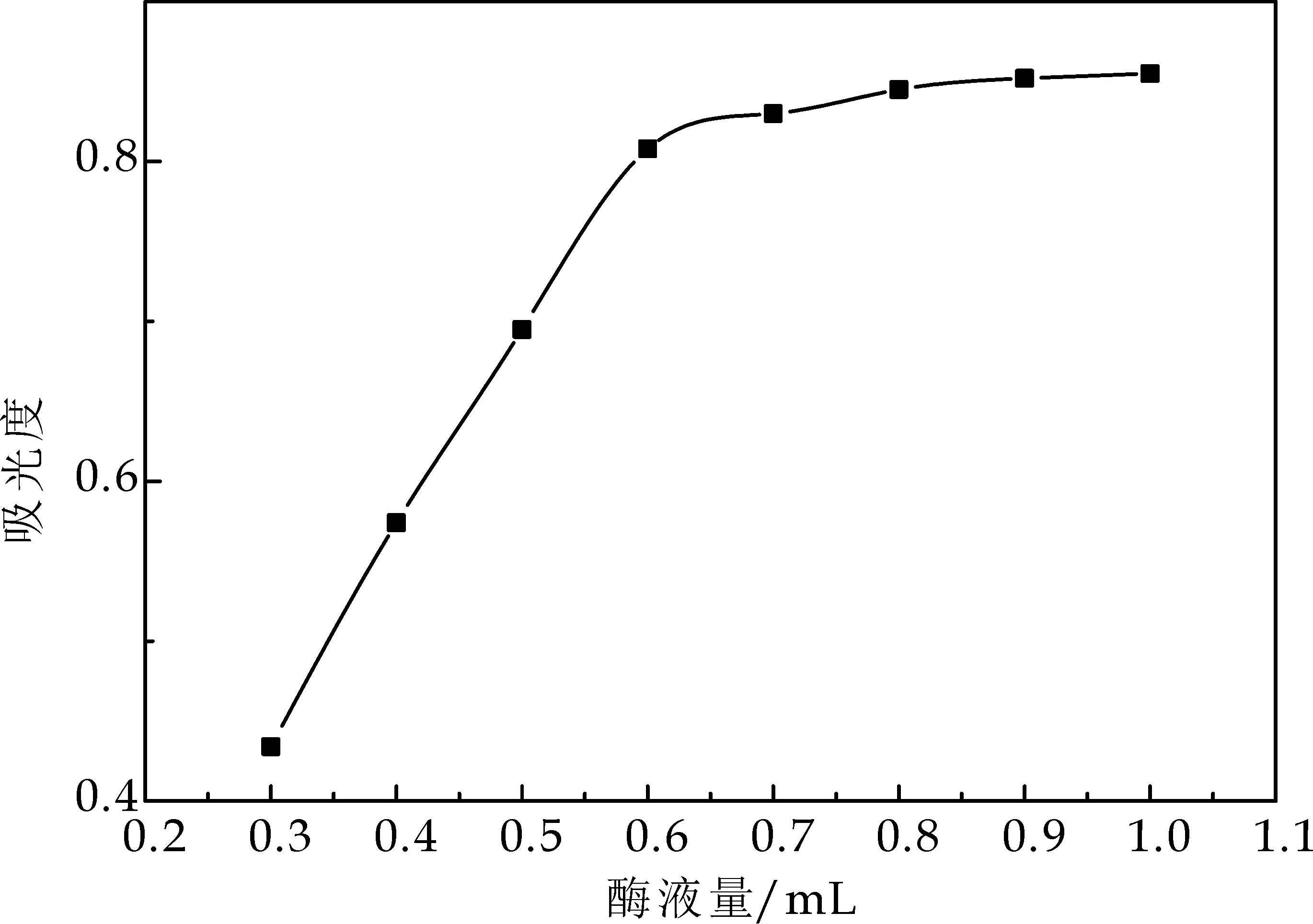
图5 酶液量
(3)反应时间的确定
由图6可知,当反应时间超过30 min后其OD值基本保持不变,所以选择30 min为其体系反应时间.

图6 反应时间
(4)乳酸菌的菌体反应浓度的确定
在以上确定的反应条件下,通过试验得出菌种BA01与LH02的菌体反应浓度为107cfu/mL,其余16株菌种菌体反应浓度均在109cfu/mL.此浓度下在体系中吸光度值可以达到置信区间.
2.2.2 菌株对α-葡萄糖苷酶抑制性研究
按照确定好的反应体系后,依照计量顺序依次加入反应物反应后计算菌株对α-葡萄糖苷酶抑制率,其结果如图7所示.
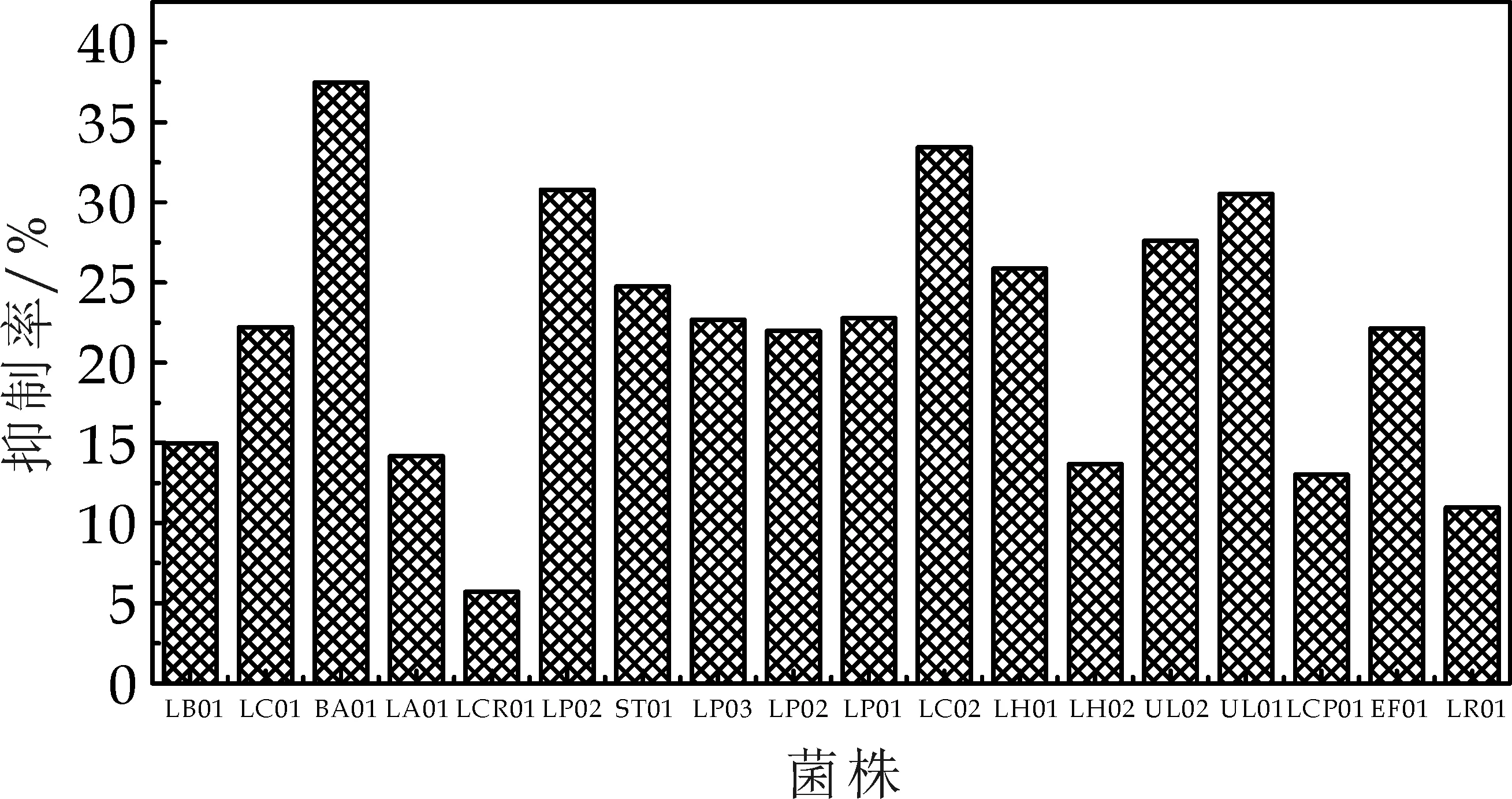
图7 乳酸菌菌体对α-葡萄糖苷酶抑制率
乳酸菌通过人体胃肠液的考验,最终定植于人体肠道内,其活的菌体对小肠上的α-glucosidase活力的抑制,可延缓碳水化合物的消化和吸收,从而降低餐后高血糖,其作用是最直接的[12].从表1可以看出这18株乳酸菌在不同程度上对于α-葡萄糖苷酶均有抑制作用,在这18株菌株里面BA01菌株对α-葡萄糖苷酶抑制率最高,达到了37.48%,其次是LC012菌株为33.79%,LP02与UL01分别为30.79%与30.52%,这4株益生乳酸菌抑制率均达到了30%以上.
3 结论
益生乳酸菌占已开发的益生菌数量的绝大部分,其益生性能是多种多样的[13],本研究对从传统发酵产品中筛选到的乳酸菌进行了一系列的测试,通过对这18株菌模拟人体内环境进行的人工肠胃液耐受性实验中,可以看出EF01对于胃液与肠液耐受性均比较敏感.LCP01对于人工胃液耐受性一般,对于人工肠液较为敏感,6 h存活率仅为2.16%,LR01耐受胃液能力较低为17.75%,其余15株菌对于胃液与肠液的耐受性都处20%以上的存活率的水平,活菌数在1×108 cfu/mL以上.Gillilands等[14]研究认为摄入1×106cfu/mL及以上的益生乳酸菌就可改善肠道微生物平衡,发挥益生作用.最终检测到这18种益生乳酸菌对α-葡萄糖苷酶都有不同的抑制效果,从5.71%到37.48%不等,这与陈佩等[15]所筛选出的1株具有潜在降糖作用的干酪乳杆菌CCFM0412对α-葡萄糖苷酶抑制率为29.61%相比略高.也比商业菌株鼠李糖乳杆菌GG 29.31%的抑制率略高.
益生乳酸菌发挥作用的前提是对人体胃肠液有良好的耐受性,在益生乳酸菌α-葡萄糖苷酶抑制性研究中综合考虑,选取耐受性良好且对α-葡萄糖苷酶抑制能力强的乳酸菌菌株进行后续研究,筛选出BA01菌株、LC02菌株、LP02菌株、UL01菌株为最终具有良好益生性能与α-葡萄糖苷酶抑制性的4株益生乳酸菌.本研究为具有降血糖能力的益生菌的筛选研究提供了一定的基础,乳酸菌产酸能力与降血糖的关系也可作为后期研究的一个方向,对于其降血糖其他方面的能力与其机理的研究还需进一步深入探究.
[1] 周凌华,王 豪,王荫榆,等.功能性益生乳酸菌的研究进展[J].天然产物研究与开发,2012,24(7):990-997.
[2] 郭志杰.仔猪源乳酸菌的筛选及其对仔猪作用的影响[D].哈尔滨:东北农业大学,2012.
[3] 范文娅,吴正钧,郭本恒.乳酸菌的降血糖作用研究进展[J].天然产物研究与开发,2012,24(9):1 323-1 329.
[4] 丁武蓉.青藏高原传统发酵牦牛奶中乳酸菌多样性及其益生功能研究[D].兰州:兰州大学,2014.
[5] 陈 佩.益生乳酸菌的降糖作用及其机制的研究[D].无锡:江南大学,2014.
[6] 赵 婧,李 慧,周春丽,等.高产酸乳酸菌的筛选、鉴定和生长特性研究[J].食品工业科技,2013,34(3):173-176.
[7] 国家药典委员会.中华人民共和国药典二部[M].京:化学工业出版社,2010.
[8] 王立平.内蒙古传统酸马奶酒中乳杆菌潜在益生特性的研究[D].呼和浩特:内蒙古农业大学,2005.
[9] 马春丽,张兰威.高产酸性能乳酸菌的筛选及产酸机理研究[J].食品工业科技,2010,31(1):189-190.
[10] 李莉媛.19株饲用益生菌体外性能评价及优良菌株的筛选[D].郑州:河南工业大学,2012.
[11] Vinderola C G,Reinheimer J A,Farnworth E R.Lactic acid starter and probiotic bacteria:A comparative “in vitro” study of probiotic characteristics and biological barrier resistance[J].Food Research International,2003,36(9-10):895-904.
[12] 肖 荣,王远亮,李宗军.益生性乳酸菌黏附性研究进展[J].食品与发酵工业,2008,34(5):134-137.
[13] 林鸿佳.具有α-糖苷酶抑制作用的啤酒糟多肽的分离及其作用机理研究[D].广州:华南理工大学,2013.
[14] Gilliland S E,Walker D K.Factorsto consider when selecting a culture ofLactobacillusacidophilusas a dietary adjunct to produce a hypocholesterolemic effect in humans[J].J Dairy Sci,2003,73(4):905-911.
[15] 陈 佩,党 辉,张秋香,等.1株具有潜在降糖作用的益生菌的筛选[J].中国食品学报,2014,14(11):27-33.
【责任编辑:陈 佳】
Screening of probiotic lactic acid bacteria withα-glucosidase inhibition activity
LV Jia-li, ZHANG Jun-meng, YU Fang, TIAN Yan-chu
(School of Food and Biological Engineering, Shaanxi University of Science & Technology, Xi′an 710021, China)
The eighteen lactic acid bacteria strains which preliminary screening from the fermentation of fruits and vegetables,by research on their prebiotic properties of acid production ability and withstand artificial gastrointestinal fluid ability,we found that total acid amount produced by 18 lactic acid bacteria strains was between 0.8% to 3.2%,Which have two lactic acid bacteria strains total acid amount more than 3%,three lactic acid bacteria strains were below 1%.In the research of tolerance with simulation environment of the human artificial gastric juice and intestinal juice test,we found that the survival rate of three strains was less than 20%,the remaining 15 strains survival rate are more than 20%.Then wasα-glucosidase inhibition study,we finally detected that this 18 lactic acid bacteria strains have differentα-glucosidase inhibition activity,ranging from 5.71% to 37.48%,the highest inhibition rate wasBifidobacteriumanimalissubsp.lactisNo.1 which reached 37.48%,the lowest forLactobacillusrhamnosusNo.1 was 5.71%.Finally we selected four probiotic lactic acid bacteria strains have good probiotic properties andα-glucosidase inhibition activity which wereBifidobacteriumanimalissubsp.lactisNo.1,LactobacilluscaseiNo.2,LactobacillusplantarumNo.2,UnculturedlactobacillusNo.1.
lactic acid bacteria; artificial gastric juice; artificial intestinal juice;α-glucosidase
2016-09-27
陕西省科技厅科技统筹创新工程计划项目(2011KTCQ03-08); 咸阳市科技计划项目(2013K06-09)
吕嘉枥(1964-),女,陕西三原人,教授,研究方向:应用微生物学
1000-5811(2017)01-0129-05
O939.99
A

