甘草酸二铵对小鼠急性肝衰竭发生过程中HMGB1表达的影响
张留鲁 罗新华 危敏
(贵州省人民医院,贵州 贵阳 550002)
甘草酸二铵对小鼠急性肝衰竭发生过程中HMGB1表达的影响
张留鲁 罗新华△危敏
(贵州省人民医院,贵州 贵阳 550002)
目的 探讨甘草酸二铵对小鼠急性肝衰竭发生过程中小鼠肝组织高迁移率族蛋白B1(HMGB1)表达的影响。方法 取雄性昆明种小鼠72只,随机分为正常对照组、急性肝功能衰竭组及甘草酸二铵治疗组。模型组及治疗组予D-Galn 500 mg/kg及LPS 10 μg/kg腹腔注射建立急性肝功能衰竭小鼠模型,并于建模1 h后予以甘草酸二铵70 mg/kg对治疗组小鼠进行灌胃处理,正常对照组及模型组予等量生理盐水灌胃。以建模后4,8,12,24 h分别取静脉血以常规生化方法检测小鼠血清谷丙转氨酶(ALT)、谷草转氨酶(AST)、总胆红素(TBIL)水平,HE染色法检查肝组织病理学变化,采用免疫组织化学法及实时荧光定量PCR检测小鼠肝组织中HMGB1的蛋白表达量及mRNA水平。结果 模型组及治疗组小鼠血清ALT和AST水平均显著高于正常对照组(P<0.01),且模型4,8 h组小鼠血清ALT和AST含量均高于相应治疗组(P<0.05),模型8,12,24 h组及甘草酸二铵治疗12,24 h组小鼠血清TBIL水平均显著高于正常对照(P<0.05)。免疫组化结果发现,模型8,12,24 h组及治疗8,12,24 h组小鼠肝组织中HMGB1蛋白表达水平较相应正常对照组显著增加(P<0.01),且随肝衰竭发展明显增加,模型8,12 h组HMGB1蛋白表达量高于相应甘草酸二铵治疗组(P<0.05)。Real time-PCR结果显示,模型组和治疗8,12,24 h组小鼠肝组织HMGB1 mRNA表达量高于正常对照组(P<0.05),模型8 h、12 h组HMGB1 mRNA表达量高于相应治疗组(P<0.05)。结论 HMGB1在小鼠急性肝功能衰竭过程中发挥了重要作用。甘草酸二铵可能通过抑制HMGB1的产生减轻肝损伤。
急性肝衰竭; HMGB1; RAGE; 甘草酸二铵
急性肝功能衰竭(acute liver failure,ALF)是由多种原因引起的肝细胞急性大量坏死和严重肝功能损伤所致的临床综合征。具有病情进展快、治疗难度大、并发症多、死亡率高、预后极差的特点,是当前肝病研究的热点和难点。在急性肝功能衰竭动物模型中,K.Takano 等[1]发现血清 HMGB1水平在肝功能损害时明显升高,予以HMGB1多克隆抗体降低血清HMGB1水平,可改善肝脏组织学损伤,并提高实验动物短期生存率,提示HMGB1参与并介导了急性肝损伤的发病过程,中和血清HMGB1可有效阻断急性肝功能损害进程,为提高急性肝功能衰竭患者治愈率提出了一种新的可能。甘草酸(Glycyrrhizin)是甘草根茎的提取物,它是甘草次酸和葡萄糖醛酸的共轭化合物。研究证实[2],甘草酸可以结合游离的 HMGB1、抑制 HMGB1的释放,目前关于甘草酸制剂对小鼠急性肝衰竭发生过程中HMGB1表达的研究尚鲜有报道。本研究拟建立小鼠急性肝衰竭模型,以甘草酸二铵作为治疗药物,观察甘草酸二铵对小鼠急性肝功能衰竭病程中HMGB1表达的影响。
1 材料及方法
1.1 实验动物 雄性昆明种SCXK(黔)2012-001小鼠72只,体质量(20±1.7)g。适应性喂养3 d后,随机分为:正常对照组,肝衰竭模型4 h组、8 h组、12 h组及24 h组,甘草酸二胺治疗4 h组、8 h组、12 h组、24 h组,每组各8只。在第4,8,12小时和第24小时(实验中18 h后死亡小鼠计入24 h组)眼球取血后、断颈处死各组小鼠,留取血液及全部肝脏。血液4 ℃离心1 500 rpm ×10 min后,分离血清,置-80 ℃冰箱保存。取各小鼠右叶肝组织1.3 mm3大小固定于4%中性甲醛固定,其余肝组织置-80 ℃冰箱保存。
1.2 检测指标及方法
1.2.1 血清ALT、AST、TBIL含量检测 血清ALT、AST、TBIL含量测定采用Siemens Advia 1650全自动生化分析仪,由贵州省人民医院生化科严格按照试剂盒要求测定。
1.2.2 光镜下观察肝脏组织结构 肝右叶组织浸于4%中性甲醛缓冲液中固定48 h以后,转移到0.1 mol/L的PBS溶液中保存,常规石蜡包埋切片行HE染色。
1.2.3 免疫组织化学检测高迁移率蛋白(HMGB1)的表达 采用SP法,微波加热抗原修复,以DAB显色。兔抗人HMGB1单克隆抗体为武汉博士德生物技术公司产品。操作程序按说明书进行。阴性对照以PBS替代一抗,用已知阳性标本作阳性对照。染色结果判断 光镜下观察:细胞呈棕黄色为阳性表达细胞,每张切片在高倍镜下随机取5个视野,分别按染色深度和阳性细胞的分布作如下评分:(1)无着色为 0 分,淡黄色为 1 分,棕黄色为 2 分,棕褐色为 3 分;(2)阳性范围:没有阳性细胞为 0 分,阳性细胞百分比<10%为 1 分,阳性细胞百分比11%~50%为2 分,阳性细胞百分比51%~80%为 3 分,阳性细胞百分比>80%为 4 分。以二者分数乘积,通过两者乘积结果进行半定量统计。
1.2.4 荧光实时定量PCR 肝脏组织50 mg加入Trizol 1.0 mL充分匀浆后离心,取上清液,酶标仪测定RNA 浓度。进行逆转录,逆转录20 μL 体系(5×buffer 4 μL、10 mmol/L dNTP 2 μL、Olig DT 1 μL、RNase Inhibitor 1 μL、RNA 反转录酶 1 μL、RNase-free H2O 9.0 μL、模板2 μL) ; 逆转录条件: 42 ℃ 60 min、70 ℃ 5 min、4 ℃保存; RT-PCR 20 μL 体系( 2 ×SYBR Green 10 μL、primer mix 1.0 μL、RNase-freeH2O 7.0 μL、模板2.0 μL); 循环参数: 50 ℃ 120 s、95 ℃ 10 min、95 ℃ 15 s、60 ℃ 60 s ,共40个循环。HMGB1引物序列: 上游5’ CCAGCGAAGGCTATCACAAG 3’,下游5’TCATAAAGGGACAAACCACAGT 3’。β-actin 序列: 上游5’ GGAGATTACTGCCCTGGCTCCTA 3’,下游5’ GACTCATCGTACTCCTGCTTGCTG 3’。所有引物均采用Primer 3.0 设计并经过NCBI Blast 验证产物特异性。

2 结 果
2.1 各组小鼠血清ALT、AST、TBIL浓度比较 小鼠注射D-GalN+LPS后, 模型组及治疗组血清AST、ALT浓度逐渐升高,12 h达高峰,24 h维持在较高水平,模型组及治疗组血清AST、ALT浓度显著高于正常对照组小鼠(P<0.01),且模型组4,8 h小鼠血清AST、ALT浓度较对应治疗组增加,差异有统计学意义(P<0.05);肝衰竭组及治疗组,血清TBIL浓度逐渐升高,24 h达高峰,肝衰竭组8,12,24 h组及治疗12,24 h组血清TBIL浓度高于相应正常对照组小鼠(P<0.05),见表1。
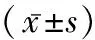
表1 各组小鼠血清ALT、AST、TBIL浓度
注:与正常组比较,#P<0.01,※P<0.05;与治疗组比较,&P<0.05。
2.2 各组小鼠肝组织学变化 正常对照组小鼠肝小叶结构完整,模型组随着给药时间延长,肝组织发生的病理改变逐渐加重, 4 h可见肝细胞轻度肿胀,嗜酸性变,炎细胞浸润,可见核内包涵体,肝细胞呈点状坏死;8 h肝细胞气球样变,汇管区及肝细胞间见炎细胞浸润伴出血,可见核内包涵体,肝细胞呈桥接坏死;12 h可见肝细胞片状坏死融合,核溶解、碎裂,汇管区及肝细胞间见较多炎细胞浸润伴少量出血;24 h肝细胞坏死更加明显,大片状坏死和少量出血,仅少量肝细胞残存,散在分布,纤维网状支架塌陷。治疗组与模型组相比有好转,4 h时仍可见多量嗜酸性变,炎细胞浸润较模型组少;8 h仍可见多量嗜酸性变,出血,炎细胞浸润较模型组少;12,24 h与模型组相比,坏死减轻,炎细胞浸润较模型组少,见图1。

正常组 (HE,×400) 模型8 h组(HE,×400) 治疗24 h组 (HE,×400)图1 各组小鼠肝组织HE染色结果
2.3 免疫组化各组小鼠肝组织中HMGB1蛋白表达变化结果 HMGB1蛋白表达:正常对照组主要为肝细胞胞浆及肝窦内皮细胞胞浆有弱表达,未见核阳性表达。小鼠注射LPS/D-GalN后表达阳性细胞主要为肝细胞,4 h及8 h胞浆表达明显,12,24 h 表达呈强阳性,随着肝细胞坏死的加重,坏死区阳性表达明显增加。甘草酸二铵治疗组各时间点与模型组比较阳性细胞表达减少。经检验,模型8,12,24 h 组和治疗8,12,24 h 组较正常对照组,差异具有显著统计学意义(P<0.05)。甘草酸二铵治疗组8,12 h HMGB1蛋白表达与模型组同一时间点比较,明显受抑制,差异具有统计学意义(P<0.05),见图2、表2。

正常组(SABC,×400) 治疗8 h组(SABC,×400) 模型24 h组(SABC,×400)图2 各组小鼠肝组织中HMGB1表达结果(箭头所示为阳性表达)
2.4 各组小鼠肝组织中HMGB1 mRNA 表达水平 小鼠注射LPS/D-GralN后4 h, 模型组和治疗组小鼠肝组织内HMGB1 mRNA表达开始上调,8 h达到高峰,之后有降低趋势,但维持在较高水平,经检验,模型组4,8,12,24 h和治疗组8,12,24 h的 HMGB1 mRNA表达较正常对照组明显增加(P<0.05);治疗组8,12 h HMGB1 mRNA的表达较相应模型组减少,差异有统计学意义(P<0.05),见表2。
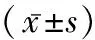
表2 各组小鼠肝组织中HMGB1 mRNA 表达水平
注:与正常组比较,※P<0.05;与治疗组比较,&P<0.05。
3 讨 论
ALF可由包括药物、毒物、病毒感染等多种原因引起,病理生理学上表现为肝细胞大量坏死、凋亡,导致肝脏合成、解毒、转运和生物转化等功能发生严重障碍,继而出现以严重消化道症状、极度乏力、凝血功能障碍、深度黄疸、肝性脑病、腹水等临床症候群[3]。急性肝功能衰竭具有起病急、预后差及病死率高的特点,迄今仍无有效治疗,是肝脏疾病研究的热点之一。
H.Wang[4]等首次报道HMGB1作为新的潜在的晚期炎症介质,参与了脓毒症的发病过程,是内毒素致死效应的晚期重要炎症介质。临床研究[5]发现急性重型胰腺炎病人的血清HMGB1水平可显著增高,且与病情严重程度显著相关。动物实验研究[6]发现高压氧致小鼠肺损伤模型中,气道内HMGB1显著增加,通过抑制HMGB1可减轻病变部位中性粒细胞聚集、水肿以及早期炎性细胞因子产生。在大鼠和小鼠类风湿关节炎模型中,应用HMGB1抗体或抑制剂,可明显减轻关节炎症状[7]。 因此,HMGB1作为一种重要的晚期炎症因子可参与多种疾病炎症反应及器官损害 。
目前在多种实验动物模型中证实甘草酸类制剂的肝脏保护作用[8],临床上广泛应用于慢性乙肝和丙肝的治疗[9]。甘草酸不仅可以抑制HMGB1的释放,还可以结合胞外游离的HMGB1,从而作为 HMGB1的一个抑制剂,减轻由HMGB1 介导的炎症反应。本研究以昆明种小鼠为动物实验模型,以D-氨基半乳糖和脂多糖成功复制了陈恩强等[10]建立的动物急性肝功能衰竭模型。随肝细胞损伤程度加重,免疫组化检测HMGB1在坏死区域内的表达量出现明显的升高。实时定量PCR等方法检测HMGB1在mRNA水平的表达,统计结果显示急性肝衰竭8 h组HMGB1mRNA在肝脏组织中的相对含量达到高峰,之后有降低趋势,但12,24 h组HMGB1在肝脏组织中的相对含量仍维持在较高水平。本研究中ALT、AST及肝脏组织学提示在研究开始的前12 h中,肝细胞以炎性损害为主,部分肝细胞仍有活性及功能,此时肝细胞合成的HMGB1 mRNA以维持HMGB1蛋白表达;但在12 h以后肝组织学也表现出了片状坏死,此时,存活肝细胞的数量锐减,HMGB1 mRNA合成大量减少,但坏死区域内的HMGB1蛋白仍可持续作用于炎症反应过程。而甘草酸二铵治疗组小鼠肝组织内HMGB1 mRNA和蛋白表达水平在相同时间点均较相对应治模型低,说明甘草酸二铵治疗组小鼠HMGB1在基因和蛋白水平均受到了不同程度的抑制,同时HE染色发现,肝脏炎症坏死的程度较模型组明显减轻,小鼠的一般临床状况有好转。而且血清ALT、AST及TBIL水平下降,说明肝功能好转,肝细胞坏死减少。
甘草酸二胺在肝衰竭过程中通过结合游离的 HMGB1和抑制 HMGB1的释放,进而抑制HMGBl表达减轻了急性肝衰竭过程中肝脏进行性损伤。
[1] Takano K, Shinoda M, Tanabe M, et al. Protective effect of high-mobility group box 1 blockade on acute liver failure in rats[J]. J Shock,2010,34(6):573-579.
[2] Girard,Jean-Philippe.A Direct Inhibitor of HMGB1 cytokine[J].Chem Biol,2007,14(4):345.
[3] Whitehouse T,Wendon J.Acute liver failure[J].Best Pract Res Clin Gastroenterol,2013,27(5):757-769.
[4] Wang H, Bloom O, Zhang M, et al.HMG-1 as a late mediator of endotoxin lethality in mice[J].Science,1999, 285(5425):248-251.
[5] Szabolcs P,Hofner T,Takács G,et al.Plasma Concentrations of high-mobility group box protein 1, soluble receptor for advanced glycation end-Products and Circulating DNA in Patients with acute pancreatitis[J].Pancreatology, 2009,9(4) : 383-391.
[6] Entezari M,Javdan M,Antoine DJ,et al.Inhibition of extracellular HMGB1 attenuates hyperoxia-induced inflammatory acute lung injury[J].Redox Biol,2014 (2):314-322
[7] Luis Ulloa,Franak M,Batliwalla UA,et al.High mobility group box chromosomal protein 1 as a nuclear protein, cytokine, and potential therapeutic target in arthritis[J].Arthritis and Rheumatism, 2003,48(4) :876-881.
[8] Ikeda T,Abe K,KlJroda N,et a1.The inhibition of apoptosis by glycyrrhizin in hepatic injury induced by injection of lipopolysaccharide/D-galactosamine in mice[J].Arch Histol Cytol,2008,71(3):163-178.
[9] Iino S, Tango T,Matsushima T, et al.Therapeutic effects of stronger neominophagenC at different doses on chronic hepatitis and liver cirrhosis[J].Hepatol Res,2001,19(1):31-40.
[10] 陈恩强,王丽春,唐红,等.脂多糖联合D-氨基半乳糖诱导急性重症肝炎小鼠模型的建立[J].华西医学,2009, 24(1):129-131.
Expression influence of transcription factor HMGB1 in the process of acute liver failure induced by Glycyrmizinate acid diamine to mice
ZhangLiulu,LuoXinhua,WeiMing.
GuizhouProvincialPeople'sHospital,Guiyang550002,China.
Objective To observe the expression influence of transcription factor HBGB1 in the process of acute liver failure induced by D-GalnandLPS, and explore the possible role of transcription factor HMGB1 in the pathogenesis of mice acute hepatic failure. Methods Total of 72 male mice was randomly divided into normal control group, acute liver failure model group, and glycyrmizinate acid diamine therapy group. Each group except the normal group was injected with D-GalN 500mg/kg and LPS 10μg/kg intraperitoneally, and after one hour, the diammonium glycyrmizinate group was fed with the glycyrrhizic acid diamine 70 mg/kg and other two groups were fed with normal saline (NS). Liver tissue was taken and detected by using HE staining method to check liver tissue pathological changes after 4 h, 8 h, 12 h, 24 h. The expression of HMGB1 protein in hepatic tissue was detected by immunohistochemistry and the expression of HMGB1 mRNA was determined by real time-PCR. Results Immunohistochemistry results was shown that model group and therapy group mice liver tissue HMGB1 protein expression at 8 h, 12 h, and 24 h were higher than normal control group, and there were statistical significance differences (P<0.01), and the model group of HMGB1 protein expression at 8 h and 12 h was higher than therapy group (P<0.05). Real time PCR results was shown that model and therapy groups's HMGB1mRNA expression at 8 h,12 h, and 24 h were higher than normal control group (P<0.05), and the model group's HMGB1mRNA expression at 8 h, 12 h was higher than the therapy group (P<0.05). Conclusion HMGB1 in the mice with acute liver failure model may play in a key role. Glycyrrhizic acid diamine can inhibit HMGB1of the liver cell to protect liver.
Acute liver failure; HMGB1; RAGE; Glycyrmizinate
R-332,R575.3
A
1000-744X(2016)05-0456-04
2015-09-27)
△通信作者,E-mail:luoxh09@163.com

