丝状蓝藻长孢藻属的中国一新记录种
——蒙氏长孢藻
熊志鹏宋高飞李守淳李仁辉
(1. 江西师范大学生命科学学院, 南昌 330022; 2. 中国科学院水生生物研究所, 武汉 430072)
丝状蓝藻长孢藻属的中国一新记录种
——蒙氏长孢藻
熊志鹏1宋高飞2李守淳1李仁辉2
(1. 江西师范大学生命科学学院, 南昌 330022; 2. 中国科学院水生生物研究所, 武汉 430072)
近期在湖北省陆水水库进行野外调查时发现了在中国尚未报道的蒙氏长孢藻Dolichospermum mendotae (Trelease) Wacklin, et al. 2009。文章详尽地描述了该种的特征, 并对其16S rRNA基因测序分析表明, 与日本、西班牙、捷克等地区所得到的该种的序列相似度很高, 显示出来自不同地区的蒙氏长孢藻在分子系统进化树上聚为一支。最后通过毒素分子检测和生物试验显示分离于陆水水库的三株蒙氏长孢藻不产神经毒素。
蒙氏长孢藻; 水华蓝藻; 新记录; 鱼腥藻; 中国
淡水水体富营养化和蓝藻水华的暴发是当今全球的一大环境问题和生态灾难。随着研究程度和方法的深入, 水华蓝藻的多样性也不断地被显示出来。目前浮游性的鱼腥藻(Anabaena)包含了大约80个淡水形态种, 代表了一个宽泛的、多样化的蓝藻类群[6]。2009年Wacklin等通过16S rRNA基因序列的差异, 把大部分浮游性的原鱼腥藻种类成立成长孢藻属(Dolichospermum)[7]。所以, 同其他水华蓝藻类群相似, 长孢藻属的一些种类能够产生具生物活性的肝毒素和神经毒素, 甚至异味物质, 对水生动物和人类健康表现出潜在的危害[3,4]。因此, 对长孢藻的形态多样性、系统分类、生物学特性以及产毒性开展研究是非常必要的[5]。但是长孢藻的名称在国内对并没有得到较广泛的使用, 如杨丽等[1]曾报道了8个浮游种类, 李守淳等[2]报道了2个新记录浮游种类, 但当时仍归类在鱼腥藻属中。2011年胡鸿钧[8]而对浮游类鱼腥藻的名称进行了整理, 收录了15个长孢藻种类。
最近在对湖北省赤壁市陆水水库进行蓝藻水华的调查时, 发现了一种在形态上类似于蒙氏长孢藻(Dolichospermum mendotae)的丝状蓝藻。通过对野外水体样品中该形态藻丝的分离培养, 获得了该种类的单种培养藻3株。然后通过对野外样品和培养藻株的形态观察和比较, 并进一步利用DNA序列分析, 确认该藻株为蒙氏长孢藻, 是一种尚未在中国报道过的新记录种。
1 材料与方法
1.1 样品的采集
采集地点位于湖北省赤壁市陆水水库, 坐标为E113°53′21″、N29°41′46″, 用25号筛绢制作的浮游生物网采集水体中的藻类样本。
1.2 藻种分离
使用经典的毛细管分离法: 将灭菌后的巴氏吸管制作成毛细管(Psateur Micropipette)于Nikon解剖镜(Nikon SMZ 1500)下挑取单根藻丝, 然后转移到含有2 mL CT培养基的24孔无菌培养板中, 放入光照培养箱中培养。培养条件: 温度(25±1)℃, 光照强度为25 μE/(m2·s), 光照周期为12h∶12h (L∶D)。一般4—6周就可得到纯培养藻株, 然后转接到含有5 mL CT培养基的玻璃试管中保存。本研究使用的藻株的编号为CHAB3512和CHAB4408、CHAB4412,采集时间分别为2011年4月和2012年6月, 该藻种保存于中国科学院水生生物研究所有害藻类学科组藻种库。
1.3 形态观察
藻丝形态的观察使用Nikon Eclipse 80i型光学显微镜, 外接数码相机(DS-Ri1)与台式计算机。数码拍照和数据测量则通过图像分析软件NIS-Elements D 3.2实行。选取50个以上的藻体对各项数据进行测量统计。
1.4 DNA提取、PCR扩增和分子系统的分析
首先对培养藻株离心富集, 然后参照xanthogenate-SDS(XS)DNA抽提方法提取藻株基因组DNA[9], 将DNA保存于-20℃备用。PCR反应体系为50 μL, 包含200 mmol/L dNTP; 1.5 mmol/L MgCl2; 1×buffer PCR缓冲液; 1 μmol/L引物; 1 U Taq DNA聚合酶。藻株的16S rDNA序列扩增, 鱼腥藻毒素和贝类毒素序列扩增所用引物见表 1。根据鱼腥藻毒素和贝类毒素合成基因的特异性, 以及现有的参考文献, 本研究选择鱼腥藻毒素合成基因anaF和贝类毒素合成基因sxtA相关的PCR扩增特异性引物作为藻株的鱼腥藻毒素和贝类毒素合成基因的检测引物。PCR扩增产物用1%的琼脂糖凝胶电泳检测, 目的片段通过胶回收试剂盒回收(Bio-Flux), 克隆到pMD18-T载体(TaKaRa, Japan)上, 然后将克隆载体转入感受态细胞E. coli DH5α中, 菌液送往北京华大基因科技有限公司进行测序。
获得的序列通过NCBI的Blast进行比对, 并将获得的序列和从GenBank数据库中下载的基因序列用MAFFT进行多重序列比对[10], 然后进行序列保守区选择(http://www.phylogeny.fr/version2_ cgi/one_task.cgi?task_type=gblocks), 利用PAUP软件对序列饱和度检测, 在未饱和的情况下用 Mr-ModelTest选择模型(HKY+I+G), 应用PhyML version 3.5c构建最大似然树(ML)[11]。用MEGA4构建邻接树(NJ), 参数如下: Kimura 2参数模型, 100次重复随机加入序列, 用Bootstrap (1000 replicates)来检验各节点支持率[12]。应用Mrbayes 3.1.2软件对序列数据进行贝叶斯分析(Bayes)[13], 以随机树起始, 运行5000000代(Generations), 每100代取样并保存一次。在舍弃老化样本(Burn-in samples)后, 根据剩余的样本构建严格合意树, 各分支的支持度使用贝叶斯后验概率表示。ML、NJ及Bayes三个系统树都以Microcystis aeruginosa为外类群。
1.5 小鼠生物试验
试验藻处理: 取培养至对数生长期的藻液, 浓度大约为105—106cells/mL, 采用5000 r/min离心10min收集藻细胞, 并用蒸馏水清洗沉淀2—3次。将收集到的藻泥等量分成两份, 一份用于冷冻干燥测藻细胞干重, 一份用于后续试验。将试验藻泥用一定体积的生理盐水(0.9% Nacl盐溶液)稀释成浓度梯度藻液, 浓度梯度设置为1 (540 mg/kg)、0.50 (300 mg/kg)、0.25 (140 mg/kg), 超声破碎5min, 液氮/25℃水浴反复冻融3次, 用于破碎藻细胞, 得到的藻细胞破碎液直接用作实验材料。
试验小鼠: 试验小白鼠购自湖北省疾病预防与控制中心的实验动物中心, 清洁级(SPF), 昆明品系(KM), 雄性, 体重18—22 g。健康实验小鼠随机分组, 每组设3个重复, 分别取不同藻株的浓度梯度细胞注射液进行腹腔注射, 每只小鼠注射量为1 mL。腹腔注射1 mL生理盐水作为空白对照。记录小鼠中毒和死亡情况。
2 结果
2.1 蒙氏长孢藻Dolichospermum mendotae (Trelease) Wacklin, et al. 2009的形态特征
藻丝自由漂浮, 不规则缠绕。藻丝等极, 沿藻丝方向细胞呈柱状, 藻丝末端不变细, 无胶质外鞘。营养细胞具气囊, 圆柱形并且具圆形末端, 淡蓝绿色, 细胞宽3.19—4.82 μm, 长为1.59—9.63 μm,长宽比为1.21—2.72 μm。异形胞单个间生, 椭圆形, 相对营养细胞稍宽, 宽4.24—6.25 μm, 长5.23—7.62 μm。孢子单个间生, 远离异形胞, 长圆柱形具圆形末端, 有时呈轻微的弓形, 直径3.84—7.04 μm, 长为14.85—44.71 μm。蒙氏长孢藻的具体形态见图 1。
表 2列出了目前世界上所报道的关于蒙氏长孢藻的各指标具体信息情况。
蒙氏长孢藻一般浮游于较大的寡营养到轻微富营养的水库、湖泊, 不常见, 有时形成轻微的水华。而陆水水库在营养水平上正好属于贫营养向中营养的过度阶段(TN: 0.97—1.21 mg/L, TP: 0.02—0.05 mg/L)。

表 1 引物序列列表Tab. 1 Primers used in this study

图 1 蒙氏长孢藻(字母A代表孢子, 字母H代表异形胞)Fig. 1 Dolichospermum mendotae (Trelease) Wacklin et al. 2009 (Letter ‘A' represents akinete, letter ‘H' as heterocyte)
2.2 分子系统分析
利用上述引物扩增16S rRNA基因, CHAB3512、CHAB4408和CHAB4412三株藻分别获得了1404、1406和1405 bp的序列, GenBank编号分别为KJ482666、KJ482667、KJ482668。与GenBank藻株序列比对处理后, 截取了最大可使用的1030 bp构建系统发育树(图 2)。陆水水库的三株蒙氏长孢藻与来自日本、西班牙、捷克等地区的蒙氏长胞藻(JN886024、FM242084、AB551482、FN691918)相似度均超过99%, 并很好的聚到一起。
2.3 毒素基因和生物毒性测试的检测结果
本研究选择鱼腥藻毒素合成基因anaF和贝类毒素合成基因sxtA相关的PCR扩增, 但这3株蒙氏长孢藻均未发现产鱼腥藻毒素和贝类毒素合成基因(图 3)。
利用小鼠进行了进一步的毒性实验。小鼠生物测试急性实验24h内, 阴性对照组可自如爬行、进食和饮水, 无不适症状, 未有小鼠死亡现象发生。以产神经毒素saxitoxin的拟柱胞藻藻株Cylidrospermopsis raciborskii T3作为阳性对照, 其细胞处理液经小鼠腹腔注射后, 出现肌肉颤动、呼吸沉重、流涎、剧烈跳跃等典型的神经毒素中毒症状,并且毒素效应发生特别快, 注射后即发生毒素反应,且反应剧烈, 小鼠的存活时间在1—3min。而较高浓度的蒙氏长孢藻藻株的细胞注射液经腹腔注射后, 小鼠初期(10min)出现精神不振, 活动不适, 25min后恢复正常, 小鼠无死亡现象。
3 讨论
鱼腥藻属(Anabaena Bory)由Bory于1822年创建, 以Anabaena oscillarioides为模式种, 既包括无气囊、底栖种类, 也包括了具气囊、浮游的类群, 隶属于蓝藻门(Cyanophyta), 念珠藻目(Nostocales), 念珠藻科(Nostocaceae), 鱼腥藻亚科(Anabaenoideae)。然而以模式种A. oscillarioides为代表的底栖种类, 与具气囊、浮游的鱼腥藻类群在形态上, 生长习性和基因分子序列上都具有明显的差异。由于模式种A. oscillarioides是底栖种类, 因此底栖种类就保留在原来的鱼腥藻属中, 而将具气囊、浮游的鱼腥藻类群中的一部分单独划分为一个新的属——长孢藻属Dolichospermum Ralfs 1850[7,17], 并以Dolichospermum flos-aquae (原来的Anabaena flos-aquae)作为其模式种。2009年Wacklin等[7]建立长胞藻属的时候重新把原来鱼腥藻的42个种类划到了长孢藻属内。在我国, 杨丽等[1]曾报道了10个浮游种类的鱼腥藻, 这10个种类根据新的蓝藻分类系统, 应该相应的改为归属于长孢藻属内[1,2]。关于蒙氏长孢藻的特点, 它区别于其他长孢藻的主要特征是藻丝卷曲缠绕, 营养细胞为柱形, 异形胞和孢子不相邻。相似的种类就是模式种水华长孢藻,但是后者的细胞是球形。表 2列出了目前报道的关于蒙氏长孢藻的各指标具体信息, 本种与Li等[18]在日本的北海道发现的藻株相比营养细胞和异形胞的直径偏小, 而孢子的直径却偏大; 与Cronberg和Annadotter[19]所描述的蒙氏长孢藻相比其异形胞稍小, 而与Komárek[20]所描述的欧洲种在形态大小上没有明显差异。该种与D. sigmoideum (Nygaard) Wacklin, et al. 2009形态较为相似, 区别在于蒙氏长孢藻藻丝缠绕稍松, 藻丝较长, 经常形成的不规则缠绕群体状态, 而D. sigmoideum藻丝缠绕较紧密,藻丝易断裂成小片段。

表 2 不同研究中蒙氏长孢藻形态参数信息Tab. 2 Morphological characteristics of Dolichospermum mendotae in different studies
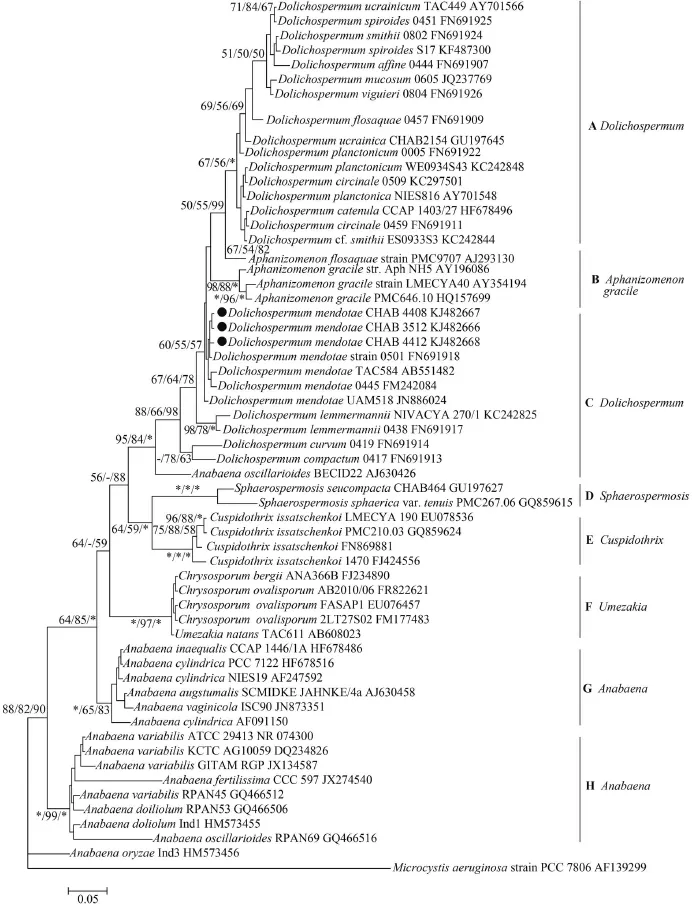
图 2 基于16S rRNA基因序列构建的NJ/ML/Bayes分子系统树Fig. 2 Maximum likelihood (ML) phylogenetic tree of cyanobacteria based on 16S rRNA Sequences (1030 bp) using the current GenBank data on cyanobacteria. Bootstrap values greater than 50% with distance/parsimony methods were indicated at the nodes with the form of NJ/ML/Bayers. Sequences from GenBank were indicated by accession numbers. The main clades were indicated by numbers. Sequences from this study were denoted with solid cycle
基于16S rRNA基因序列构建的分子系统树分析显示(图 2), 长孢藻属类群(Clade A and C)与底栖附着的鱼腥藻类群(Clade G and H)形成明显的不同分支, 同时也再次证明了长孢藻属与其他的具异形胞的浮游类群, 如束丝藻(Clade B), 矛丝藻(Clade E)及Umezakia(Clade F)具有较近的亲缘关系[4,14,21—23]。本研究所得的蒙氏长孢藻藻种的16S rRNA基因序列归到长孢藻属Clade C分支, 并且与其他研究中的蒙氏长孢藻序列聚到同一个支中, 与日本(AB551482)、西班牙(JN886024)、捷克(FN691918, FM242084)等地区所得到的序列相似度很高, 在基因水平上没有明显的差异。

图 3 蒙氏长胞藻anaF和sxtA基因PCR扩增电泳图Fig. 3 Electrophoresis results from anaF and sxtA gene of Dolichospermum mendotae
从这个16S rRNA基因系列的系统树上可以看出, 长孢藻属分布于位于系统发育树的两个不同的位置, 而长孢藻属的模式种水华长孢藻位于系统树的A分支, 而蒙氏长孢藻位于C分支。这主要的原因还是因为束丝藻属的水华束丝藻和柔细束丝藻和长孢藻的种类混合在一个大类群中, 这2个属的混合问题已经长期存在。
蒙氏长孢藻被认为具产神经毒素的能力, 比如,在芬兰南部的两个湖Sääskjärvi和Säyhteenjärvi的水华中分离的D. mendotae均产神经毒素[24]。来自于加拿大湖泊的藻株NRC-44-1和NRC-525-17也能够产神经毒素, 虽然这两株藻一直被认为是水华长孢藻, 而Wantanabe则认为实际上应为蒙氏长孢藻[25],但由于缺少序列等更多信息, 暂时无法进一步确认这些结论。在本研究中, 通过鱼腥藻毒素和贝类毒素的特异性引物对3株来自我国陆水水库的蒙氏长孢藻进行初步检测, 表明这些藻株并没有鱼腥藻毒素和贝类毒素的产毒基因。通过小鼠生物实验也再次验证了本研究中的蒙氏长孢藻都不产生神经毒素。未发现蒙氏长孢藻中国藻株的产毒特性, 可能是由于藻株过少, 或者区域性的局限。因此, 将来的研究需要分离到更大范围和跟多的藻种, 深入地研究此类长胞藻的各种生物特性和产毒能力检测。
[1]Yang L, Yu G L, Li R H. Eight newly recorded species of Anabaena Bory (Nostocaceae, Cyanophyta) from China [J]. Acta Hydrobiologica Sinica, 2009, 33(5): 917—923 [杨丽, 虞功亮, 李仁辉. 中国鱼腥藻属的八个新记录种.水生生物学报, 2009, 33(5): 917—923]
[2]Li S C, Chai W B, Zheng H P, et al. Two newly recorded speices of Anabaena (Nostocales, Cyanobacteria) in China [J]. Journal of Lake Science, 2012, 24(5): 797—800 [李守淳, 柴文波, 郑洪萍, 等. 中国鱼腥藻属的两个新记录种. 湖泊科学, 2012, 24(5): 797—800]
[3]Rapala J, Sivonen K. Assessment of environmental conditions that favor hepatotoxic and neurotoxic Anabaena spp. strains cultured under light limitation at different temperatures [J]. Microbial Ecology, 1998, 36(2): 181—192
[4]Lyra C, Suomalainen S, Gugger M, et al. Molecular characterization of planktic cyanobacteria of Anabaena, Aphanizomenon, Microcystis and Planktothrix genera [J]. International Journal of Systematic and Evolutionary Microbiology, 2001, 51(2): 513—526
[5]Zapomĕlová E, Řeháková K, Jezberová J, et al. Polyphasic characterization of eight planktonic Anabaena strains (Cyanobacteria) with reference to the variability of 61 Anabaena populations observed in the field [J]. Hydrobiologia, 2010, 639(1): 99—113
[6]Komárek J. Klĺč kurčovánĺ vodnĺch kvĕtů sinicvč eské republice. A key for determination of water-bloom-forming cyanobacteria in the Czech Republic. In: Maršálek B, Keršner V, Marvan P (Eds.), Vodnĺ kvĕty sinic [Cyanobacterial Water Blooms] [M]. Nadatio flos-aquae, Brno. 1996, 22—85
[7]Wacklin P, Hoddmann L, Komárek J. Nomenclatural validation of the genetically revised cyanobacterial genus Dolichospermum (Ralfs ex Bornet et Flahault) comb. nova [J]. Fottea, 2009, 9(1): 59—64
[8]Hu H J. The Biology of Water-blooms Blue-green Algae [M]. Science Press. 2011, 66—75 [胡鸿钧. 水华蓝藻生物学. 北京: 科学出版社. 2011, 66—75]
[9]Tillett D, Neilam A. Xanthogenate nucleic acid isolation from cultured and environment cyanobacteria [J]. Journal of Phycology, 2000, 36(1): 251—258
[10]Katoh K, Misawa K, Kuma K, et al. MAFFT: a novel method for rapid multiple sequence alignment based on fast Fourier transform [J]. Nucleic Acids Research, 2002, 30(14): 3059—3066
[11]Guindon St, Phane, Gascuel O. A simple, fast, and accu-rate algorithm to estimate large phylogenies by maximum likelihood [J]. Systematic Biology, 2003, 52(5): 696—704
[12]Tamura K, Dudley J, Nei M, et al. MEGA4: Molecular evolutionary genetics analysis (MEGA) software version 4.0 [J]. Molecular Biology and Evolution, 2007, 24(8): 1596—1599
[13]Huelsenbeck J P, Ronquist F. MRBAYES: Bayesian inference of phylogenetic trees [J]. Bioinformatics Applications Note, 2001, 17(8): 754—755
[14]Gugger M, Lyra C, Henriksen P, et al. Phylogenetic comparison of the cyanobacterial genera Anabaena and Aphanizomenon [J]. International Journal of Systematic and Evolutionary Microbiology, 2002, 52(5): 1—14
[15]Andreas Ballot, Jutta Fastner Claudia Wiedner. Paralytic shellfish poisoning toxin-producing Cyanobacterium Aphanizomenon gracile in Northeast Germany [J]. Applied and Environment Microbiology, 2010, 76(4): 1173—1180
[16]Andreas Ballot, Jutta Fastner, Marén Lentz, et al. First report of anatoxin-a-producing cyanobacterium Aphanizomenon issatschenkoi in northeastern Germany [J]. Toxicon, 2010, 56(6): 964—971
[17]Komárek J, Mares J. An update to modern taxonomy (2011) of freshwater planktic heterocytous cyanobacteria [J]. Hydrobiologia, 2012, 698(1): 327—351
[18]Li R H, Watanabe M, Watanabe M M. Taxonomic studies of planktic species of Anabaena based on morphological characteristics in cultured strains [J]. Hydrobiologia, 2000, 438(1): 117—138
[19]Gertrud Cronberg, Heléne Annadotter. Manual on Aquatic Cyanobacteria-A photo Guide and a Synopsis of their Toxicology [M]. Intergovernmental Oceanographic Commission, UNESCO. 2006, 35—36
[20]Komárek J. Cyanoprokaryota 3. Teil/Part 3: Heterocytous Genera [M]. Springer-Verlag Berlin Heidelberg. 2013, 605—652
[21]Rajaniemi P, Hrouzek P, Kaštovská K, et al. Phylogenetic and morphological evaluation of the genera Anabaena, Aphanizomenon, Trichormus and Nostoc (Nostocales, Cyanobacteria) [J]. International Journal of Systematic and Evolutionary Microbiology, 2005, 55(1): 11—26
[22]Rajaniemi P, Komárek J, Hrouzek P, et al. Taxonomic consequences from the combined molecular and phenotype evaluation of selected Anabaena and Aphanizomeno strains [J]. Algological Studies, 2005, 117(1): 371—391
[23]Willame R, Boutte C, GruBisic S, et al. Morphological and molecular characterisation of planktonic cyanobacteria from Belgium and Luxembourg [J]. Journal of Phycology, 2006, 42(6): 1312—1332
[24]Jarkko Rapala, Kaarina Sivonen, Raija Luukkainen, et al. Anatoxin-a concentration in Anabaena and Aphanizomenon under different environmental conditions and comparison of growth by toxic and non-toxic Anabaena-strainsa laboratory study [J]. Journal of Applied Phycology, 1993, 5(6): 581—591
[25]Watanabe M. Studies on planktonic blue-green algae 6. Bloom-forming species in Lake Biwa (Japan) in the summer of 1994 [J]. Bulletin National Science Museum, Series B, 1996, 22: 1—10
A NEWLY RECORDED SPECIES OF FILAMENTOUS CYANOBACTERIUM ——DOLICHOSPERMUM MENDOTA IN CHINA
XIONG Zhi-Peng1, SONG Gao-Fei2, LI Shou-Chun1and LI Ren-Hui2
(1. School of Sciences in Jiangxi Normal University, Nanchang 330022, China; 2. Key Laboratory of Algal Biology, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China)
As a large group of water bloom forming cyanobacteria, Dolichospermum genus has been attracted more attention and its taxonomic status and biological characteristics were significantly improved. The present study performed a detailed description of a newly found Dolichospermum mendotae (Trelease) Wacklin, et al. 2009 from Lushui Reservoir, Hubei, China. Molecular phylogenetic analysis based on the 16S rRNA gene sequences showed that the Dolichospermum mendotae strain was very similar to the strains isolated from Japan, Spain and Czech. Cyanotoxin detection including neutoxin gene test and bioassay demonstrated that the Dolichospermum mendotae strain examined in this study was not neurotoxin producer.
Dolichospermum mendotae; Bloom forming cyanobacteria; New record; Anabaena; China
Q949.2
A
1000-3207(2017)01-0238-06
10.7541/2017.30
2016-01-04;
2016-05-17
国家自然科学基金(31470310)资助 [Supported by the National Natural Science Foundation of China (31470310)]
熊志鹏(1990—), 男, 江西高安人; 硕士; 主要从事藻类生物学研究。E-mail: 718957085@qq.com
李仁辉(1965—), 研究员; 主要从事蓝藻分类系统以及藻类环境生物学研究。E-mail: reli@ihb.ac.cn

