不同酿酒酵母对啤酒酿造过程中反-2-壬烯醛的影响
王艳丹,蔡 勇,吕慧威*
(1.吉林师范大学博达学院,吉林四平136000;2.长春职业技术学院食品生物技术分院,吉林长春130033)
不同酿酒酵母对啤酒酿造过程中反-2-壬烯醛的影响
王艳丹1,蔡 勇2,吕慧威1*
(1.吉林师范大学博达学院,吉林四平136000;2.长春职业技术学院食品生物技术分院,吉林长春130033)
从不同生产用酵母菌泥中分离筛选出3株工业酿酒酵母,编号分别为A、B、C、D。以酿酒酵母C为对照,利用顶空固相微萃取结合气质联用(HS-SPME-GC/MS)法,研究不同酵母在啤酒酿造过程中反-2-壬烯醛(T2N)含量的变化。结果表明,不同发酵液中T2N含量差异显著(P<0.05),A、B、C、D酵母菌发酵液中T2N含量分别为13.63 μg/L、9.12 μg/L、10.93 μg/L、7.63 μg/L。4株菌的成品酒中T2N含量均较发酵液高,监测D菌啤酒酿造过程中T2N含量变化结果显示:冷麦汁中T2N含量最高为25.93 μg/L,发酵过程中T2N含量相对最低为6.96 μg/L,冷贮和成品阶段T2N含量有所增加,分别达到9.27 μg/L和11.36 μg/L,但与冷麦汁相比低很多。
酿酒酵母;顶空固相微萃取;气相色谱-质谱联用法;啤酒酿造;反-2-壬烯醛
啤酒在生产、贮存和运输过程中,由于环境因素影响,风味会逐渐发生变化,产生令人不愉快的异杂味,俗称“老化味”,使啤酒的饮用性大大降低,同时也缩短了啤酒的货架期。目前,普遍认为引起啤酒风味变化的主要物质是羰基化合物[1-2],其中反-2-壬烯醛(trans-2-nonenal,T2N)是典型代表,它是由于麦芽脂质降解而形成的一种具有纸板味的老化物质[3-4],可作为原料新鲜度的指示剂。由于啤酒老化过程的复杂性[5],解决啤酒生产和贮藏过程中的老化问题,一直是一个严峻的课题。
啤酒是麦汁经酿酒酵母发酵而成的,其风味主要由酵母在麦汁中代谢产生的总体代谢产物决定。有研究表明,酿酒酵母发酵过程中会产生具有抗老化能力的还原性物质,如亚硫酸盐、还原酮和还原型谷胱甘肽等[6],这类物质可以和许多氧自由基发生反应,对维持胞内氧化还原环境具有一定作用,能够显著延长啤酒的风味保鲜期。以往对啤酒老化程度的研究主要集中于老化物质检测方法的开发和对成品啤酒贮存过程的研究[7-8],对酿造过程老化物质变化的研究报道较少,尹花等[9]跟踪了啤酒发酵过程中多种老化指示物质的变化情况,但没有考虑不同酿酒酵母间的差异。因此,要从根本上解决啤酒老化问题,还需要从酵母菌种本身的选择出发,选择抗氧化能力较强的啤酒酵母工业菌株。
本研究以T2N含量为评价指标,采用顶空固相微萃取(headspace solid-phase microextraction,HPLC)气质联用(gas chromatography-mass spectrometry,GC-MS)法检测不同酵母酿造啤酒中冷麦汁、发酵液及成品酒中T2N的含量,探索四株不同工业酿酒酵母对啤酒酿造过程中麦汁老化程度的影响。此外,通过监测啤酒厂酿造过程中T2N含量的变化,可以及时调整原料的使用情况以及控制原料的贮存条件,并且可实现生产工艺的过程控制,从而定向进行啤酒新鲜度的改善,持续提高产品的竞争力。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
酿酒酵母C:本实验室保藏;酵母A、B、D:从不同啤酒厂的酵母菌泥中筛选分离得到;生产用酵母菌泥:来自不同啤酒厂;麦芽汁:四平市某啤酒厂。
1.1.2 主要试剂
反-2-壬烯醛标准品(色谱纯):美国Sigma公司;琼脂、无水乙醇(色谱纯)、NaCl、葡萄糖、果糖、蔗糖、乳糖、半乳糖、可溶性淀粉、麦芽糖、甘油、鼠李糖、(NH4)2SO4、NH4NO3、尿素(均为分析纯):天津市滨海科迪化学试剂有限公司。
1.1.3 培养基
麦芽汁培养基:11°P麦芽汁,121℃湿热灭菌18 min,固体培养基加0.15%琼脂,pH值约5.8。
碳源同化测试培养基:(NH4)2SO45.0g/L,KH2PO41.0g/L,NaCl 0.1 g/L,MgSO4·7H2O 0.5 g/L,CaCl20.1 g/L,酵母膏0.2 g/L,琼脂15.0 g/L,pH值6.5,121℃灭菌18 min。加待测碳源(葡萄糖、果糖、蔗糖、乳糖、半乳糖、可溶性淀粉、麦芽糖、甘油、鼠李糖溶液)2%。调节pH值为6.0。
氮源同化测试培养基:葡萄糖20.0g/L,K2HPO41.0g/L,MgSO4·7H2O 0.5 g/L,琼脂15.0 g/L,121℃灭菌20 min。加待测氮源((NH4)2SO4、NH4NO3、尿素溶液)0.5%。调节pH值为6.0。
发酵糖测试培养基:蛋白胨5.0 g/L、NaCl 5.0 g/L,1.6%溴甲酚紫乙醇溶液2.0 mL/L,分装于试管,放入Durham小管,121℃灭菌20 min。含量为20%的葡萄糖、果糖、蔗糖、乳糖、半乳糖溶液112℃灭菌30 min。灭菌后,每管中加入20%无菌糖液0.5 mL。调节pH值为6.0。
1.2 仪器与设备
303-0S恒温培养箱:深圳市鼎鑫宜实验设备有限公司;LIOO JS-500双目生物显微镜:上海光学仪器厂;HS-1300洁净工作台:成都一科仪器设备有限公司;75 μm CAR-PDMS萃取头的SPME装置:德国SIGMA-Aldrich公司;Clarus600 GC/MS气相色谱-质谱联用仪:美国PE公司;UGC-12MF氮吹仪:北京优晟联合科技有限公司;FE20型pH计:瑞士Mettler Toledo集团公司;UV-1800型紫外可见分光光度计:日本岛津公司。
1.3 方法
1.3.1 菌株的筛选
对不同啤酒厂获得的发酵状况较好酵母菌泥进行菌株初筛,初筛前先进行活化复壮,至供试培养液菌体密度为1×108个/mL,将处理后的酵母液稀释至10-6,吸取10-6稀释度的酵母稀释液0.5 mL注入麦芽汁琼脂培养基中,涂匀均匀,于28℃培养72~96 h,监测菌落生长情况[10]。
观察固体培养基上形成菌落的形态,根据大小、颜色、边缘等特征进行初筛[10],结合细胞显微形态筛选出3株菌,分别接种于麦芽汁斜面培养基,28℃培养48~72 h备用。
1.3.2 生理生化实验
(1)碳源同化测试[11]:取斜面培养基活化的新鲜菌体一环,悬浮于1 mL无菌水中,取0.5 mL滴到碳源同化管中。28℃静置培养2周,每天观察并记录结果。取一张白纸,画一条宽度为3/4 mm的黑线,摇动同化管,使菌体充分悬浮,将白纸贴近同化,透过菌悬浮液观察黑线,若黑线清晰可见,表明此菌不能同化该碳源,结果记录为“-”,如果黑线模糊或者完全看不见,表明可以同化该碳源记录为“+”。
(2)氮源同化测试:方法用碳源同化,以被测试的氮源代替碳源。
(3)发酵糖测试:菌悬液制备、接种及培养方式同碳源同化测试,28℃培养48 h,观察各试管内颜色变化(溴甲酚紫)及Durham小管内有无气泡产生。视气体有无记录实验结果,无气体产生表明不发酵该碳源,记录为“-”,有气体产生的管表明可以发酵该碳源,记录为“+”。
以上每个测试均做3个平行管。
1.3.3 发酵方法
在1 000 mL三角瓶中进行啤酒主发酵小型试验。具体方法如下:将麦汁加水,使糖度达到10°Bx,0.05 MPa灭菌20 min。冷却后摇动充氧,沉淀。将50 mL酵母菌种接入,使最终细胞浓度为1×106CFU/mL。在10℃生化培养箱中发酵,每天观察发酵情况。发酵7 d左右糖度至4.0°Bx时结束(嫩啤酒),此阶段为主发酵。
1.3.4 T2N含量测定样品前处理方法
用移液枪准确移取5 mL麦芽汁和待测样品于22 mL顶空瓶中,加入足量NaCl使其处于饱和状态,并用高纯度氮气将瓶中的空气吹走,然后迅速压盖密封,置于沸水浴中煮沸120min,再于50℃恒温水浴中用75μmCAR/PDMS萃取头萃取90 min,待检测[12-14]。
1.3.5 仪器分析条件
GC条件:色谱柱:HP-5MS毛细管色谱柱(60m×0.32mm ×0.25 μm);载气:氦气(纯度≥99.99%);流速:1 mL/min;升温程序:柱温箱初始温度为60℃,以3℃/min的速度升至100℃,再以10℃/min升至250℃,维持7 min,最后以10℃/min升至290℃,维持5 min;进样口温度:280℃;分流方式:无分流进样。
MS条件:电离方式采用电子电离(electron ionization,EI)源,设置电离电压70 eV,离子源温度250℃,传输线温度250℃;测定模式选择离子监测(selected ion monitoring,SIR),溶剂延迟3 min,全扫描质核比范围29~300m/z[13]。
1.3.6 T2N检测方法
采用SPME-GC/MS方法测定样品中的T2N含量。用保留时间和离子碎片比例定性,用外标法定量,用峰面积计算标准工作液和待测样液中的T2N含量值均应在仪器检测的线性范围内,其质量浓度与响应值有良好的线性关系,相关系数R为0.991~0.998范围内。
1.3.7 统计分析
上述实验均做3个平行,并用SPSS 20.0分析软件对数据进单因素方差分析。
2 结果与分析
2.1 菌株的筛选及形态观察
观察四株菌在固体培养基上菌落的形态特征,结果见表1。并分别进行生理化实验,结果见表2。

表1 筛选菌株的形态特征Table 1 Morphological characteristics of selected strains
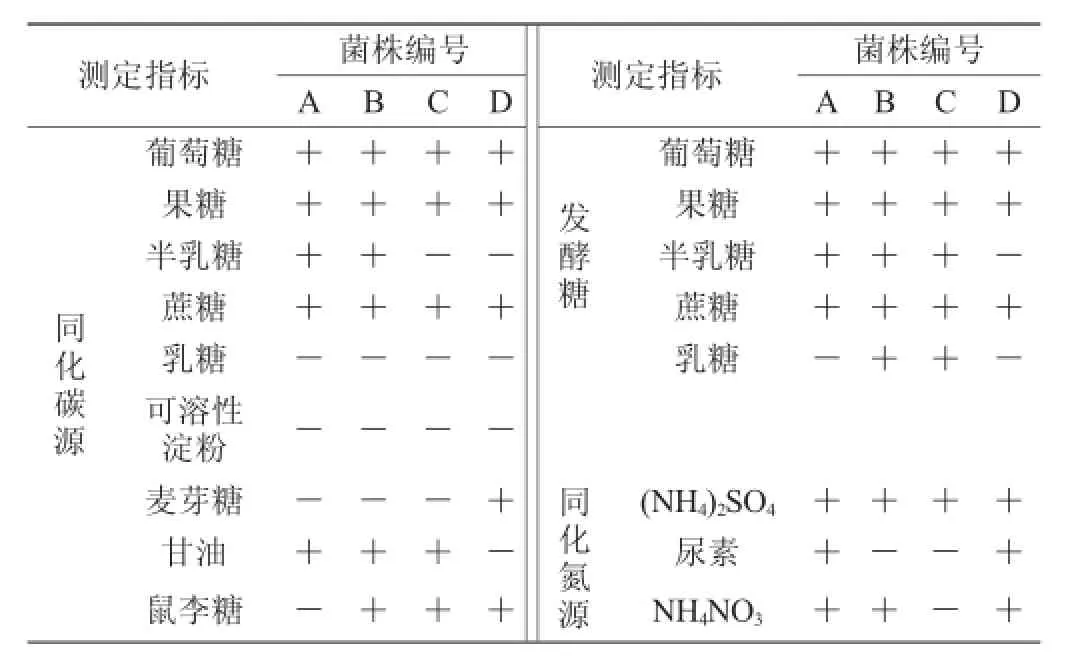
表2 筛选菌株的生理生化特性Table 2 Physiological and biochemical characteristics of selected strains
由表1可知,来自不同啤酒厂的菌泥中分离筛选出三株菌A、B、D与酿酒酵母C形态相似,可作为啤酒发酵实验菌株。由表2可知,在碳源同化测试中,供试菌株均能迅速利用葡萄糖、果糖和蔗糖;均不能利用乳糖和可溶性淀粉,且同化半乳糖、麦芽糖、甘油和鼠李糖的能力存在明显差异。发酵糖测试结果表明:所有菌株均能快速发酵葡萄糖、果糖和蔗糖,Durham小管内充有气体;而在半乳糖和乳糖的发酵能力上存在差异。氮源同化结果表明:四株菌均能很好的利用(NH4)2SO4,在尿素和NH4NO3的利用上存在差异。
2.2 不同的酵母发酵液中T2N含量测定
2.2.1 T2N标准曲线的绘制
本实验所用麦汁经高温煮沸后的反-2-壬烯醛(T2N)含量可达25μg/L,在麦汁中添加T2N标准品0、5μg/L、10μg/L、15 μg/L、20 μg/L、25 μg/L,对样品进行前处理,并用气质联用仪(GC-MS)检测其峰面积,结果扣除空白,绘制出标准曲线,结果见图1。由图1可知,分别以各自的峰面积(y)对T2N标准品质量浓度(x)进行回归计算,得到回归方程:y=7 228.2x+3 069,R2=0.998 4,此方法检出限为0.5 μg/L,该标准曲线可以用作结果的定量分析。
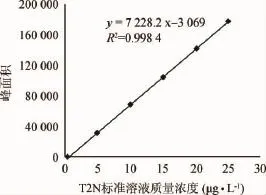
图1 T2N标准曲线Fig.1 Standard curve of T2N
2.2.2 发酵液中T2N含量的测定
监测四株酵母满罐期(0 d)、发酵2 d、4 d、6 d及主发酵结束(8 d)过程中T2N含量的变化,结果见图2。主发酵结束时T2N含量测定结果方差分析结果见表3。
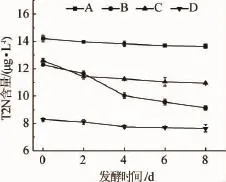
图2 4株酵母菌从满罐到主发酵结束T2N含量变化趋势Fig.2 Changes trend of T2N contents from the full tank to the end of the main fermentation by four different yeast strains
由图2可知,此过程中四株酵母发酵液中T2N含量均呈下降趋势,主发酵结束时酵母D发酵液中T2N含量最低为7.63 μg/L,酵母A发酵液中T2N含量最高达13.63 μg/L,且与冷麦芽汁的25.51 μg/L相比,发酵液中T2N含量均下降,其原因可能是反-2-壬烯醛属于羰基化合物,而酵母对羰基化合物有较强的还原能力,发酵过程中,酵母能将醛类还原为醇类物质,醇类作为中间产物参与到酵母的代谢途径中,使得发酵液中的T2N含量较麦芽汁中降低。由此可知,四株酿酒酵母中,D菌在发酵过程中对醛类物质的还原能力最强,其次是B菌和C菌,A菌还原能力最弱。酵母的种类直接影响了发酵液中的老化物质的含量,选择合适的酿酒酵母对啤酒老化物质T2N含量的控制至关重要。
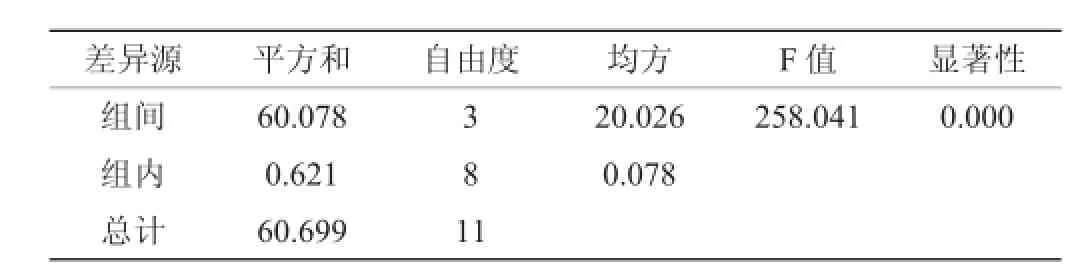
表3 主发酵结束时T2N含量测定结果方差分析Table 3 Variance analysis of determination results of T2N contents at the end of the main fermentation
由表3方差分析可知,不同的酵母在主发酵结束时测定的T2N含量差异显著(P<0.05)。
2.2.3 成品酒中T2N含量的测定
将上述四种主发酵液经后熟、冷贮制成成品酒,测定四株菌对应的成品酒中T2N含量,结果见图3。由图3可知,四株菌成品酒中T2N含量均较发酵液有所上升,其中A菌成品酒中T2N含量最高,为18.30 μg/L,B菌成品酒含14.05 μg/L的T2N,C菌成品酒中含T2N为15.21 μg/L,D菌成品酒中T2N含量最低,为11.19 μg/L,四株菌成品酒中T2N含量差异显著(P<0.05)。由此可见,与酿酒酵母C菌相比,B和D两株菌经发酵得到的成品酒中T2N含量均有所降低,D菌降低的幅度更大,更适宜作啤酒酿造菌株。

图3 4株酵母菌发酵液及成品酒中T2N含量差异Fig.3 Difference of T2N contents in fermentation broth and beer of four yeast strains
2.2.4 啤酒发酵过程中T2N含量的变化趋势
为探究啤酒酿造过程中T2N含量的变化趋势,以D酵母菌为研究对象,跟踪啤酒厂酿造过程,分析冷麦汁、满罐、主酵、后熟、冷贮、成品酒六个阶段T2N的含量变化[9,15-16],结果见图4。由图4可知,麦汁中添加酵母菌D后,在达到满罐时T2N含量由25.93 μg/L大幅下降至7.25 μg/L,其原因是在啤酒发酵初期,酵母具有较强的还原能力,将T2N还原成对应的醇类,并参与到相应的生化循环中[17]。相对于麦汁,在后续的整个发酵过程中,T2N含量均维持在较低的水平,主酵过程与满罐时T2N含量几乎相同,而在后期的后熟、冷贮阶段,T2N含量略有增加,在冷贮至成品阶段T2N有较明显的上升趋势,出现此现象可能是由于酵母菌具有一定的还原能力,当达到一定限度时,过量的T2N不再被还原成醇类物质。此外,在成品的包装、杀菌等高温环境操作过程中,使发酵液中脂氧合酶(lipoxygenase,LOX)酶活性升高,脂质降解造成T2N物质含量上升。因此,在啤酒的后期贮存应尽量控制在较低温度中进行。

图4 麦汁和发酵过程中T2N含量的变化趋势Fig.4 Variation of T2N contents in wort and fermentation broth during fermentation process
3 结论
与麦芽汁相比,四株酵母菌的发酵液中T2N含量均有所下降,且不同发酵液中T2N含量差异显著(P<0.05),其中酵母D发酵液中检测到的T2N含量最低,为7.63 μg/L。结果表明,D酵母菌对醛类物质的还原能力最强,酵母的种类直接影响了发酵液中T2N的含量,为从菌种选择方面提高啤酒品质奠定基础。
四株酵母菌的成品酒中T2N含量均较发酵液中高。对D酵母菌的发酵过程进行监测,可知T2N含量变化趋势:冷麦芽汁中最高,为25.93 μg/L,满罐时达到最低,为7.25 μg/L,随着发酵进行,在主酵、后熟阶段T2N含量略有上升,后期冷贮和成品阶段T2N含量仍有所增加,最终成品酒中含量为11.36 μg/L。掌握T2N含量在啤酒酿造过程中的变化趋势,有助于在不同阶段采取措施控制老化物质的含量。
参考文献:
[1]王红梅,张彦青,樊明涛.固相萃取高效液相色谱法检测啤酒中的反-2-壬烯醛[J].酿酒科技,2008,12(32):106-108.
[2]邵铠,李红,张五九.啤酒大生产中抗氧化能力影响因素的研究[J].中国酿造,2012,31(4):155-157.
[3]陈爽,周芸芸,林智平,等.LOX-less大麦麦芽对麦汁和啤酒风味稳定性的影响[J].啤酒科技,2015(1):63-66.
[4]王涵斌.控制麦芽脂肪酸氧化酶提高啤酒风味稳定性研究[D].乌鲁木齐:新疆农业大学,2014.
[5]徐春.纯生啤酒老化过程与抗氧化活性的研究[J].中国酿造,2008,27(14):57-59.
[6]赵换英.抗老化啤酒酵母菌株的选育[D].天津:天津科技大学,2010.
[7]VANDERHAEGEN B,NEVEN H,VERACHTERT H.The chemistry of beer aging-acritical review[J].Food Chem,2006,95(3):357-381.
[8]江伟,李红,周梅,等.采用GC-MS同时检测啤酒中的醛酯类老化物质[J].食品与发酵工业,2010,36(10):153-158.
[9]尹花,田玉红,郝俊光,等.18种老化指示物质在啤酒发酵过程中的变化研究[J].食品工业科技,2013,34(1):63-66.
[10]刘潇,田瑞华,葳力斯.啤酒酵母分离纯化及性能测定[J].酿酒,2009,36(2):82-83.
[11]凌猛,祖国仁,曹磊.高耐性优良啤酒酵母菌的选育及其高浓发酵后啤酒风味的研究[J].中国酿造,2010,29(10):92-95.
[12]吕慧威,孙玉梅,卢明春,等.自选酵母菌株草莓酒发酵特性比较[J].食品科学,2010,31(11):197-201.
[13]吕慧威,胡雪莲,蔡勇.回旋沉淀时间对啤酒生产中麦汁老化程度的影响[J].中国酿造,2014,33(12):107-111.
[14]张源麟,董建军,郝俊光,等.顶空固相微萃取-气相色谱-质谱法同时检测啤酒酿造大米中16种风味物质含量[J].食品科学,2015,36(22):75-79.
[15]何熙,李红,李惠萍,等.麦汁反-2-壬烯醛检测方法的建立与应用[J].啤酒科技,2015(5):22-25.
[16]赵海锋,陆健,陈坚,等.SPE-HPLC法测定啤酒中的微量反-2-壬烯醛[J].食品工业科技,2008,29(5):270-273.
[17]DEBOURG A,LAURENT M,GOOSSENS E,et al.Wort aldehyde reduction potential in free and immobilized yeast systems[J].J Am Soc Brew Chem,1994,52(3):100-106.
Effect of differentSaccharomyces cerevisiaeon trans-2-nonenal in beer brewing process
WANG Yandan1,CAI Yong2,LV Huiwei1*(1.BODA College,Jilin Normal University,Siping 136000,China;2.School of Food and Biological Technology,Changchun Vocational Institute of Technology,Changchun 130033,China)
Three strains of industrialSaccharomyces cerevisiaewere isolated and screened from different yeast mud used for production,and numbered A,B,C,D.UsingS.cerevisiaeC as the control,the changes of trans-2-nonenal(T2N)contents in beer fermented by different yeasts during brewing process were researched by headspace solid-phase microextraction(HS-SPME)combined with gas chromatography-mass spectrometry (GC-MS).The results showed that the difference of T2N content in different fermentation broth was significant(P<0.05).The T2N contents in the yeast A,B,C,D fermentation broth were 13.63 μg/L,9.12 μg/L,10.93 μg/L and 7.63 μg/L,respectively.T2N contents in the beer fermented by four yeast strains were higher than that in the fermented broth.The T2N contents changes in the yeast D beer brewing process showed that T2N content in cold wort was the highest of 25.93 μg/L,and was relatively lowest of 6.96 μg/L in the fermentation process,then the T2N contents increased in the cold storage and the finished product stage,up to 9.27 μg/L and 11.36 μg/L,respectively,but much lower than that of the cold wort.
Saccharomyces cerevisiae;HS-SPME;GC-MS;beer brewing;trans-2-nonenal
TS262.5
0254-5071(2017)01-0088-05
10.11882/j.issn.0254-5071.2017.01.018
2016-11-10
吉林省教育厅“十二五”科学技术研究项目(2015585)
王艳丹(1988-),女,助教,硕士,研究方向微生物发酵与代谢调控。
*通讯作者:吕慧威(1982-),女,工程师,硕士,研究方向为微生物代谢控制发酵及啤酒酿造工艺。

