黄泥煨制人参中皂苷成分的RRLC-Q-TOF MS分析
戴雨霖,庞 博,阎 琪,乔梦丹,郑 飞,越 皓,刘淑莹
(1.长春中医药大学,吉林 长春 130117;2.吉林大学第一医院,吉林 长春 130023)
黄泥煨制人参中皂苷成分的RRLC-Q-TOF MS分析
戴雨霖1,庞 博2,阎 琪1,乔梦丹1,郑 飞1,越 皓1,刘淑莹1
(1.长春中医药大学,吉林 长春 130117;2.吉林大学第一医院,吉林 长春 130023)
人参作为新资源食品,有多种炮制方法的应用。本研究对于黄泥煨制的人参化学成分是否安全、可靠提供了借鉴。利用高分离度快速液相色谱-四极杆-飞行时间质谱(RRLC-Q-TOF MS)法研究黄泥煨炮制方法的人参化学成分。鲜人参黄泥煨制的样品溶解离心过滤后,采用Agilent ZORBAX SB-C18色谱柱,以0.1%甲酸水-乙腈溶液作为流动相进行梯度洗脱,高分辨质谱进行检测,Masshunter Qualitative Analysis软件与人工相结合进行数据分析。结果表明,本研究鉴定了31种人参皂苷,比较了黄泥煨制人参与其他炮制方法人参中人参皂苷的相对百分含量差异,同时检测到F2、Rg3等稀有人参皂苷。该研究可为人参的使用提供更多的途径,能够为开发人参的多种保健功能提供依据。
黄泥煨制;人参皂苷;液相色谱-质谱
人参是五加科植物人参(PanaxginsengC.A. Mey.)的干燥根,其主要有效成分是人参皂苷[1]。人参皂苷属于三萜类化合物,可分为原人参二醇型皂苷(Protopanaxadiol, PPD)、原人参三醇型皂苷(Protopanaxatriol, PPT)和齐墩果烷型人参皂苷(Oleanolic acid)3类;按照C-20位结构的不同,又可以分为20(S)-和20(R)-型人参皂苷,其中天然人参皂苷均为20(S)-构型。2012年,国家卫生部发布了关于批准人参为新资源食品的公告,因此其有了更多的食用途径和方法。人参主要有红参、生晒参、大力参等炮制品[2-4],古代医书《普济方》中还有用黄泥煨制药材的记载[5],此方法在国内一些地区仍然沿用。有研究表明,人参经过加工炮制后,所含的有效成分会发生复杂的变化,同时伴有新物质生成[6]。黄泥煨制方法中,高温加热且隔绝空气的条件是否影响人参的有效成分和含量至今鲜有报道。
高分离度快速液相色谱-四极杆-飞行时间质谱(RRLC-Q-TOF MS)技术常被用于天然产物的化学成分分析[7-8],如,Wang等[9]利用液相色谱-质谱联用技术检测了人参和西洋参中人参皂苷类化合物的差异。为了比较黄泥煨制方法炮制的人参与其他方法制得的炮制品之间化学成分的差异,本实验用黄泥包裹人参,在高温烘箱中加热后,制得黄泥煨人参样品。采用RRLC-Q-TOF MS联用技术对3种人参炮制品(生晒参、黄泥煨人参及醋制参)的化学成分进行分析,希望为人参的药效学研究提供依据。
1 实验部分
1.1 主要仪器与材料
Agilent 1200型快速分离液相色谱系统,Agilent 6520 Q-TOF 质谱仪:美国Agilent公司产品。
鲜人参、生晒参:5年参,购于吉林省抚松县万良人参市场,经长春中医药大学王淑敏教授鉴定为五加科植物人参PanaxginsengC.A. Mey.的根;人参皂苷Rg2、Rg3、Rb1、Rc、Rd、Re和Rf等对照品(纯度均大于98%):南京泽朗医药科技有限公司产品;乙腈为色谱纯;其他试剂均为分析纯。
1.2 样品的制备
鲜人参按照2015版药典的炮制方法制成生晒参,备用。
黄泥煨炮制方法(mud-covered processed method, MPM):用黄泥完全包裹鲜人参,于80 ℃高压烘箱中加热2.5 h后,冷却至室温,剥去黄泥,备用。
醋制人参炮制方法:用市售食醋浸泡鲜人参48 h后,于100 ℃高压蒸锅蒸制2.5 h,冷却至室温后,置于60 ℃干燥烘箱中干燥72 h,备用。
取1 g炮制后的人参粉末,加入20 mL 70%甲醇,浸泡过夜,超声60 min,以5 000 r/min离心10 min,过0.22 μm滤膜,备用。
1.3 实验条件
1.3.1 色谱条件 Agilent Zorbax SB-C18 色谱柱(2.1 mm×100 mm×3.5 μm);流动相:0.1%甲酸水溶液(A),乙腈(B);梯度洗脱程序:0~2 min(0%~10%B),2~7 min(10%~15%B),7~15 min(15%~30%B),15~21 min(30%~39%B),21~33 min(39%~50%B),33~44 min(50%~68%B),44~50 min(68%~100%B);柱温35 ℃;流速 0.3 mL/min;进样量5 μL。
1.3.2 质谱条件 电喷雾离子源,负离子扫描模式(ESI-);干燥气(N2)流速9 L/min,干燥气温度300 ℃;雾化气压力2.41×105Pa;毛细管电压3.5 kV;碎裂电压175 V;锥孔电压65 V;质量扫描范围m/z100~2 000。实验数据采用Masshunter Qualitative Analysis(B.03.01)软件分析处理。
2 结果与讨论
2.1 线性范围和检出限
选择人参中的主要成分人参皂苷Rg2和Rf作为对照品,按照1.3节条件分析,并计算方法的线性范围和检出限,结果列于表1。以样品的浓度(mg/L)为横坐标,峰面积为纵坐标,绘制标准曲线。结果表明,在0.025~2.5 mg/L浓度范围内,Rg2对照品的相关系数为0.994,线性关系良好;在0.1~10 mg/L浓度范围内,Rf对照品的相关系数为0.995,线性关系良好。以3倍信噪比(S/N=3)计算2种对照品的检出限(LODs),Rg2对照品的检出限为0.001 mg/kg,Rf对照品的检出限为0.001 2 mg/kg。
2.2 不同炮制品化学成分的分析及比较
人参皂苷在ESI-模式下的一级质谱图中,准分子离子主要以[M-H]-和[M+HCOOH-H]-形式存在[10]。通过RRLC-Q-TOF MS技术可获得标准对照品的质谱信息和供试品一级谱中的分子质量信息,然后通过二级串联质谱分析得到碎片信息,并确定苷元类型和所连糖基的种类和数量,从而确定人参皂苷的结构。实验数据采用提取离子流(EIC)方法分析。

表1 对照品人参皂苷Rg2和Rf的线性范围、回归方程、线性相关系数和检出限Table 1 Linear ranges, regression equations, correlation coefficients (r2) and limitsof detection (LODs) of ginsenosides Rg2 and Rf
以丙二酰基人参皂苷mRb1为例说明人参皂苷的鉴定方法。人参皂苷mRb1是二醇型人参皂苷,其C-3位取代基是一分子丙二酰基和两分子葡萄糖形成的侧链,C-20位为两分子葡萄糖连接而成,其二级串联质谱图示于图1。mRb1理论分子质量为1 194.603 3,在一级质谱图中主要以[M-H]-离子形式存在,[M-H]-理论值为1 193.596 1,测得值为1 193.596 7,误差为0.5×10-6。m/z1 193离子脱去丙二酰基(86 u)产生m/z1 107 [M-malonyl-H]-特征碎片离子;脱去丙二酰基和一分子葡萄糖形成m/z945离子;继续脱去一分子葡萄糖残基分别产生m/z783、621、459碎片离子,其中碎片离子m/z459 是二醇型人参皂苷的特征离子。这与文献[4]报道的一致,由此推断该物质为人参皂苷mRb1。用同样的方法可以判定所测得的其他人参皂苷的RRLC-MS/MS数据,结果列于表2。
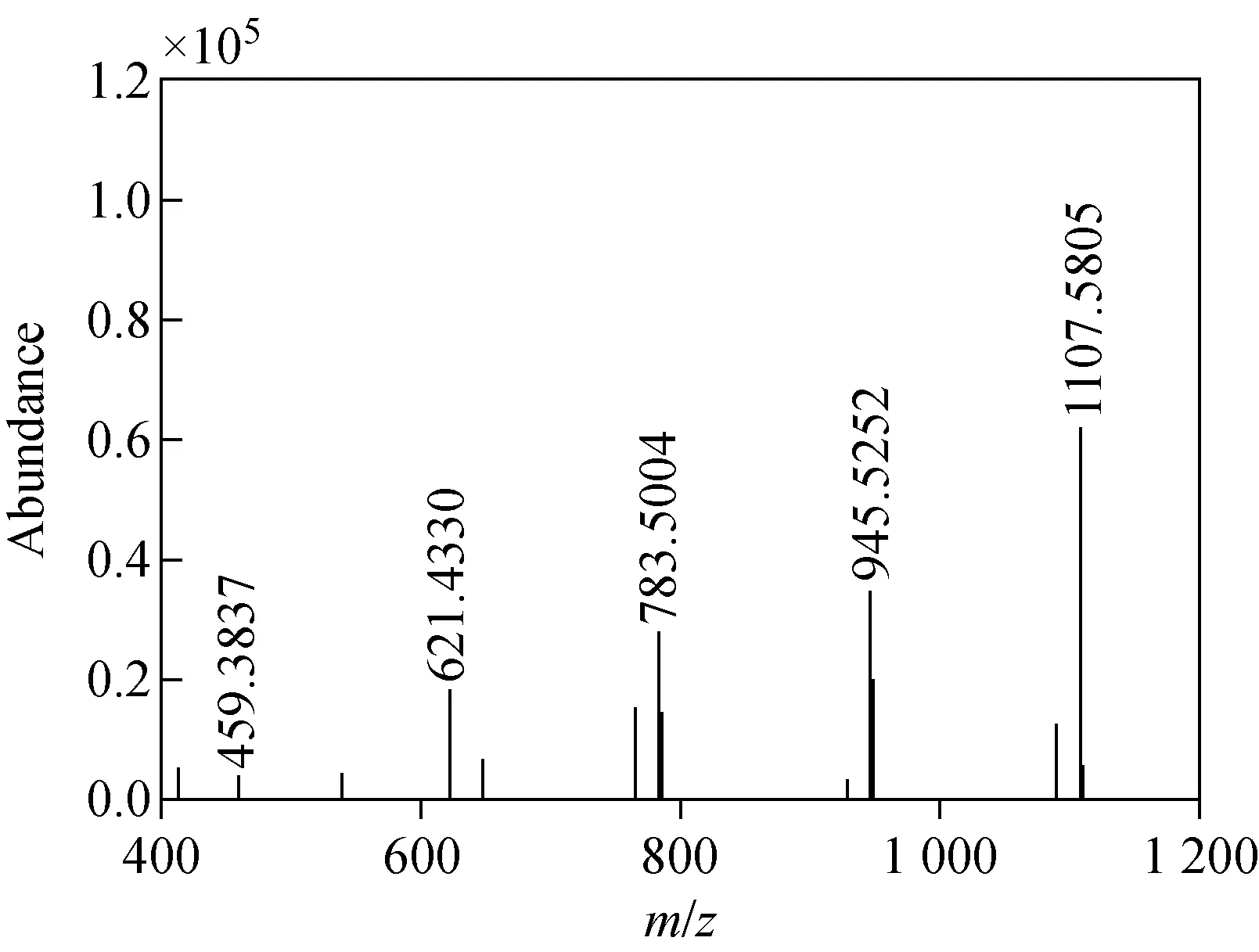
图1 人参皂苷mRb1二级串联质谱图Fig.1 MS/MS spectrum of mRb1 ginsenoside

序号No.化合物Ginsenosides分子式MoleculaformulaWMPM[M-H]-/[M+HCOOH-H]-(m/z)※串联质谱碎片MS/MSfragmention(m/z)1Ra0C60H102O28-+1269.6485/1315.6541107,945,783,621,4592Ra1C58H98O26+++1209.6274/1255.63281107,945,783,621,4593Ra2C58H98O26+++1209.6274/1255.63281107,945,783,621,4594Ra3C59H100O27+++1239.6379/1285.64341107,1077,945,783,621,4595Rb1C54H92O23+++++1107.5957/1153.6011945,783,621,4596Rb2C53H90O22++++1077.5851/1123.5906945,783,621,4597Rb3C53H90O22++++++1077.5851/1123.5906945,783,621,4598RcC53H90O22++++1077.5851/1123.5906945,783,621,4599RdC48H82O18+++945.5428/991.5483783,621,45910Rg3C42H72O13+++783.49/829.4955621,45911Rs1C55H92O23+++1119.5957/1165.60111077,1059,945,783,621,45912Rs2C55H92O23+++1119.5957/1165.60111077,1059,945,783,621,45913Rs3C44H74O14-++825.5006/871.5061783,621,45914mRb1C57H94O26+++1193.5961/—1107,945,783,621,45915mRb2C56H92O25++++1163.5855/—1077,915,783,621,45916mRb3C56H92O25++++1163.5855/—1077,915,783,621,45917mRcC56H92O25++++1163.5855/—1077,915,783,621,45918mRdC51H84O21++++1031.5432/—945,783,765,621,45919F2C42H72O13-+783.49/829.4955621,45920Rg1C42H72O14++++++—/845.4904637,47521RfC42H72O14++++++799.4849/845.4904637,47522Rg2C42H72O13+++783.49/829.4955637,47523ReC48H82O18+++945.5428/—799,783,637,47524NotoR1C47H80O18+++931.5272/977.5327799,637,47525NotoR2C41H70O13+++769.4744/815.4798637,47526mRg1C45H74O17++++885.4853/—781,637,47527mRfC45H74O17++++885.4853/—781,619,47528mReC51H84O21++1031.5432/—945,799,637,4752920-Glc-RfC48H82O19++961.5378/1007.5432799,637,47530F3C41H70O13-+769.4744/—637,47531RoC48H76O19++++955.4908/—793,613,569,453
注:1.W=生晒参;MPM=黄泥煨人参;2.编号1~19为二醇型人参皂苷,编号20~30为三醇型人参皂苷,编号31为齐墩果烷型人参皂苷;3.“-”代表未检测到,“+”代表峰面积为(0~2)×105,“++”代表峰面积为(2~5)×105,“+++” 代表峰面积大于5×105;4.“※”表示质量准确度<10-5
黄泥煨人参和醋制人参中的原人参二醇型人参皂苷转化途径示于图2。由于生晒参在炮制过程中未经高温蒸制,因此其皂苷类成分中存在天然的丙二酰基类人参皂苷;而黄泥煨制过程中会有一部分丙二酰基类人参皂苷经高温水解脱去丙二酰基,生成了相应的人参皂苷,如mRe经水解生成了Re,因此黄泥煨炮制品中类似Re的人参皂苷含量会明显偏高,另外,黄泥煨制人参中还存在一些生晒参中没有检测出的成分。
2.3 炮制品中原人参二醇型人参皂苷转化途径
在人参的炮制品中,原人参二醇型人参皂苷含量相对丰富。与本课题组之前研究的醋制人参[11]中原人参二醇型人参皂苷含量及转化途径相比,醋制人参的炮制效果更“剧烈”,黄泥煨制的炮制效果更“柔和”。两种炮制品皂苷转化均有以下过程:人参皂苷Rb1(1 108)、Rb2(1 078)、Rb3(1 078)、Rc(1 078) 的C-3和C-20位分别连有不同的糖基,如人参皂苷Rb3在RRLC-Q-TOF MS一级谱图中的准分子离子为[M-H]-(m/z1 077.585 1)。在ESI-MS/MS 条件下发生碎裂产生一系列碎片离子,其中m/z945是m/z1 077离子失去C-20位木糖基C5H8O4(132 u)碎片产生的;m/z783是m/z1 077 离子失去C-20位木糖基碎片并且失去一个葡萄糖基C6H10O5碎片产生的;m/z621是m/z1 077离子失去C-20位木糖基碎片且分别失去两个葡萄糖基C12H20O10碎片产生的;m/z459是m/z1 077离子失去C-20位和C-3位所有取代糖基碎片产生的。炮制过程中,人参皂苷Rb1、Rb2、Rb3、Rc会发生C-20位的取代基优先失去,C-3位保持不变,即转化成人参皂苷Rd(946)。继续转化会有两条途径:第一条途径是人参皂苷失去C-3位的葡萄糖基C6H10O5(162 u)和C-20位的一个糖基,产生人参皂苷F2。第二条途径是人参皂苷失去C-20位的糖基并且C-3位的取代基不变,即转化成C-20位R/S构型的Rg3,提取离子流图示于图3。除了以上转化途径,醋制人参还可以沿着第一条途径F2接着失去C-3位或者C-20位的糖基后,分别转化成人参皂苷CK和Rh2(图2)。沿着第二条途径Rg3接着失去C-3位的一个葡萄糖基,转化成人参皂苷Rh2。最后Rg3经过水合作用或者脱水作用分别可以生成人参皂苷CY和人参皂苷Rk1/Rg5。而在黄泥煨制人参样品中,未检测到以上稀有人参皂苷的质谱信号。
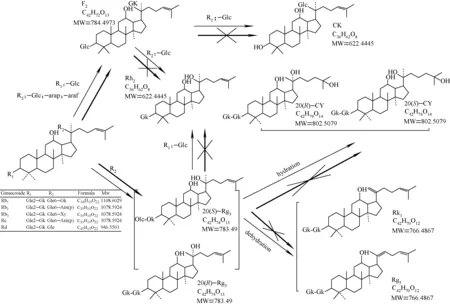
注:细线代表醋制人参转化线路,粗线代表黄泥煨制人参转化线路图2 黄泥煨人参和醋制人参中的原人参二醇型人参皂苷转化途径图Fig.2 Comparation between vinegar and mud-covered processed ginseng in chemical transformation pathway for PPD-type ginsenosides
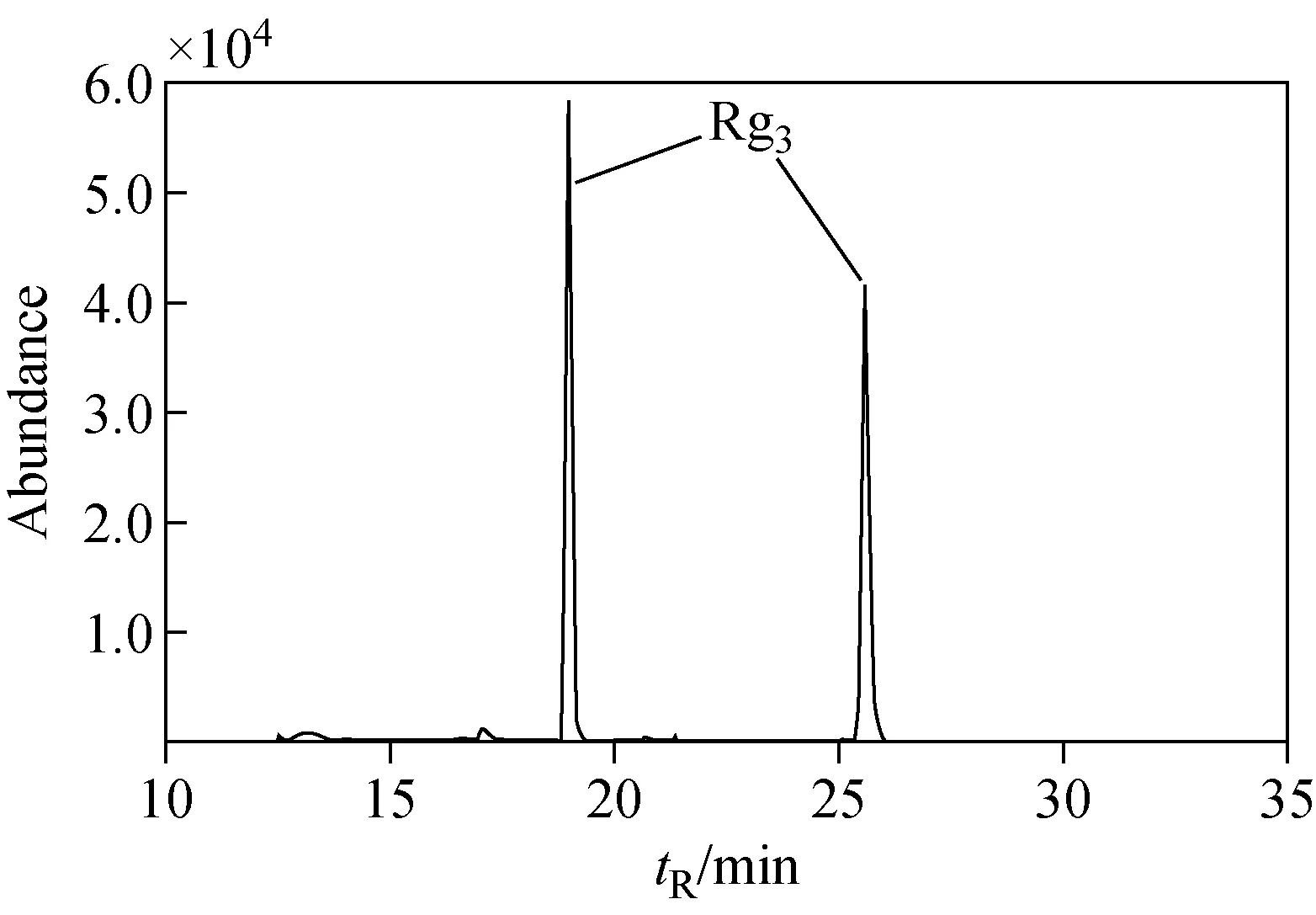
图3 黄泥煨制人参的提取离子流图(m/z 783.490 0)Fig.3 Extract ion chromatography (EIC) of mud-covered processed ginseng at m/z 783.490 0
3 结论
实验通过RRLC-Q-TOF MS联用技术比较了生晒参、黄泥煨人参及醋制人参的皂苷类成分。研究表明,在生晒参中能检测出的人参皂苷在人参的几种炮制品中都能检测出来,黄泥煨制人参有部分人参皂苷能够转化成稀有人参皂苷,如Rg3、F2等。但与其他炮制方法比较,仍有一些皂苷转化不能继续进行,有文献报道[12],加热对中药有效成分的影响较大。黄泥煨制人参较其他人参炮制品更加“柔和”,皂苷含量及种类介于生晒参和醋制人参之间,提示酸碱度可能影响人参皂苷成分的转化。本研究可为今后人参保健食品的多元化开发提供一种选择,同时提出了黄泥煨制人参的药效物质基础。
[1] CHOI K. Botanical characteristics, pharmacological effects and medicinal components of KoreanPanaxginsengC. A. Mey[J]. Acta Pharmacologica Sinica, 2008, 29(9): 1 109-1 118.
[2] 郑重,宋凤瑞,刘淑莹,等. 人参、红参皂苷类成分指纹图谱研究[J]. 质谱学报,2012,33(6):327-333.
ZHENG Zhong, SONG Fengrui, LIU Shuying, et al. Fingerprint Study on ginsenoside in ginseng and red ginseng[J]. Journal of Chinese Mass Spectrometry Society, 2012, 29(6): 327-333(in Chinese).
[3] 李海生,周静远,刘虹. HPLC用于西洋参与生晒参生药及炮制品的鉴定[J]. 中草药,1996(10):624-626.
LI Haisheng, ZHOU Jingyuan, LIU Hong. Identification of sun dried ginseng and American ginseng by HPLC[J]. Chinese Traditional and Herbal Drugs, 1996, 27(10): 624-626(in Chinese).
[4] 郝颖,于珊珊,戴雨霖,等. RRLC-Q-TOF MS/MS法分析生晒参和大力参中的皂苷类成分[J]. 质谱学报,2014,35(4):311-316.
HAO Ying, YU Shanshan, DAI Yulin, et al. Study on ginsenosides in white ginseng and Dali ginseng by RRLC-Q-TOF MS/MS[J]. Journal of Chinese Mass Spectrometry Society, 2014, 35(4): 311-316(in Chinese).
[5] 朱橚. 普济方[M]. 北京:科学技术出版社,1998.
[6] 张淼,秦昆明,李伟东,等. 人参炮制过程中化学成分变化及机制研究[J]. 中国中药杂志,2014,39(19):3 701-3 706.
ZHANG Miao, QIN Kunming, LI Weidong, et al. Research on chemical reactions during ginseng processing[J]. China Journal of Chinese Material Medica, 2014,39(19): 3 701-3 706(in Chinese).
[7] 戴雨霖,于珊珊,张颖,等. 葛花中异黄酮类化学成分的RRLC-Q-TOF MS/MS 研究[J]. 高等学校化学学报,2014,35(7):1 396-1 402.
DAI Yulin, YU Shanshan, ZHANG Ying, et al. Studies on the isoflavone in extract of the flower ofPuerariaLobataby RRLC-Q-TOF MS/MS[J]. Chem J Chinese Universities, 2014, 35(7): 1 396-1 402(in Chinese).
[8] YANG H M, LI Z J, WAN D, et al. Identification of reducing and nonreducing neutral carbohydrates by laser-enhanced in-source decay (LEISD) MALDI MS[J]. Journal of Mass Spectrometry, 2013, 48(5): 539-543.
[9] WANG X, SAKUMA T, ASAFU-ADJAYE E, et al. Determination of ginsenosides in plant extracts from panax ginseng and panax quinquefolius l. by LC-MS/MS[J]. Analytical Chemistry, 1999, 71(8): 1 579-1 584.
[10]李丽,刘春明,吴巍,等. 高效液相色谱-电喷雾质谱联用法测定人参和西洋参的皂苷类成分[J]. 分析化学,2005,33(8):1 087-1 090.
LI Li, LIU Chunming, WU Wei, et al. Analysis of saponins in extract ofPanaxginsengandPanaxquinquofoliumby liquid chromatography-electrospray ionization mass spectrometry[J]. Chinese J Anal Chem, 2005, 33(8): 1 087-1 090(in Chinese).
[11]戴雨霖,越皓,孙长江,等. 高分离度快速液相色谱-四极杆-飞行时间质谱法分析酒制和醋制人参的皂苷类成分[J]. 分析化学,2015,43(8):1 181-1 186.
DAI Yulin, YUE Hao, SUN Changjiang, et al. Determination of ginsenosides in processed ginseng by rapid resolution liquid chromatography coupled with quadrupole time-of-flight tandem mass spectrometry[J]. Chinese J Anal Chem, 2015, 43(8): 1 181-1 186(in Chinese).
[12]曹月梅. 加热炮制法对中药有效成分的影响[J]. 时珍国医国药,2006,17(12):2 539-2 540.
CAO Yuemei. Determination of compounds heating process Chinese herbs[J]. Lishizhen Medicine and Materia Medica Research, 2006, 17(12): 2 539-2 540(in Chinese).
Study on Ginsenosides in Mud-Covered Processed-Ginseng by RRLC-Q-TOF MS/MS
DAI Yu-lin1, PANG Bo2, YAN Qi1, QIAO Meng-dan1, ZHENG Fei1, YUE Hao1, LIU Shu-ying1
(1.ChangchunUniversityofChineseMedicine,Changchun130117,China;2.FirstHospitalofJilinUniversity,Changchun130023,China)
PanaxginsengC. A. Mey (ginseng) is a traditional Chinese medicine herb, which has been widely used for the treatment of enhancing intelligence and improving immunity in China and Aisa. As a new resource food in China, ginseng has a variety of processing methods which are used for different symptoms. The major active components of ginseng are ginsenosides, which demonstrate the ability to target a number of tissues and produce an array of pharmacological responses. In this study, active components from mud-covered processed-ginseng were studied whether the chemical composition of ginseng is safety and reliable. Rapid resolution liquid chromatography coupled with quadrupole-time-of-flight tandem mass spectrometry (RRLC-Q-TOF MS/MS) was used to compare the white ginseng, vinegar processed ginseng and mud-covered processed ginseng for the composition of ginsenosides. Chromatographic conditions were as follows: ZORBAX SB-C18 column (2.1 mm×100 mm×3.5 μm), column temperature of 35 ℃, mobile phase of water-acetonitrile gradient elution, flow rate of 0.3 mL/min, injection volume of 5 μL. Thirty-one ginsenosides were identified by the comparison of the retention times of the standard compounds and the accurate mass obtained from RRLC-Q-TOF MS/MS. A few minor ginsenosides, such as ginsenoside F2and Rg3, were detected by the comparison of white ginseng with processed-ginseng. The method is applicable to the research of compounds in the processed Chinese herbs.
mud-covered processed ; ginsenosides; liquid chromatography-mass spectrometry
2016-06-07;
2016-09-05
国家自然科学基金项目(31400682);吉林省科技发展计划项目(20160101152JC)资助
戴雨霖(1988—),男(汉族),吉林人,研究实习员,从事中药有效成分分析。E-mail: dyltcm@163.com
越 皓(1977—),男(汉族),吉林人,研究员,从事中药化学和色谱质谱研究。E-mail: jlsrskxyjy@126.com
刘淑莹(1943—),女(汉族),黑龙江人,研究员,从事中药化学和有机质谱学研究。E-mail: syliu@ciac.jl.cn
O657.63
A
1004-2997(2017)01-0060-07
10.7538/zpxb.2017.38.01.0060

