高效液相色谱-四极杆-静电场轨道阱高分辨质谱分析桑葚中黄酮类和多酚类物质
马 悦,赵乐凤,吕子燕,孙 乐,吴 巍,刘淑莹,2
(1.长春中医药大学,吉林省人参科学研究院,吉林 长春 130117;2.中国科学院长春应用化学研究所,长春质谱中心,吉林 长春 130022)
高效液相色谱-四极杆-静电场轨道阱高分辨质谱分析桑葚中黄酮类和多酚类物质
马 悦1,赵乐凤1,吕子燕1,孙 乐1,吴 巍1,刘淑莹1,2
(1.长春中医药大学,吉林省人参科学研究院,吉林 长春 130117;2.中国科学院长春应用化学研究所,长春质谱中心,吉林 长春 130022)
为了更好地利用桑葚这一药食同源果品,采用高效液相色谱-四极杆-静电场轨道阱高分辨质谱对桑葚提取物中黄酮类和多酚类成分进行分析研究。采用Syncronis C18 色谱柱(100 mm×2.1 mm,1.7 μm),以乙腈-0.1%甲酸水溶液为流动相,流速0.2 mL/min,梯度洗脱分析。根据高分辨质谱提供的准分子离子峰和碎片离子信息,分析得到化合物的相对分子质量和结构信息。结合化合物的保留时间、对照品和相关文献数据,共鉴定出5种黄酮类成分和3种多酚类成分,分别为芦丁、异槲皮素、山奈酚-7-葡萄糖苷、二氢槲皮素、槲皮素、原儿茶酸、绿原酸和咖啡酸。通过讨论化合物的质谱碎裂规律,为化合物的结构鉴定提供依据。该方法可快速分析桑葚中黄酮类和多酚类成分,为合理开发桑葚的药用、食用价值奠定化学基础。
桑葚;高效液相色谱;四极杆-静电场轨道阱高分辨质谱;黄酮;多酚
桑葚(mulberry)为桑科植物桑MorusalbaL.的干燥果穗[1],味甘酸、性寒,归心、肝、肾经,具有补肝益肾、养血生津之功效[2]。近年来,桑葚作为一种新型果品,其独特的保健作用引起人们的广泛关注[3]。桑葚含有丰富的营养成分,如氨基酸、矿物质、维生素、微量元素、生物碱、多酚类、黄酮类等[4],因此它具有良好的药用价值。《中国药典》中采用85%乙醇提取桑葚,提取物具有滋阴补血、生津润燥的作用,可用于治疗肝肾阴虚、眩晕耳鸣等症状。目前对桑葚的研究大多集中在含量测定、提取分离和药理活性等方面[5],也有研究应用超声技术结合紫外分光光度法提取和定量分析桑葚中总黄酮的含量,其结果为1.508 mg/g[6-7]。游元元等[8]利用HPLC法对不同产地的桑葚药材进行了指纹图谱分析,并研究了药材的品质、加工和贮存;王欣等[9]采用硅胶等柱色谱法分离鉴定了桑葚95%乙醇提取物中的15种化合物;Thabti等[10]利用HPLC-DAD和HPLC-MS法测定了桑叶中总多酚和总黄酮的含量,并且分离鉴定了黄酮和多酚类物质。但从总体上来看,利用液质联用技术分析桑葚中黄酮类有效成分的文献报道较少,而研究桑葚中的黄酮类和多酚类物质组成,对桑葚的药用和食用的质量控制与合理开发具有重要意义。
本实验拟采用高效液相色谱-四极杆-静电场轨道阱高分辨质谱法对桑葚提取物中的黄酮类和多酚类成分进行分析,希望为研究桑葚中的化学物质提供快速、直观、准确的方法。
1 实验部分
1.1 仪器与试剂
Thermo Scientific Q-Exactive 四极杆-静电场轨道阱高分辨质谱系统,Dionex UltiMate 3000快速液相色谱系统:美国 Thermo Fisher公司产品。
芦丁、槲皮素、二氢槲皮素、异槲皮素、原儿茶酸、绿原酸和咖啡酸对照品:南京泽郎医药有限公司产品;乙腈:色谱纯,美国Fisher公司产品;甲酸:纯度为96%,美国Tedia公司产品;实验用水:由Milli-Q超纯水仪制得,电阻率为18 MΩ·cm;其他试剂均为分析纯:北京化工厂产品。
1.2 实验条件
1.2.1 色谱条件 Thermo Syncronis C18色谱柱(100 mm×2.1 mm, 1.7 μm);柱温35 ℃;二元线性梯度洗脱;流动相为0.1%甲酸水溶液(A)和乙腈(B);梯度洗脱程序:0~5 min(5%~35%B),5~30 min(35%~45%B);流速0.2 mL/min;进样量5 μL。
1.2.2 质谱条件 Q-Exactive 四极杆-静电场轨道阱高分辨质谱,ESI 离子源;负离子模式;雾化温度300 ℃;离子传输管温度 350 ℃;扫描模式:Full Scan-ddMS2/Targeted-ddMS2;分辨率70 000 FWHM;质量扫描范围m/z50~750。
1.3 样品制备
精密称取1 g桑葚粉末,用85%乙醇以料液比1∶20混合,于60 ℃浸提1 h,蒸干溶剂,然后用蒸馏水溶解样品,加入等量的石油醚萃取3次,弃去石油醚层。向水层部分加入等量的乙酸乙酯萃取3次,蒸干溶剂,加入80%甲醇溶液定容至10 mL,过0.45 μm微孔滤膜,得样品溶液,备用。
2 结果与讨论
桑葚提取物在负离子模式Full Scan/Full Scan-ddMS2/Targeted-ddMS2下的总离子流图示于图1。实验表明,在负离子模式下,化合物生成[M-H]-准分子离子,8种化合物均可实现很好的分离。Q-Exactive四极杆-静电场轨道阱质谱的高分辨性能可对化合物进行精确的质量数测定,以整数m/z值对化合物进行讨论,精确数值(误差≤5×10-6)列于表1。化合物1~8产生的[M-H]-离子分别为m/z153、353、179、609、463、447、303和301。为进一步分析鉴定这些化合物结构,对8种化合物进行串联质谱分析。
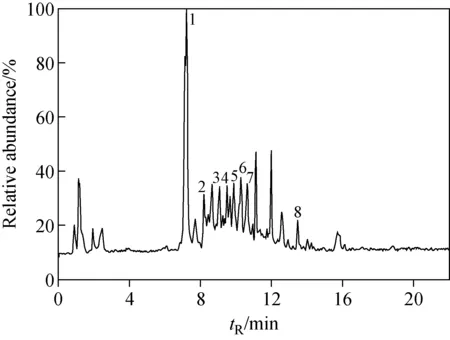
注:1.原儿茶酸;2.绿原酸;3.咖啡酸;4.芦丁;5.异槲皮素;6.山奈酚-7-葡萄糖苷;7.二氢槲皮素;8.槲皮素图1 负离子模式下,桑葚乙醇提取物的总离子流图Fig.1 Total ion chromatogram(TIC) of ethanol extraction from mulberry fruit in negative mode
本实验中黄酮类化合物的质谱碎片离子命名方法如下:对于含有完整黄酮苷元A环和B环的子离子,采用Claeys研究小组的命名方法[11],分别标记为i,jA和i,jB,其中,上标i和j分别表示C环上断裂键位置。对于涉及糖开环解离的子离子,则采用Domon和Costello研究小组的命名方法[12],这些子离子分别标记为k,lYj、k,lZj(糖苷键断裂)和k,lXj(糖开环裂解),其中,上标k和l表示糖开环裂解的断裂键位置。
化合物1~3的色谱保留时间分别为7.08、8.32、9.05 min。在负离子模式下,准分子离子峰[M-H]-为m/z153、353、179。通过Full Scan-ddMS2串联质谱分析,化合物1产生碎片离子m/z109 [M-H-CO2]-,由母离子m/z153失去一个中性碎片CO(28 u)产生,其串联质谱图示于图2a。化合物2产生碎片离子m/z308 [M-H-CO2]-,是由准分子离子[M-H]-m/z353失去一个中性碎片CO2(44 u)产生的。碎片离子m/z191[quinic acid-H]-为奎尼酸;m/z179[caffeic acid-H]-为咖啡酸;m/z173[quinic acid-H-H2O]-为奎尼酸失去一个中性碎片H2O(18 u)得到的碎片离子;m/z161[caffeic acid-H2O-H]-为咖啡酸失去一个中性碎片H2O(18 u)得到的碎片离子;m/z135[caffeic acid-H-CO2]-为咖啡酸失去一个CO2(44 u)中性离子得到的碎片离子,其质谱图示于图2b。化合物3产生的离子m/z135 [M-H-CO2]-是准分子离子[M-H]-失去一个中性碎片CO2(44 u)得到的,其质谱图示于图2c。根据文献报道[13-16],并与标准品对照,依据化合物的保留时间和表1中列出的串联质谱产生的碎片离子及精确质量数,确定化合物1为原儿茶酸,化合物2为绿原酸,化合物3为咖啡酸。

表1 8种化合物的质谱碎裂数据Table1 Mass spectral fragmentation data of 8 compounds
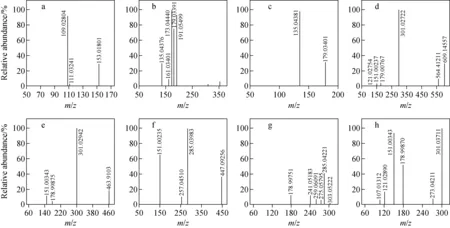
图2 8种化合物的二级串联质谱图Fig.2 MS/MS spectras of 8 compounds
化合物4、5、8的准分子离子峰[M-H]-分别为m/z609、463和301,由此推断化合物4和5的相对分子质量分别为610和464。通过与文献[17]和标准品进行对比,其色谱保留时间与芦丁、异槲皮素和槲皮素一致,分别为9.50、9.88、13.46 min。进一步分析串联质谱所产生的碎片离子和精确质量数,可推断化合物的结构。芦丁准分子离子[M-H]-为m/z609,在Full Scan-ddMS2串联质谱中,m/z564[M-H-CO2]-离子为m/z609失去一个中性碎片CO2(44 u)和一个H生成的离子;m/z301[M-H-Glc-Rha]-为芦丁C7位的糖苷键发生B—Y断裂丢失质量数为308的中性碎片离子生成的苷元[18]。此外,还存在m/z151、179、121三个碎片离子。经分析,m/z151的碎片离子为m/z301离子发生RDA反应生成的;m/z179[M-H-Glc-1,2B-H]-的碎片离子为m/z301在1,2处断裂且转移2个H生成的;m/z1211,2B为m/z301在1,2处断裂产生的离子。综上,可确定化合物4为芦丁,其串联质谱图示于图2d。化合物5在串联质谱中产生的碎片离子m/z301、151、179与异槲皮素一致。其中,m/z301是准分子离子峰 [M-H]-m/z463丢失一分子葡萄糖残基(162 u)产生的苷元离子[M-H-Glc]-;m/z151、179离子是苷元C环开环裂解产生的离子[19]。由此可确定化合物5为异槲皮素,其串联质谱图示于图2e。
在一级全扫描质谱图中,化合物6的准分子离子峰[M-H]-为m/z447,色谱保留时间为10.33 min。通过Full Scan-ddMS2串联质谱分析,Y0离子m/z285为失去一分子六碳糖残基(162 u)碎片产生的离子;m/z257是m/z285丢失中性碎片离子CO(28 u)而产生的[M-H-Glc-CO]-离子,其串联质谱图示于图2f。通过与文献[19]和标准品进行对比,该化合物的串联质谱碎裂规律符合山奈酚-7-葡萄糖苷的结构特点,因此确定化合物6为山奈酚-7-葡萄糖苷。
化合物7的分子离子峰为[M-H]-m/z303,由此可确定化合物7的相对分子质量为304。通过与标准品进行对比,可知二氢槲皮素的准分子离子峰为[M-H]-m/z303。经Full Scan-ddMS2串联质谱分析,m/z285[M-H-H2O]-离子是二氢槲皮素4’,5’的邻羟基失去质量数为18 u(H2O)的中性碎片后产生的离子峰;m/z275[M-H-CO]-为m/z303失去中性碎片CO(28 u)所得的离子峰;m/z259[M-H-CO2]-为m/z303丢失中性碎片CO2(44 u)所得的离子峰;m/z241[M-H-CO2-H2O]-为m/z303丢失中性碎片CO2(44 u)和H2O(18 u)所得的离子峰;m/z1791,4B离子为二氢黄酮母核1,4位开裂所得的离子峰,其质谱图示于图2g。化合物7的色谱保留时间为10.65 min,二氢槲皮素标准品的色谱保留时间为10.67 min,且化合物7 Full Scan-ddMS2串联裂解产生的碎片离子与二氢槲皮素标准品Targeted-ddMS2串联产生的碎片离子相同,因此,可确定化合物7为二氢槲皮素。
分析化合物8的二级质谱图可发现,离子m/z273[M-H-CO]-为分子离子峰m/z301丢失中性碎片CO(28 u)产生的,m/z273继续丢失中性碎片CO产生m/z245离子峰。此外,还存在m/z151、179、121、107四个碎片离子,经分析,碎片离子m/z151为m/z301离子发生RDA反应生成的;m/z151失去中性碎片CO2产生m/z107碎片离子;m/z1791,2A碎片离子为m/z301在1,2处断裂且转移2个H生成的;m/z1211,2B为m/z301在1,2处断裂产生的离子[21]。因此可确定化合物8为槲皮素,其串联质谱图示于图2h。
由表1可见,几种化合物在二级串联质谱中表现出一些特征中性碎片的丢失,如丢失葡萄糖基(162 u),CO(28 u)、CO2(44 u)和H2O(18 u)等,这些特征碎片可为鉴定桑葚中黄酮类和多酚类化合物提供重要信息。
3 结论
采用高效液相色谱-四极杆静电场轨道阱高分辨质谱法对桑葚中黄酮类和多酚类成分进行分析,通过与对照品的保留时间进行对比,并对一级全扫描质谱中分子离子峰信息和串联质谱中碎片离子及中性碎片丢失情况进行分析,推测出8种化合物的结构信息,并快速分析鉴定了桑葚中黄酮类和多酚类化合物。该方法可为研究桑葚的化学物质提供快速、直观、准确的方法。
[1] 国家药典委员会. 中华人民共和国药典(一部)[M]. 北京:中国医药科技出版社,2010,281.
[2] 李银,滕永慧,陈艺红,等. 桑椹的化学成分[J]. 沈阳药科大学学报,2003,20(6):422-424.
LI Yin, TENG Yonghui, CHEN Yihong, et al. Mulberry chemical composition[J]. Journal of Shenyang Pharmaceutical University, 2003, 20(6): 422-424(in Chinese).
[3] SEZAI E, EMINE O. Chemical composition of white (Morusalba), red (Morusrubra) and black (Morusnigra) mulberry fruits[J]. Food Chemistry, 2006, 103 (2 007): 1 380-1 384.
[4] 张文娜,姚清国,俞龙泉,等. 桑葚化学成分及药理作用研究进展[J]. 安徽农业科学,2011,39(14):8 371-8 373,8 375.
ZHANG Wenna, YAO Qingguo, YU Longquan, et al. Research progress of chemical ingredients and pharmacological activities of mulberry[J]. Journal of Anhui Agricultural Sciences, 2011, 39 (14): 8 371-8 373, 8 375(in Chinese).
[5] 操红缨. 桑葚研究进展[J].时针国医国药,1999,10(8):626-628.
CAO Hongying. A review on research situation ofFructusMori[J]. Lishizhen Medicine and Materia Medica Research, 1999, 10(8): 626-628(in Chinese).
[6] 韦耀东,孙婷婷,刘海花,等. 超声波提取桑葚总黄酮及鉴别[J]. 时珍国医国药,2012,23(11):2 811-2 812.
WEI Yaodong, SUN Tingting, LIU Haihua, et al. The total flavanone of movus aalba extraction and the identification by ultrasonic wave[J]. Lishizheng Medicine and Materia Medica Research, 2012, 23(11): 2 811-2 812(in Chinese).
[7] MARIJA M R, ZORAN P Z, SENKA S V, et al. Free radical scavenging activity and total phenolic and flavonoid contents of mulberry (Morusspp. L., Moraceae) extracts[J].Scientific Paper, 2012, 66(4): 547-522.
[8] 游元元,万德光,杨文宇,等. 桑葚药材HPLC图谱研究[J]. 食品科学,2010,31(2):141-144.
YOU Yuanyuan, WAN Deguang, YANG Wenyu, et al. HPLC profile analysis ofFructusMori[J]. Food Science, 2010, 31(2): 141-144(in Chinese).
[9] 王欣,王洪庆,康洁,等. 桑葚化学成分研究[J]. 药学学报,2014,49(4):504-506.
WANG Xin, WANG Hongqing, KANG Jie, et al. Studies on chemical constituents from fruits ofMorusalbaL[J]. Acta Pharmaceutica Sinica, 2014, 49(4): 504-506(in Chinese).
[10]THABTI I, ELFALLEH W, HANNACHI H, et al. Identification and quantification of phenolic acids and flavonol glycosides inTunisianMorus, species by HPLC-DAD and HPLC-MS[J]. Journal of Functional Foods, 2012, 4(1): 367-374.
[11]LI Q M, CLAEYS M. Characterization and differentiation of diglycosyl flavonoids by positive ion fast atom bombardment and tandem mass spectrometry[J]. Biological Mass Spectrometry, 1994, 23(7): 406-416.
[12]DOMON B, COSTELLO C E. A systematic nomenclature for carbohydrate fragmentations in FAB-MS/MS spectra of glycoconjugates[J]. Glycoconjugate Journal, 1988, 5(4): 397-409.
[13]田晨煦,徐小平,廖丽云,等. 高效液相色谱-串联质谱法分离鉴定绿原酸及其相关杂质[J]. 色谱,2007,25(4):496-500.
TIAN Chenxu, XU Xiaoping, LIAO Liyun, et al. Separation and identificaion of chlorogenic acid and related impurities by high performance liquid chromatography-tandem mass spectrometry[J]. Chinese Journal of Chromatography, 2007, 25(4): 496-500(in Chinese).
[14]袁晓艳,高明哲,王锴,等. 高效液相色谱-质谱法分析菊芋叶中的绿原酸类化合物[J]. 色谱,2008,26(3):335-338.
YUAN Xiaoyan, GAO Mingzhe, WANG Kai, et al. Analysis of chlorogenic acids inHelianthustuberosusLinn leaves using high performance liquid chromatography-mass spectrometry[J]. Chinese Journal of Chromatography, 2008, 26(3): 335-338(in Chinese).
[15]罗奇志,王有志,罗佳波. 绿原酸水解产物的高效液相色谱—电喷雾串联质谱分析[J]. 药物分析杂志,2011,31(7):1 345-1 349.
LUO Qizhi, WANG Youzhi, LUO Jiabo. HPLC-ESS/MS analysis of chlorogenic acid and its hydrolysate[J]. Chinese Journal of Pharmaceutical Analysis, 2011, 31(7): 1 345-1 349(in Chinese).
[16]周红霞,张凤,许蔚,等. 高效液相色谱串联质谱法测定蜂蜜中马来酸和水杨酸[J]. 南京晓庄学院学报,2010,3(3):57-60.
ZHOU Hongxia, ZHANG Feng, XU Wei, et al. Analysis of maleic acid and salicylic acid in honey using high performance liquid chromatography-mass spectrometry[J]. Journal of Nanjing Xiaozhuang University, 2010, 3(3): 57-60(in Chinese).
[18]卢定强,蒋奔,王俊,等. 生物合成咖啡酸苯乙酯体系的液相色谱-串联质谱快速分析[J]. 分析化学研究简报,2010,38(11):1 657-1 660.
LU Dingqiang, JIANG Ben, WANG Jun, et al. Analysis of biosynthesis of caffeic acid phenethyl ester system using high performance liquid chromatography-mass spectrometry[J]. Chinese Journal of Analytical Chemistry, 2010, 38(11): 1 657-1 660(in Chinese).
[19]赵安琦,李博,张慧荣,等. 应用电喷雾质谱技术分析鉴定桑叶中黄酮类化合物[J]. 分子科学学报,2014,30(4):293-398.
ZHAO Anqi, LI Bo, ZHANG Huirong, et al. Application of electrospray mass spectrometry technical analysis of flavonoids identified mulberry[J]. Journal of Molecular Science, 2014, 30(4): 293-398(in Chinese).
[20]李宇航,戴海学,汪明明,等. 槲皮素的电喷雾离子阱质谱分析[J]. 质谱学报,2009,30(6):374-378.
LI Yuhang, DAI Haixue, WANG Mingming, et al. Elucidation of quercetin by electronspray ionization mass spectrometry[J]. Journal of Chinese Mass Spectrometry Society, 2009, 30(6): 374-378(in Chinese).
[21]张语迟,刘春明,刘志强,等. 罗布麻叶黄酮类成分酶解前后的液相色谱-质谱分析及活性比较[J]. 分析测试学报,2010,29(10):1 073-1 077.
ZHANG Yuchi, LIU Chunming, LIU Zhiqiang, et al. HPLC-MS analysis and activity evaluation of flavonoids ofApocynumvenetumLeaves before and after hydrolyzed by enzyme[J]. Journal of Instrumental Analysis, 2010, 29(10): 1 073-1 077(in Chinese).
Analysis of Flavonoids and Polyphenols in Mulberry Extracts by High-Performance Liquid Chromatography Quadrupole-Orbitrap Mass Spectrometry
MA Yue1, ZHAO Le-feng1, LV Zi-yan1, SUN Le1, WU Wei1, LIU Shu-ying1,2
(1.JilinGinsengAcademy,ChangchunUniversityofChineseMedicine,Changchun130117,China;2.ChangchunCenterofMassSpectrometry,ChangchunInstituteofAppliedChemistry,ChineseAcademyofSciences,Changchun130022,China)
Mulberry has been widely researched for its unique health care effect. Its 85% ethanol extract is included in the Chinese Pharmacopoeia. A method for analyzing the flavonoids and polyphenols of mulberry extracts was developed by high-performance liquid chromatography quadrupole-Orbitrap mass spectrometry. Most studies of mulberry focused on the content determination, extraction and separation, pharmacological activities, while the analysis of active ingredients in mulberry flavonoids was seldom investigated. Studies have shown that the total content of flavonoids in the mulberry is 1.508 mg/g. The research of flavonoids and polyphenols is of great significance to control the quality of medicinal and edible mulberry as well as to develop the valuable source reasonably. Recently, the HPLC/MS has been proved as an effective method for component analysis in complex extracts system, through which the compounds in mixtures and yield information based on their molecular weights as well as the structures can be rapidly determined. In this study, high-performance liquid chromatography quadrupole-Orbitrap mass spectrometry was adopted for its high speed, high resolution and high sensitivity. It is also effective for compound structure identification online. Analysis of flavonids and polyphenols was performed using H2O-CH3CN containing 0.1% formic acid with 0.2 mL/min flow rate by a Syncronis C18 column (100 mm×2.1 mm, 1.7 μm). Five flavonoids of rutin, isoquercerin, kaempferol-7-glucoside, taxifolin, quercetin and three polyphenols of 3,4-dihydroxyphenylacetic acid, chlorogenic acid, caffeic acid are identified by retention time, accurate molecular weight, tandem mass spectrometry fragmentation information. The retention times of these eight identified compounds are 7.08, 8.32, 9.05, 9.50,9.88, 10.33 and 13.46 min, respectively. In full MS scan, these eight compounds give [M-H]-ion atm/z153, 353, 179, 609, 463, 447, 303 and 301 in negative ion mode. For the further analysis to identify the structures of these compounds, they were subjected for the tandem mass spectrometry. MS fragmentation patterns of compounds were discussed and it provided basis for their structure identification. Loss of glucose residue (162 u), CO (28 u), CO2(44 u) and H2O (18 u) are characteristic losses for the identification of flavonoids in mulberry which offer the important structural information. This method is rapid, simple, accurate, which can provide chemical foundations for exploitation of mulberry in drugs and foods reasonably.
mulberry; high performance liquid chromatography; quadrupole-Orbitrap mass spectrometry; flavonoids; ployphenols
2016-05-09;
2016-09-23
吉林省科技厅人参化学与药理重点实验室探索项目(20160101334JC)资助
马 悦(1992—),女(汉族),内蒙古人,硕士研究生,药物分析专业。E-mail: 302572905@qq.com
吴 巍(1974—),女(汉族),吉林人,研究员,从事中药分析研究。E-mail: weiwu_ccucm@126.com;刘淑莹(1943—),女(汉族),黑龙江人,研究员,从事中药化学和有机质谱学研究。E-mail: syliu@ciac.jl.cn
O657.63
A
1004-2997(2017)01-0045-07
10.7538/zpxb.2017.38.01.0045

