UHPLC-Q-TOF MS和化学计量学方法分析川芎硫磺熏蒸前后化学成分的变化
蔡 皓,乔凤仙,裴 科,段 煜,范恺磊,刘 晓,徐洋洋,汪小琦
(1.南京中医药大学药学院,江苏 南京 210023;2.南京中医药大学国家教育部中药炮制规范化及标准化工程研究中心,江苏 南京 210023;3.山西中医药大学制药与食品工程学院,山西 太原 030024)
UHPLC-Q-TOF MS和化学计量学方法分析川芎硫磺熏蒸前后化学成分的变化
蔡 皓1,2,乔凤仙1,2,裴 科3,段 煜1,2,范恺磊1,2,
刘 晓1,2,徐洋洋1,2,汪小琦1
(1.南京中医药大学药学院,江苏 南京 210023;2.南京中医药大学国家教育部中药炮制规范化及标准化工程研究中心,江苏 南京 210023;3.山西中医药大学制药与食品工程学院,山西 太原 030024)
采用UHPLC-Q-TOF MS结合化学计量学方法分析川芎硫磺熏蒸前后化学成分的变化。选取19批未经硫磺熏蒸川芎饮片、11批实验室自制硫磺熏蒸川芎饮片和9批市售硫磺熏蒸川芎饮片作为实验样品,制备供试品溶液进样后,应用PeakView1.2软件依据一级质谱的精确质荷比和二级质谱的碎片信息进行成分解析,并结合MarkerView1.2.1软件进行主成分分析(PCA)和t检验,鉴定其中的共有成分和差异性成分。结果表明,在PCA分析中,正负离子模式下的未硫熏和硫熏川芎样品均可被明显地区分开,主成分之间存在明显的差异;t检验结果也显示二者之间存在大量的差异性成分,同时鉴定出部分差异性成分,并进一步推测了其可能的转化方式。本实验可为研究硫磺熏蒸对川芎质量的影响提供客观参考,并为控制硫磺熏蒸在中药材和饮片加工过程中的过度应用和确保中医临床用药的安全提供理论依据。
UHPLC-Q-TOF MS;化学计量学;川芎;硫磺熏蒸;t检验;主成分分析(PCA);成分转化;差异性成分
川芎始载于《神农本草经》,为伞形科植物川芎LigusticumchuanxiongHort.的干燥根茎,其性辛、温,归肝、胆和心包经,具有活血行气和祛风止痛的功效[1],临床主要用于治疗气滞血瘀所导致的胸痹心痛、胸胁刺痛、跌扑肿痛、月经不调、经闭痛经、癥瘕腹痛、头痛和风湿痹痛等,是中医处方的常用中药,也是众多中成药的重要原材料[2]。川芎的成分主要包括苯酞类、酚酸类和生物碱类等,其中苯酞类化合物具有明显的舒张血管、改善微循环、抑制血小板聚集、拮抗动脉粥样硬化的形成以及抗实验性脑缺血等方面的药理活性[3-4],这与川芎活血行气和祛风止痛的传统功效密切相关。
硫磺熏蒸是中药材及饮片的传统养护方法之一,可以达到杀菌、防虫和防霉的效果,有利于中药材及饮片的保存。已有研究表明,中药材及饮片经过硫磺熏蒸后,性状多有改变,且由于二氧化硫是一种强还原剂,可能与含有羟基和酮基等基团的成分发生化学反应,导致有效成分含量的变化或化学结构的改变[5-6]。川芎作为药典规定的71种二氧化硫残留量限度为150 mg/kg的中药品种之一,对其硫磺熏蒸前后化学成分变化的分析和鉴定极具代表性和研究价值。
超高效液相色谱与飞行时间质谱联用(ultra-high-performance liquid chromatography-quadrupole-time of flight mass spectrometry, UHPLC-Q-TOF MS)是目前医药科研分析领域中应用较好的定性分析技术,它同时具备高灵敏度和高分辨率的优势,二者的结合不仅可以使不同化学成分能够更好地相互区分,并且能够检测到精确的质荷比数据,获得的信息较传统方法更为丰富,在没有标准品比对的情况下也能获得关于化合物结构的重要提示,因此是目前分析中药复杂系统的最有力工具之一[7-14]。本研究拟采用UHPLC-Q-TOF MS技术,以未硫熏川芎和硫熏川芎为研究对象,应用PeakView1.2软件对其质谱数据进行深入分析,并结合MarkerView1.2.1软件,进一步应用主成分分析(principal component analysis, PCA)和t检验等化学计量学方法,探讨硫磺熏蒸对川芎中化学成分的影响,以期尽可能全面地从化学成分的角度阐明硫磺熏蒸对川芎质量影响的科学内涵,为临床安全用药提供依据。
1 实验部分
1.1 仪器与试剂
超高效液相色谱仪:日本Shimadzu公司产品,配有LC-30AD 二元液相泵,SIL-30SD自动进样器,DGU-20A5R 在线脱气机,CTO-30A柱溫箱;Triple TOF 5600+系统:美国AB Sciex公司产品,配有电喷雾离子源ESI;SPE固相萃取小柱:德国CNW公司产品;AG 285型电子天平:瑞士Mettler Toledo公司产品;Multi Reax全能型振荡器:德国Heidolph公司产品;HH系列数显恒温水浴锅:江苏金坛市金城国胜实验仪器厂产品;KQ-500型超声波清洗器:昆山市超声仪器有限公司产品;R-210型旋转蒸发仪:瑞士Buchi公司产品;TGL-16B型离心机:上海安亭科学仪器厂产品;超纯水制备仪:南京易普易达科技发展有限公司产品;Millipore超纯水器:美国Millipore公司产品。
乙腈,甲醇:均为质谱纯,德国Merck公司产品;甲酸:质谱纯,德国CNW公司产品;实验用水:Millipore超纯水;其余所用试剂均为色谱纯。
1.2 饮片
川芎饮片收集于其道地产区及各大药房,实验前按照2010版《中国药典》一部附录ⅨU“二氧化硫残留量的测定法”项下规定进行检测,其中19批为未硫磺熏蒸饮片,9批为硫磺熏蒸饮片。在19批未硫磺熏蒸饮片中随机取11批饮片,经实验室自熏,作为对照自制硫磺熏蒸饮片,即20~30号硫磺熏蒸饮片依次为9~19号未硫磺熏蒸饮片对应的实验室自制硫磺熏蒸饮片。
自制硫磺熏蒸饮片的具体工艺:取100 g川芎饮片,厚度约为2~4 mm,均匀加入10 mL超纯水,覆盖保鲜膜并于室温下闷润;取10 g硫磺于蒸发皿中,点燃后放于自制硫熏容器的最下层,将闷润好的饮片均匀铺散于不锈钢笼屉上,并将笼屉置于距离硫磺30 cm左右处硫熏容器的中层,紧密盖上盖子,保持密闭24 h后取出饮片,置于40 ℃烘箱中干燥12 h。自制容器的下部侧边均匀留有8个直径约为0.5 cm的小孔,可避免容器内氧气燃尽而自动熄灭。
各批次川芎饮片经北京大学药学院天然药物及仿生药物国家重点实验室屠鹏飞教授鉴定为伞形科植物川芎LigusticumchuanxiongHort.的干燥根茎。川芎饮片的编号、批号及类型列于表1。
1.3 供试品溶液的制备
取川芎饮片,粉碎,过3号筛,精密称定1.25 g,置于圆底烧瓶中,精密加入40倍量的95%乙醇,回流提取2 h,过滤;向残渣中加入40倍量纯水,回流提取2 h,过滤;混合两次提取液并用纯水定容至100 mL,摇匀,以13 000 r/min离心10 min,取上清液,过0.45 μm微孔滤膜。取500 μL续滤液,上样于SPE固相萃取小柱(SPE柱使用前需用3 mL 100%甲醇缓慢活化,然后不断减小甲醇比例冲洗柱子,直至甲醇比例为10%),依次以3 mL 10%甲醇、3 mL 50%甲醇、3.5 mL 100%甲醇为流动相,收集滤液,定容至10 mL;混匀后以13 000 r/min离心10 min,取上清液,过0.22 μm微孔滤膜,取续滤液,即得供试品溶液。
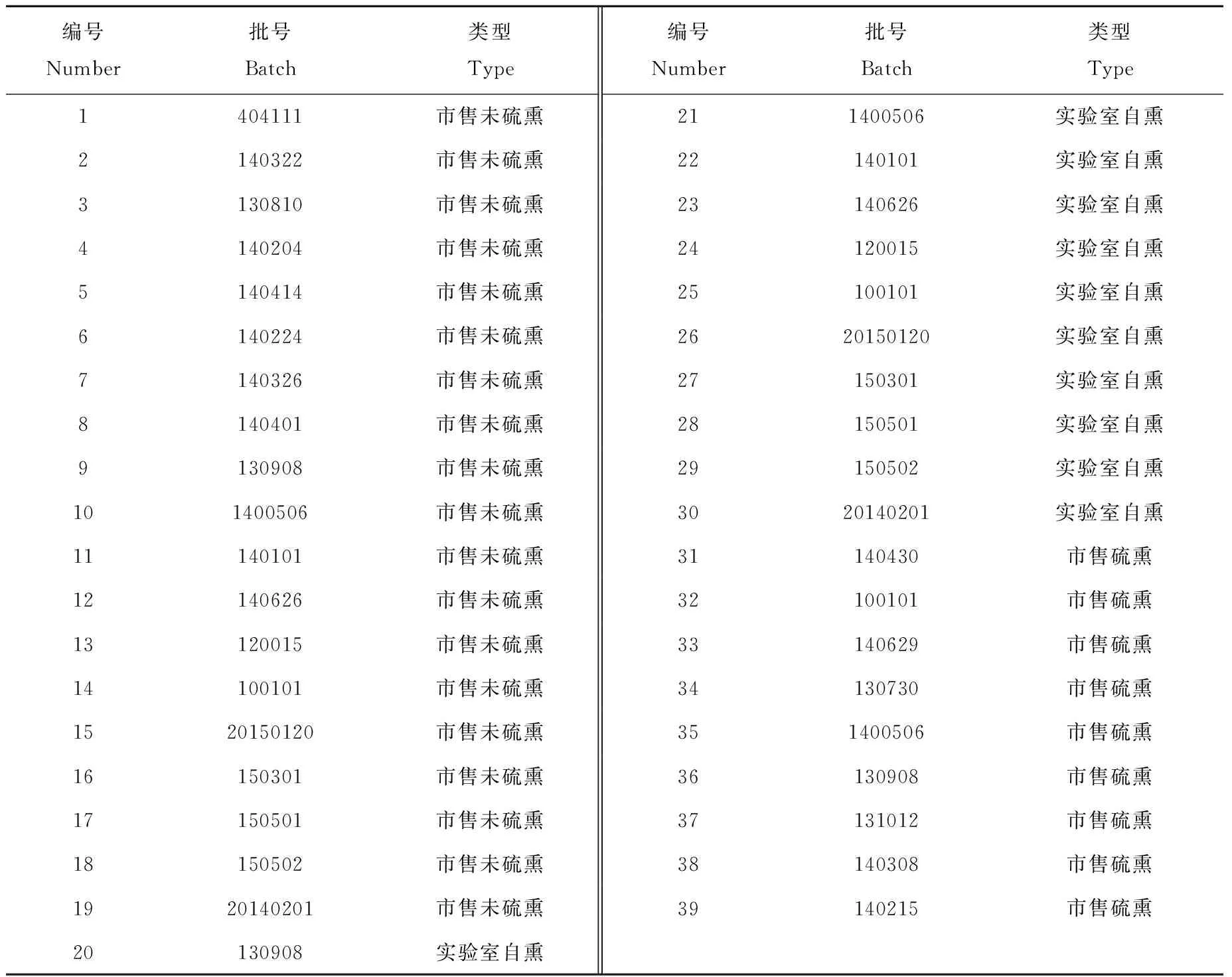
表1 川芎样品的编号、批号及类型Table 1 Number, batch, and type of Chuanxiong Rhizoma Samples
1.4 实验条件
1.4.1 色谱条件 Agilent Eclipse Plus C18色谱柱(100 mm×2.1 mm×3.5 μm),前置Agilent C18预柱;柱温为35 ℃;流速为0.3 mL/min;进样量为3 μL;流动相:A为0.01%甲酸水溶液, B为乙腈;梯度洗脱程序:0.1~12 min(5%B~50%B),12~18 min(50%B),18~28 min(50%B~100%B),28~30 min(100%B)。
1.4.2 质谱条件 TOF MS条件:质量扫描范围m/z100~1 500;离子化电压5 500.00 V/-4 500.00 V;去簇电压60 V/-60 V;补偿电压10 V/-10 V;雾化气压力379 kPa;辅助加热气压力379 kPa;气帘气压力276 kPa;离子化温度500.00 ℃。
Product 条件:质量扫描范围m/z50~1 000,高灵敏度扫描;去簇电压60 V/-60 V;补偿电压20 V/-20 V;离子释放延迟67;离子释放宽度25。质谱配备有自动校正系统,设定每3 h自动校正一次。
1.5 数据分析
1.5.1 数据库的建立 检索伞形科藁本属植物的相关文献,建立包含中药川芎中所含化学成分的分子式、分子质量和化学名称等信息的尽可能全面的数据库,计算其在正离子模式下的常见离子[M+H]+、[M+NH4]+、[2M+H]+和负离子模式下的常见离子[M-H]-、[M+COOH]-、[2M-H]-等多种离子形态的精确质荷比数值。同时借助ChemSpider或Chemical Book等下载各个化合物的.mol文件,或者用ChemBio Draw Ultra 12.0软件画出其结构式并存储为.mol文件。
1.5.2 软件应用及参数的设定 将未硫熏和硫熏川芎样品的原始质谱数据导入PeakView软件中,通过分析比较各个化合物由总离子流图提取到的二级碎片与其.mol文件所对应的碎片之间的匹配度,以及其误差大小,来推断所含有的成分;应用MarkerView 软件对未硫熏和硫熏川芎样品的原始质谱数据进行峰匹配、峰对齐和滤噪处理。主要参数设置如下:最短保留时间2.00 min;最小谱峰宽度25 ppm;最小谱峰宽度扫描次数6 scans;噪声阈值100;保留时间阈值0.50 min;质量阈值10.0 ppm;最大峰数8 000。借助于MarkerView软件对原始质谱数据进行主成分分析和组间t检验分析,得出其PCA得分图和载荷图以及p值的分布图。
2 结果与讨论
2.1 典型的总离子流图
未硫熏和硫熏川芎样品在正离子和负离子模式下的UHPLC-Q-TOF MS总离子流图示于图1、图2。结合两图可以看出,未硫熏和硫熏川芎样品在正负离子模式下均存在一定的差异(如正离子模式下的16~17 min处和负离子模式下的6 min处),但并不明显。由于中药成分的复杂性,很多成分难以在30 min内完全分离,特别是许多具有差异性的成分很可能隐藏和包埋在同一个色谱峰的下面,所以单纯依靠总离子流图中的色谱峰寻找未硫熏和硫熏川芎样品的差异性成分是不充分和不完全的。因此,本实验结合多元数据分析(PCA)以及t检验的方法,提取更多的差异性成分,并对其结构转化的机理进行推导。
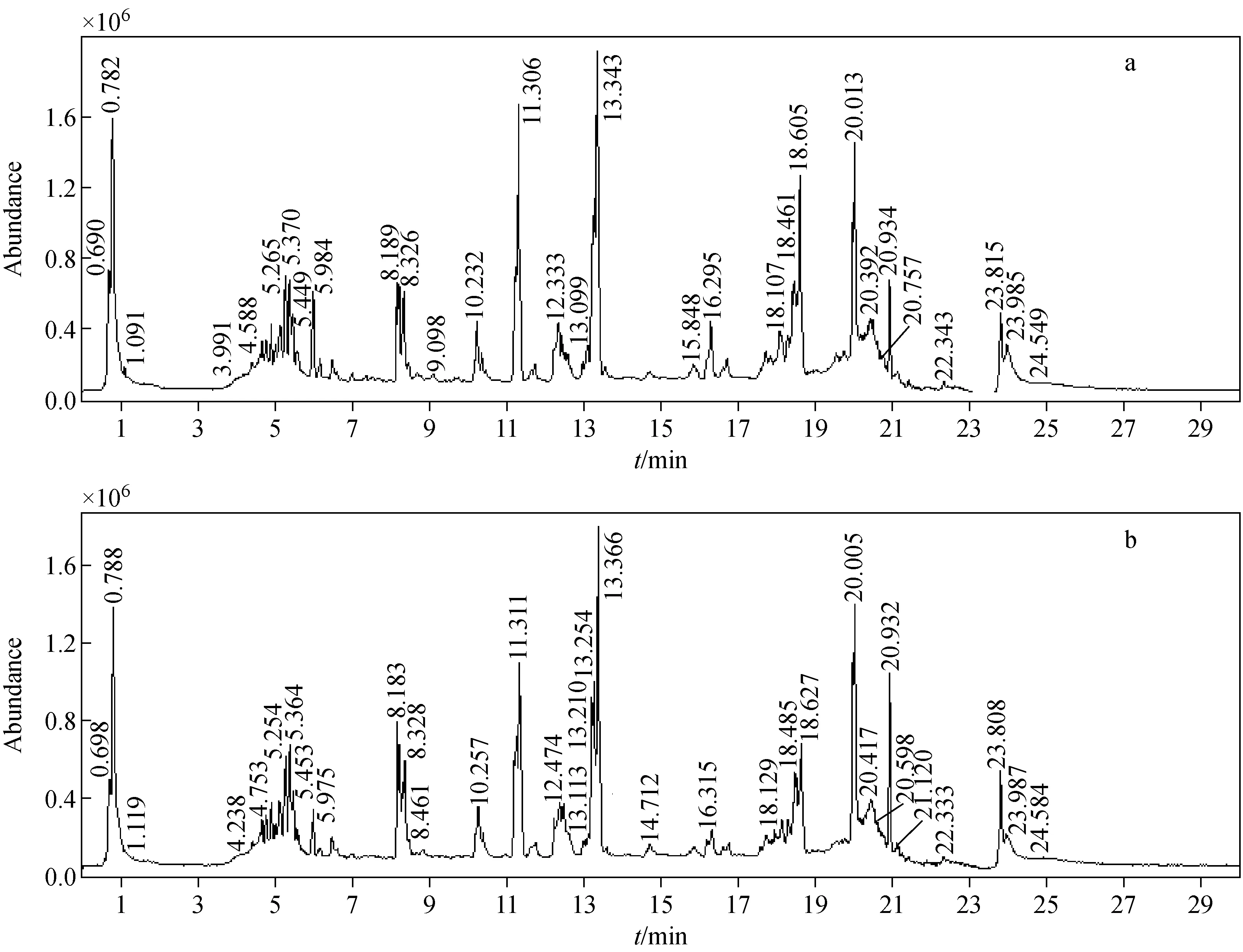
图1 正离子模式下未硫熏川芎(a)和硫熏川芎(b)的总离子流图Fig.1 TIC of sun-dried (a) and sulfur-fumigated (b) Chuanxiong Rhizoma in positive ion mode
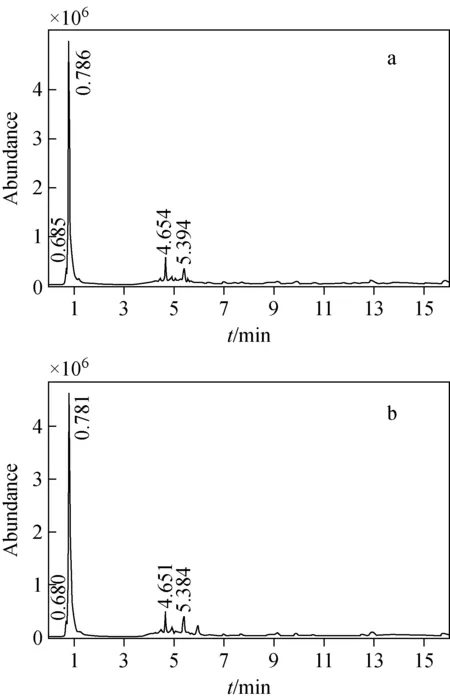
图2 负离子模式下未硫熏川芎(a)和硫熏川芎(b)的总离子流图Fig.2 TIC of sun-dried (a) and sulfur-fumigated (b) Chuanxiong Rhizoma in negative ion mode
2.2 成分鉴定
按照1.5 节的相关步骤和思路,将PeakView软件中的质荷比、质量偏差、同位素匹配度、结构匹配度等参数与ChemSpider等数据库关联后,进行化合物的比对和成分鉴定。正负离子模式下所鉴定出的成分分别列于附表1和附表2中(由于篇幅所限,请登录http:∥www.jcmss.com.cn/CN/volumn/current.shtml下载附表)。
2.3 PCA分析
非监督方法是按照样本的特性对原始数据进行分类,把具有相似特性的数据归为一类,用相应的可视化技术进行表达,主成分分析是其中应用最广泛的一种。PCA得分图是将样品的特征信息量压缩,在低维空间显示样品之间的关联性。相似的样本在坐标图中聚在一起,有差异的样本则会分散在不同的区域,据此能够将存在成分差异的各组实验样品进行分类。本实验中正负离子模式下川芎样品的主成分分析得分图示于图3。
本实验提取了两个主要的成分来体现硫熏(包括市售硫熏和实验室自熏)和未硫熏样品的差异,其中主成分1是体现差异最大的成分。从图3中可见,未硫熏样品和硫熏样品的主成分1处于横坐标的两侧,可以明显地将二者区分。实验室自熏样品和市售硫熏样品也存在一定的差异,体现在主成分2上。这主要是因为实验室自熏样品是采用市售未硫熏饮片经过润湿后再进行硫磺熏制的,而市售的硫熏饮片大多是将原药材在产地新鲜采摘后就立即进行硫磺熏制的(有些甚至是反复熏蒸)。因此,实验室自制的硫熏样品和市售的硫熏样品在化学成分上有一定的相似性,但也存在一定的差异性,两者在PCA得分图上所体现出来的差异说明了多元数据分析的准确性和客观性。
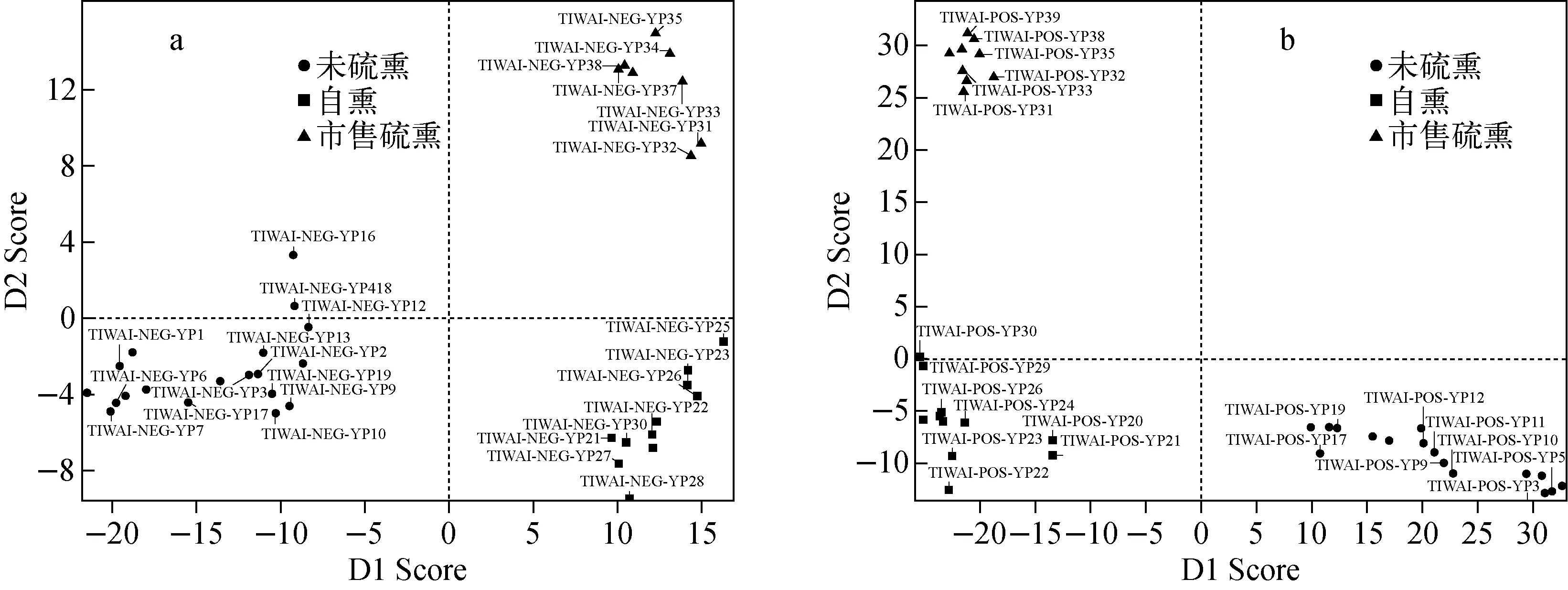
图3 正离子(a)和负离子(b)模式下川芎主成分分析得分图Fig.3 PCA score plot of Chuanxiong Rhizoma in positive (a) and negative (b) ion modes
图3中对类别差异产生影响的离子贡献大小在其载荷图(PCA loading plot)中以其离原点的距离表示,正负离子模式下对应的载荷图示于图4。图中每个点代表对分类有贡献的成分,对其分类影响越大的离子在载荷图中距离原点的距离越远,可被认为是区别各组的标志物。
在MarkerView 软件中应用t检验进行组与组之间的比较,可得到各离子的p值分布图(Log (fold change) versusp-value plot),示于图5。图中越贴近X轴越靠近X轴两端的离子是组间差异越大的离子。针对p值低于0.05的离子,推断其可能的来源和裂解方式,并进一步在PeakView软件中导出其相应的.mol文件与对应的各个碎片进行匹配,选取在置信区间范围内的相应差异成分。图5中p<0.05成分的鉴定结果分别在表2和表3中列出。表中,t>0,表明硫熏后峰强度减小;t<0,表明硫熏后峰强度增大。
通过对川芎硫磺熏蒸后差异性成分可能的变化途径进行推测和验证,确定了部分成分的转化途径和所得成分,列于表4。转化途径主要为α-羟基和酚羟基的硫酯化和亚硫酯化、内酯类化合物单个或者多个内酯键的水解以及两者的复合转化。本课题组前期研究所得的液相色谱指纹图谱中,硫熏样品比未硫熏样品明显多出的一个色谱峰位于阿魏酸和咖啡酸之间,因其出峰位置有多个紫外最大吸收波长,故推测该色谱峰并非单一成分,很可能是多个成分形成的峰包;根据成分的极性和相对出峰顺序以及本实验所鉴定的成分,推断其可能是香荚兰酸、洋川芎内酯H或其同分异构体的硫酯化物或水解产物以及邻苯二甲酸二丁酯内酯键水解后的产物。洋川芎内酯H的硫酯化物的二级质谱碎片匹配及结构推导示于图6。

图5 正离子(a)和负离子(b)模式下川芎各离子的p值分布图Fig.5 Log (fold change) versus p-value plot of Chuanxiong Rhizoma in positive (a) and negative (b) ion modes
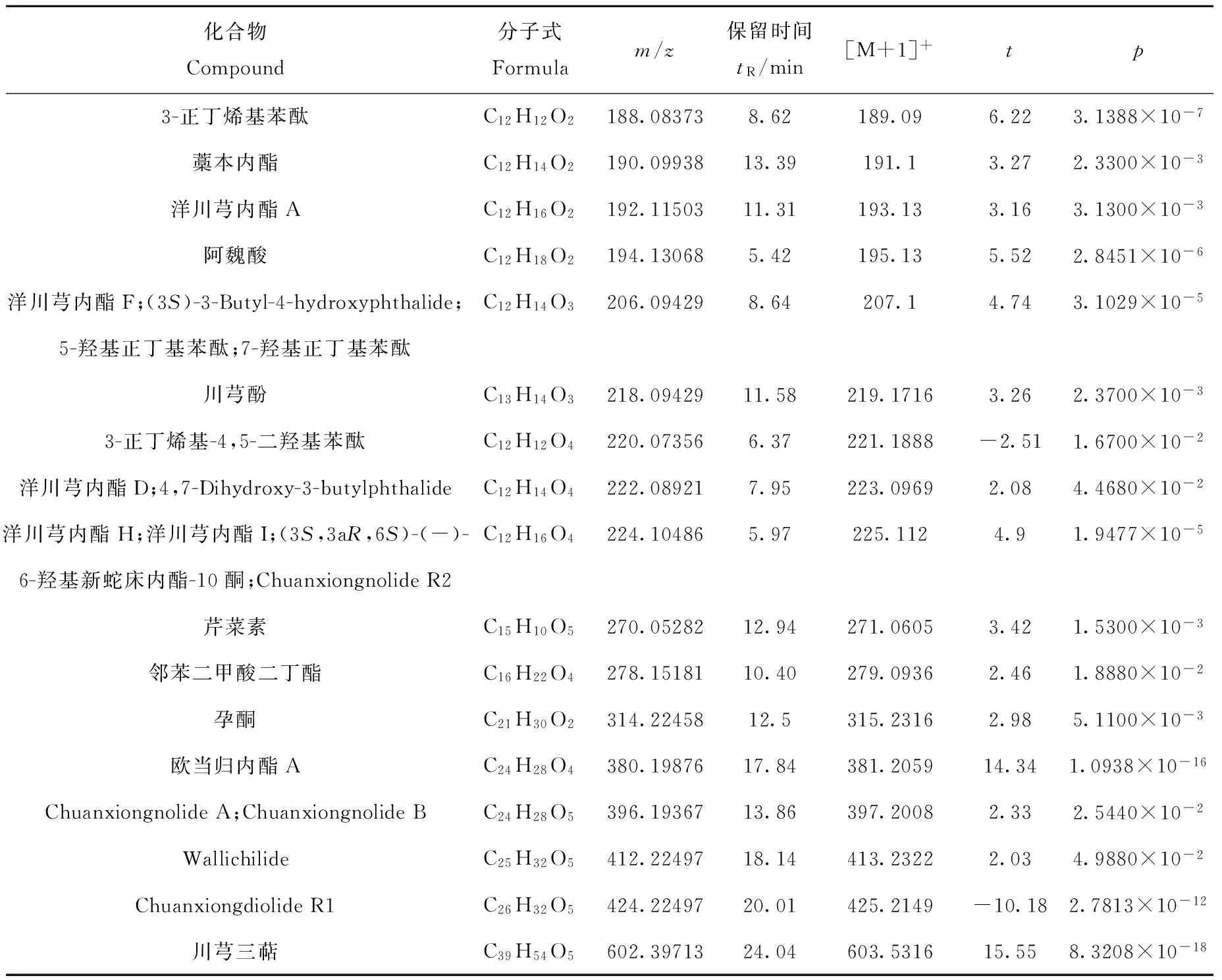
化合物Compound分子式Formulam/z保留时间tR/min[M+1]+tp3-正丁烯基苯酞C12H12O2188.083738.62189.096.223.1388×10-7藁本内酯C12H14O2190.0993813.39191.13.272.3300×10-3洋川芎内酯AC12H16O2192.1150311.31193.133.163.1300×10-3阿魏酸C12H18O2194.130685.42195.135.522.8451×10-6洋川芎内酯F;(3S)-3-Butyl-4-hydroxyphthalide;C12H14O3206.094298.64207.14.743.1029×10-55-羟基正丁基苯酞;7-羟基正丁基苯酞川芎酚C13H14O3218.0942911.58219.17163.262.3700×10-33-正丁烯基-4,5-二羟基苯酞C12H12O4220.073566.37221.1888-2.511.6700×10-2洋川芎内酯D;4,7-Dihydroxy-3-butylphthalideC12H14O4222.089217.95223.09692.084.4680×10-2洋川芎内酯H;洋川芎内酯I;(3S,3aR,6S)-(-)-C12H16O4224.104865.97225.1124.91.9477×10-56-羟基新蛇床内酯-10酮;ChuanxiongnolideR2芹菜素C15H10O5270.0528212.94271.06053.421.5300×10-3邻苯二甲酸二丁酯C16H22O4278.1518110.40279.09362.461.8880×10-2孕酮C21H30O2314.2245812.5315.23162.985.1100×10-3欧当归内酯AC24H28O4380.1987617.84381.205914.341.0938×10-16ChuanxiongnolideA;ChuanxiongnolideBC24H28O5396.1936713.86397.20082.332.5440×10-2WallichilideC25H32O5412.2249718.14413.23222.034.9880×10-2ChuanxiongdiolideR1C26H32O5424.2249720.01425.2149-10.182.7813×10-12川芎三萜C39H54O5602.3971324.04603.531615.558.3208×10-18

表3 负离子模式下鉴定出的川芎中差异性化学成分(p<0.05)Table 3 Components identified with significant differences from Chuanxiong Rhizoma in negative ion mode (p<0.05)
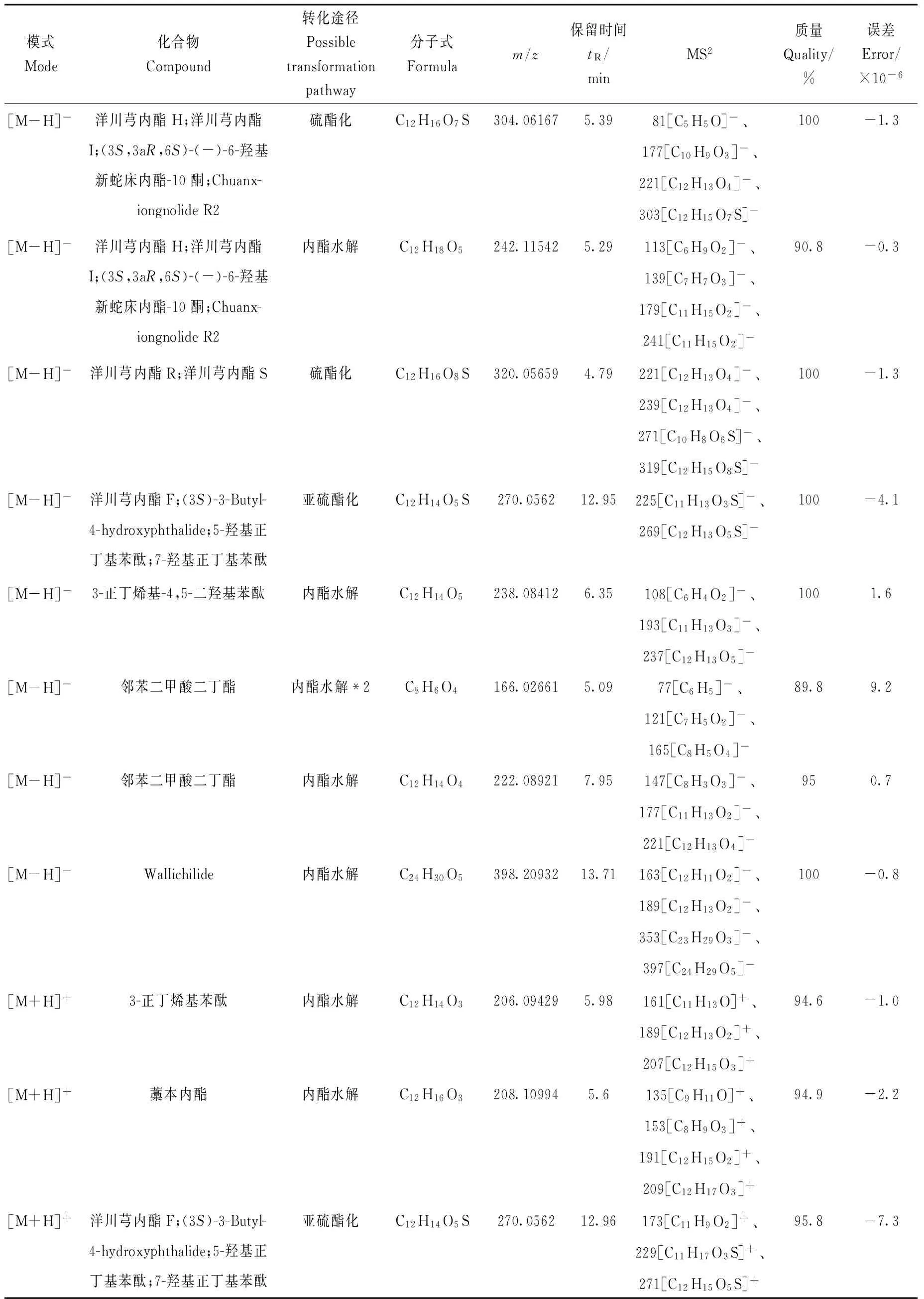
表4 川芎硫磺熏蒸后差异性成分可能的转化途径Table 4 Possible transformation pathways of components with significant differences from Chuanxiong Rhizoma after sulfur-fumigation
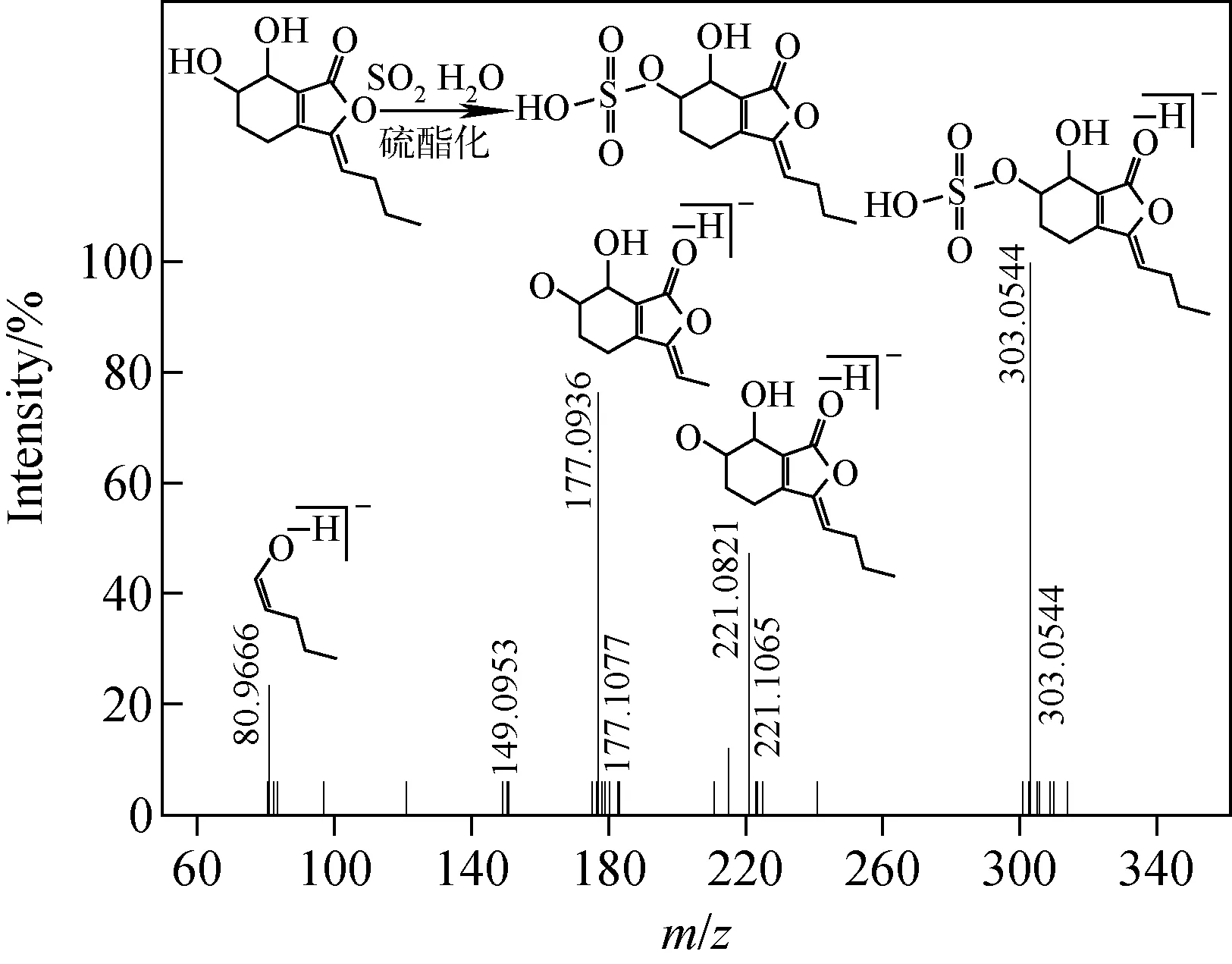
图6 洋川芎内酯H的硫酯化物的二级质谱碎片匹配及结构推导Fig.6 MS/MS spectrum with assigned fragment structures of senkyunolide H sulfite
3 结论
本研究采用UHPLC-Q-TOF MS和化学计量学方法研究了川芎硫磺熏蒸前后化学成分的变化。通过PCA分析发现,正负离子模式下,未硫熏和硫熏川芎样品均可被明显地区分,主成分之间存在明显差异,t检验结果进一步证实了两者之间存在大量差异性成分。通过对差异性成分进行结构解析,对其可能的变化途径进行推测,验证了部分成分的转化途径和转化所得的成分。实验所建立的研究模式可为中药材和饮片及其他复杂体系成分的鉴定和差异性成分的研究提供方法借鉴,研究结果可为硫磺熏蒸对川芎质量的影响提供客观参考,并为控制硫磺熏蒸在中药材和饮片加工过程中的过度运用和确保中医临床用药的安全提供理论依据。
[1] 国家药典委员会. 中华人民共和国药典2015年版(一部)[S]. 北京:中国医药科技出版社,2015:40.
[2] 李松林,林鸽,钟凯声,等. 应用HPLC-DAD-MS联用技术研究中药川芎指纹图谱[J]. 药学学报,2004,39(8):621-626.
LI Songlin, LIN Ge, CHUNG Hoising, et al. Study on fingerprint of Rhizome Chuanxiong by HPLC-DAD-MS[J]. Acta Pharmaceutica Sinica, 2004, 39(8): 621-626(in Chinese).
[3] 彭仕华,周同惠. 丁基苯酞的体内代谢转化研究[J]. 药学学报,1996,31(10):780-784.
PENG Shihua, ZHOU Tonghui. Investigation oninvivometabolism ofn-butyl phthalide[J]. Acta Pharmaceutica Sinica, 1996, 31(10): 780-784(in Chinese).
[4] 徐皓亮,冯亦璞. 丁基苯酞对大鼠血栓形成及血小板功能的影响[J]. 药学学报,2001,36(5):329-333.
XU Haoliang, FENG Yipu. Effects of 3-N-butylphthalide on thrombosis formation and platelet function in rats[J]. Acta Pharmaceutica Sinica, 2001, 36(5): 329-333(in Chinese).
[5] 刘静静,刘晓,李松林,等. 硫磺熏蒸中药材及饮片的研究现状[J]. 中草药,2010,41(8):1 403-1 406.
LIU Jingjing, LIU Xiao, LI Songlin, et al. Current situation in studies on traditional Chinese medicinal materials and Yinpian by sulfur-fumigated process[J]. Chinese Traditional and Herbal Drugs, 2010, 41(8): 1 403-1 406(in Chinese).
[6] LI S L, SONG J Z, CHOI F F K, et al. Chemical profiling ofRadixPaeoniaeevaluated by ultra performance liquid chromatography/photo-diode-array/quadrupole time-of-flight mass spectrometry[J]. Journal of Pharmaceutical and Biomedical Analysis, 2009, 49(2): 253-266.
[7] 黄昆,王文辉,李宝才,等. 超高效液相色谱和质谱联用在药物研究领域的应用[J]. 光谱实验室,2009,26(4):922-930.
HUANG Kun, WANG Wenhui, LI Baocai, et al. Applications of combined ultra-high performance liquid chromatography (UPLC) and mass spectrometry (MS) in the field of drug research[J]. Chinese Journal of Spectroscopy Laboratory, 2009, 26(4): 922-930(in Chinese).
[8] 练杭芸,徐王彦君,梁乾德,等. UPLC-QTOF MS法比较赤芍、白芍煎液化学成分差异[J]. 质谱学报,2014,35(3):269-278.
LIAN Hangyun, XU Wangyanjun, LIANG Qiande, et al. Chemical comparison between decoctions ofRadixPaeoniaeRubraandRadixPaeoniaeAlbaby UPLC-QTOF MS[J]. Journal of Chinese Mass Spectrometry Society, 2014, 35(3): 269-278(in Chinese).
[9] 侯娅,马阳,邹立思,等. 基于UPLC-Triple-TOF-MS/MS技术分析不同产地太子参的差异化学成分[J]. 质谱学报,2015,36(4):359-366.
HOU Ya, MA Yang, ZOU Lisi, et al. Difference of chemical compositions inPseudostellariaeRadixfrom different origins by UPLC-Triple TOF-MS/MS[J]. Journal of Chinese Mass Spectrometry Society, 2015, 36(4): 359-366(in Chinese).
[10]王静哲,刘震,马立满,等. 基于UPLC-Q-TOF MS分析加工炮制对玄参化学成分的影响[J]. 质谱学报,2016,37(1):1-9.
WANG Jingzhe, LIU Zhen, MA Liman, et al. Changes of chemical constituents inScrophulariaeRadixduring processing based on UPLC-Q-TOF MS[J]. Journal of Chinese Mass Spectrometry Society, 2016, 37(1): 1-9(in Chinese).
[11]张小平,蒋可志,吕惠卿,等. HPLC-Q-TOF MS鉴定条叶榕根茎乙酸乙酯提取物中的主要化学成分[J]. 质谱学报,2015,36(4):310-320.
ZHANG Xiaoping, JIANG Kezhi, LV Huiqing, et al. Identification and characterization of major chemical compounds in the ethyl acetate extract fromFicuspandurataHance Aerial Roots by HPLC-Q-TOF MS[J]. Journal of Chinese Mass Spectrometry Society, 2015, 36(4): 310-320(in Chinese).
[12]宋燕燕,李敏,吴柱樟,等. 采用UPLC-Q-TOF MS技术分析坛紫菜中脂质成分[J]. 质谱学报,2015,36(5):425-433.
SONG Yanyan, LI Min, WU Zhuzhang, et al. Rapid identification of lipid compositions fromPorphyrahaitanensisby UPLC-Q-TOF MS[J]. Journal of Chinese Mass Spectrometry Society, 2015, 36(5): 425-433(in Chinese).
[13]马强,白桦,王超,等. 超高效液相色谱-四极杆-飞行时间质谱法快速筛查化妆品中18 种香豆素类化合物[J]. 分析测试学报,2014,33(3):248-255.
MA Qiang, BAI Hua, WANG Chao, et al. Rapid screening of 18 coumarin compounds in cosmetics by ultra performance liquid chromatography-quadrupole time-of-flight mass spectrometry[J]. Journal of Instrumental Analysis, 2014, 33(3): 248-255(in Chinese).
[14]董静,王弘,万乐人,等. 高效液相色谱/电喷雾-离子阱-飞行时间质谱分析鉴定中药虎杖中的主要化学成分[J]. 色谱,2009,27(4):425-430.
DONG Jing, WANG Hong, WAN Leren, et al. Identification and determination of major constituents inPolygonumcuspidatumSieb. et Zucc. by high performance liquid chromatography/electrospray ionization-ion trap-time-of-flight mass spectrometry[J]. Chinese Journal of Chromatography, 2009, 27(4): 425-430(in Chinese).
Investigation on Differences of Chemical Constituents between Sun-Dried and Sulfur-FumigatedChuanxiongRhizomaBased on UHPLC-Q-TOF MS and Chemometric Analysis
CAI Hao1,2, QIAO Feng-xian1,2, PEI Ke3, DUAN Yu1,2, FAN Kai-lei1,2, LIU Xiao1,2, XU Yang-yang1,2, WANG Xiao-qi1
(1.SchoolofPharmacy,NanjingUniversityofChineseMedicine,Nanjing210023,China;2.EngineeringCenterofStateMinistryofEducationforStandardizationofChineseMedicineProcessing,NanjingUniversityofChineseMedicine,Nanjing210023,China; 3.InstituteofPharmaceuticalandFoodEngineering,ShanxiUniversityofTraditionalChineseMedicine,Taiyuan030024,China)
Sulfur-fumigation has been used around the world for centuries in the food industry to inhibit oxidation of the light-colored fruits or vegetables, and this sulfur-based preservative approach has also been employed in postharvest handling of the medicinal herbs to preserve color and freshness, and to protect against insects and molds over the last several decades in China. However, more and more recent reports about sulfur-fumigation show that it can cause the chemical transformations of the original bioactive components (the sulfur dioxide obtained from the heating of sulfur, as a strong reducing agent, may react with the ketonic group and hydroxyl radical-containing components of the medicinal herbs), affect the efficacies and the pharmacokinetics of the medicinal herbs and their extracts or preparations, and more seriously it can even lead to a toxic reaction in the liver and kidneys. Therefore, the influence on the intrinsic quality ofChuanxiongRhizomacaused by sulfur-fumigation needs to be investigated systematically. In this paper, the differences of chemical constituents between sun-dried and sulfur-fumigatedChuanxiongRhizomawere investigated based on UHPLC-Q-TOF MS and chemometric analysis. The samples of 19 batches of sun-driedChuanxiongRhizoma, 11 batches of lab-prepared sulfur-fumigatedChuanxiongRhizoma, and 9 batches of industrial sulfur-fumigatedChuanxiongRhizomawere taken as the research objects. The sample solutions were prepared by the optimized extraction method. After injection of the prepared sample solutions, PeakView1.2 software was applied to analyze the mass spectrometric data and to identify the constituents based on the accuratem/zvalues of Q-TOF MS and the fragments of Q-TOF MS2. Meanwhile, MarkerView1.2.1 software was combined to develop the principal component analysis andt-test statistical analysis to identify as more common components and components with significant differences as possible. The results showed that the samples of sun-dried and sulfur-fumigatedChuanxiongRhizomacould be classified clearly both in positive and negative ion modes by the means of principal component analysis, and there were obvious statistical differences existed among the principal components. What’s more, the results oft-test also demonstrated that there were a large number of constituents with statistical differences existed between sun-dried and sulfur-fumigatedChuanxiongRhizoma, and parts of them were identified and their possible transformation pathways were further proposed. The study can provide the objective reference for the influence of sulfur-fumigation on the quality ofChuanxiongRhizoma, and the theoretical basis for the control of excessive use of sulfur-fumigation in the processing of Chinese medicinal herbs and for the ensurance of safety and effectiveness of clinical medication in Chinese medicine.
UHPLC-Q-TOF MS; chemometric analysis;ChuanxiongRhizoma; sulfur-fumigation;t-test; principal component analysis (PCA); composition transformation; components with significant differences
2016-09-02;
2016-11-28
国家自然科学基金(81673600,81173546,30940093);江苏省国际科技合作计划项目(BZ2011053);国家药典委员会项目;江苏省普通高校研究生科研创新计划项目(KYLX_0975);江苏高校优势学科建设工程项目(2011ZYX2-001)资助
蔡 皓(1966—),男(汉族),副研究员,硕士生导师,从事中药分析及中药质量控制研究。E-mail: haocai_98@126.com
O657.63
A
1004-2997(2017)01-0127-11
10.7538/zpxb.2017.38.01.0127

