间充质干细胞多模态示踪方法的应用
吴 春,姜在波,朱康顺,黄明声,关守海,李征然,钱结胜,李名安,单 鸿
(中山大学附属第三医院放射科 介入放射学研究所,广东 广州 510630)
间充质干细胞多模态示踪方法的应用
吴 春,姜在波,朱康顺,黄明声,关守海,李征然,钱结胜,李名安,单 鸿*
(中山大学附属第三医院放射科 介入放射学研究所,广东 广州 510630)
目的 合成具备MR显像和基因传输功能的纳米载体,探讨载体对间充质干细胞(MSCs)的基因传输功能及其联合生物发光成像(BLI)和MRI对MSCs双模态示踪的能力。方法 合成三元共聚物聚乙二醇-聚天冬氨酸(聚乙烯亚胺)-超顺磁性氧化铁纳米颗粒载体(PAI/SPION);利用凝胶阻滞实验分析载体携带质粒(pDNA)的能力;电位及粒度测定仪测量载体复合pDNA后的粒径和电位;采用大鼠股骨骨髓分离培养MSCs;采用流式细胞仪、激光共聚焦显微镜评估PAI/SPION/pDNA对MSCs的基因转染效率;联合BLI和MRI双模态示踪MSCs。结果 成功合成了载体PAI/SPION。氨基与质粒磷酸根的摩尔比(N/P)=3.0时,PAI/SPION可完全复合pDNA。N/P=12时,粒径趋于稳定,为(74.8±8.1)nm,电位为(12.2±1.5)mV,载体对MSCs的基因转染率为(71.2±2.3)%。激光共聚焦显微镜下,胞浆内可见大量表征PAI/SPION的绿色荧光和表征pDNA的红色荧光,且MSCs生物发光强度最高,T2*WI标准化信号强度最低。结论 本研究成功合成了MRI可视的基因传输载体PAI/SPION;载体可高效传输pDNA至大鼠MSCs,且可成功联合BLI和MRI双模态示踪MSCs。
间充质干细胞;基因;生物发光;磁共振成像
多种致病因素均可导致急、慢性肝功能损伤,间充质干细胞(mesenchymal stem cells, MSCs)移植为治疗肝损伤提供了新途径[1-2]。已有研究[3-5]报道,干细胞移植有助于肝损伤的修复和再生。但由于缺乏有效的干细胞活体示踪技术,干细胞移植的临床应用受到了限制,因此研制实时、无创的干细胞示踪成像技术非常重要。本研究利用合成的具备基因传输功能和MRI显像功能的三元共聚物载体(PAI/SPION),对MSCs基因传输及联合生物发光成像(bioluminescence imaging, BLI)和MRI双模态示踪MSCs进行研究。
1 材料与方法
1.1 主要实验仪器与材料 聚乙二醇-聚天冬氨酸(胱胺二盐酸-丁二酸酐)[mPEG-b-PAsp(DMEA-SA),中山大学化工学院提供];水溶性Fe3O4纳米颗粒(WSPION,中山大学化工学院提供);端氨基线性聚乙烯亚胺(lPEI-NH2,中山大学化工学院提供);质粒pDNA(pCMV-Luciferase2-mKate2,中山大学附属第三医院分子影像实验室提供);低糖DMEM培养基(Gibco公司);荧光染料Oregen Green 488(Molecular Probes公司);胎牛血清(Gibco公司);荧光染料popo-3(Molecular Probes公司);电泳凝胶成像分析仪(Alpha Innotech公司);90Plus-Zeta电位及粒度测定仪(BI-MAS公司);流式细胞仪(BD公司);激光共聚焦显微镜(Zeiss公司);GE 1.5T MRI扫描仪;活体成像系统(Caliper Life Science公司)。
1.2 实验动物 取6周龄雌性SD大鼠3只,体质量80~90 g,由中山大学动物中心提供,批号为SYXK(粤)2012-0081,并通过中山大学实验动物伦理委员会许可。
1.3 纳米载体PAI/SPION的合成 ①将1.52 g lPEI-NH2溶解于20 ml乙二胺四乙酸中,再加入1.2 eq三乙胺,室温下反应30 min。②将1.07 gm PEG-b-PBLAsp(DMEA-SA)溶解于20 ml乙二胺四乙酸中,再加入0.4 g N-羟基琥珀酰亚胺,反应溶液水浴至18℃,加入0.72 g二环己基碳二亚胺,充入氩气,将反应溶液密封。③1 h后,再缓慢加入配制好的lPEI-NH2溶液,18℃水浴反应1 h,然后置于室温下24 h。④过滤去除沉淀物,将滤液用去离子水透析,以去除有机溶剂和过量的lPEI-NH2,冻干后获得终产物聚乙二醇-聚天冬氨酸(聚乙烯亚胺)[mPEG-b-PAsp(-g-ss-PEI)],即PAI。⑤将100 mg PAI溶解于5 ml去离子水中,然后加入40 mg WSPION,于室温下搅拌48 h,用450 nm滤过膜去除较大的聚合物颗粒。⑥反应产物经去离子水离心超滤,再用220 nm滤过膜过滤后,得到终产物PAI/SPION溶液,置于4℃恒温环境中保存。
1.4 凝胶阻滞实验 ①质粒pDNA(pCMV-Luciferase2-mKate2)含有荧光素酶表达基因和红色荧光蛋白表达基因。按照载体氨基与质粒磷酸根的摩尔比(ratio of nitrogen to phosphorus, N/P;1.5、2.0、2.5、3.0、3.5)配制不同类型的PAI/SPION/pDNA复合物溶液。取1 μg pDNA与相应量载体PAI/SPION溶液混匀,室温静置复合30 min。②取0.3 g琼脂糖加入30 ml TAE缓冲液,微波炉加热至琼脂糖完全溶解,将溶液倒入插有梳子的平板,加1.5 μl溴化乙锭溶液,室温下静置30 min待琼脂糖溶液凝固。③琼脂糖溶液完全凝固后拔出梳子,将上述复合好的体系和未经载体复合的pDNA加入上样孔,恒压100 V电泳45 min后,置于紫外线灯下观察电泳条带。
1.5 粒径和电位测量 ①按照不同的N/P比(6、8、10、12、14、16)配制不同的PAI/SPION/pDNA复合物溶液,取1 μg pDNA和相应质量载体溶液混匀,室温静置复合30 min。②将复合好的体系PAI/SPION/pDNA和未复合质粒的载体PAI/SPION溶液各取50 μl置入比色杯中,利用90 Plus-Zeta电位及粒度测定仪分别测量其粒径和电位,入射激发光波长λ=532 nm,入射角θ=90°,测量5次取其平均值。
1.6 MSCs的分离和培养 ①将6周龄雌性SD大鼠脱颈处死,于无菌条件下将大鼠股骨分离并浸泡入低糖DMEM培养基(10%胎牛血清,1%青/链霉素)[6]。②离断大鼠股骨干,用26号针将低糖DMEM培养基沿股骨干断端注入骨髓腔内冲洗骨髓组织,获取骨髓组织混悬液。③骨髓组织混悬液离心分离20 min后,用低糖DMEM培养基重悬沉淀物,置入培养皿内于恒温培养箱中培养。④24 h后,去除未贴壁细胞,每隔3天更换培养基,当细胞贴壁率达到70%时,用胰酶消化分离细胞,按1∶3比率稀释传代。第4代MSCs用于本实验研究。
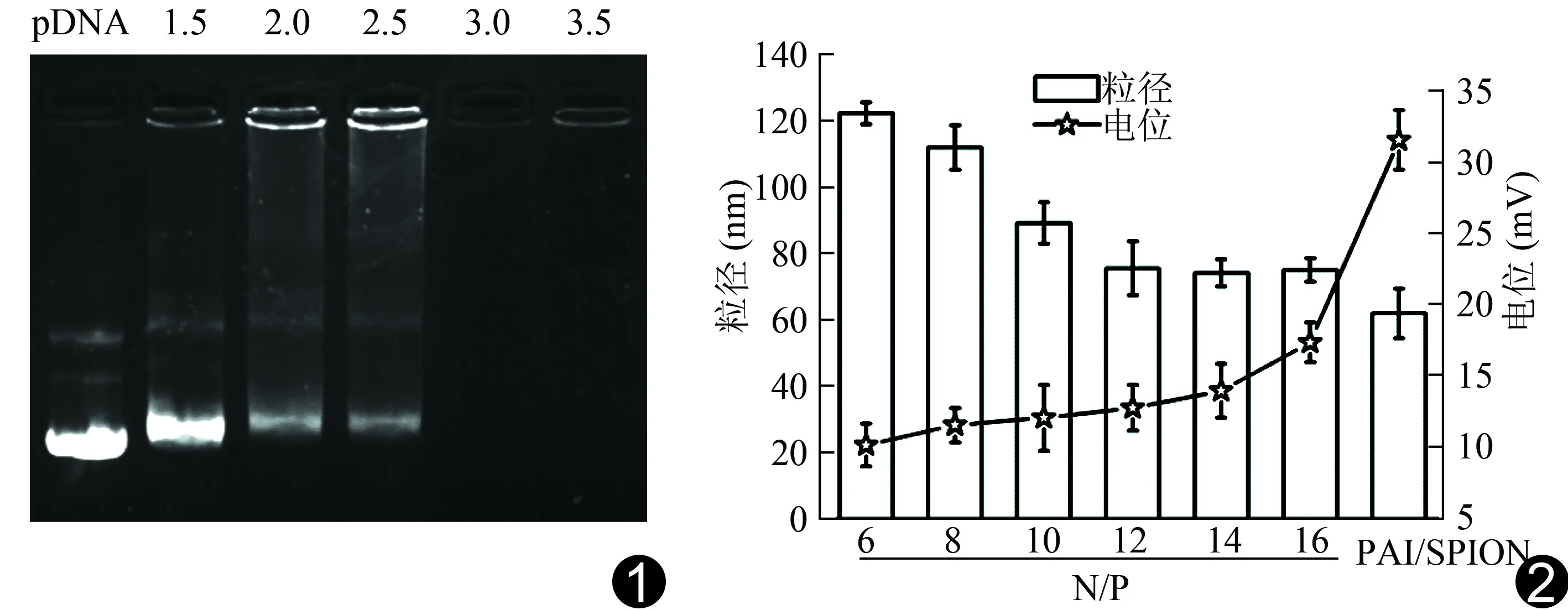
图1 不同N/P比pDNA被载体PAI/SPION负载后在琼脂糖凝胶中电泳图 图2 不同N/P比条件下PAI/SPION/pDNA的电位和粒径图
1.7 MSCs吸收分析 荧光染料popo-3标记的pDNA(红色荧光)被用来观察细胞对质粒的吸收。①在激光共聚焦皿内种入MSCs,每孔的细胞数量约为1 000个。②用Oregon Green 488荧光染料标记PAI/SPION(绿色荧光),用popo-3荧光染料标记pDNA(红色荧光)[7],每个细胞培养皿内pDNA用量为4 μg,按照N/P=12制备复合物PAI/SPION/pDNA。③将复合物PAI/SPION/pDNA加入细胞培养皿,于恒温培养箱孵育1 h。④在细胞培养皿中加入DNA染色剂DAPI(1 mg/ml),孵育15 min后在激光共聚焦显微镜下观察并实时记录。
1.8 MSCs转染分析 ①在6孔板内种入MSCs,每孔的细胞数量约为2×105个。②每孔细胞培养基中pDNA用量为4 μg,按照不同的N/P比(8、10、12、14、16)分别配制复合物PAI/SPION/pDNA。③将配制好的不同复合物体系分别加入细胞培养孔,在恒温培养箱中孵育48 h。④消化、分离细胞并重悬在300 μl PBS溶液中,采用流式细胞仪检测红色荧光蛋白阳性细胞数量评估复合物的MSCs基因转染效率。未进行转染的MSCs作为空白对照组。采用WinMDI 2.9软件分析流式细胞仪检测数据。
1.9 MSCs的BLI MSCs中报告基因表达程度 利用生物发光成像进行评估。①在48孔板内种入MSCs,每孔的细胞数量约为6×104个。②按照不同的N/P比(8、10、12、14、16)分别配制复合物PAI/SPION/pDNA,每孔细胞培养基中pDNA用量为 2 μg。③将配制好的不同复合物体系分别加入细胞培养孔,在恒温培养箱中孵育48 h。④室温下将荧光素酶底物(30 μg)加入细胞培养孔,利用活体成像系统观察MSCs的BLI并实时记录,定量分析不同处理组细胞的生物发光强度,以photos/sec/cm2/steradian(sr)为生物发光强度单位。未转染的MSCs作为对照组。
1.10 MSCs的MR扫描 利用MR评估MSCs对PAI/SPION/pDNA的吸收能力。扫描前准备:①在6孔板内种入MSCs,每孔细胞数量约为2×105个;②按照不同的N/P比(8、10、12、14、16)配制复合物PAI/SPION/pDNA,每孔细胞培养基中pDNA用量设为4 μg;③将不同复合物分别加入细胞培养孔,恒温培养箱内孵育1 h;④称取0.4 g明胶置入10 ml双蒸水中,制备4%明胶溶液备用;⑤使用胰酶消化分离干细胞,用300 μl PBS溶液重悬MSCs,置入小离心管;⑥干细胞悬液与等体积的4%明胶溶液混合,置入96孔板。
MR扫描:采用GE Signa Excite Ⅱ 1.5T MR扫描仪,8通道头部线圈,对MSCs悬液进行T2*WI。扫描参数:TR 450 ms,TE 15ms,翻转角15°,FOV 200 mm×200 mm,矩阵320×192,层厚1.0 mm,层间距1.0 mm。ROI设置为30 mm2,测量细胞悬液 T2*WI信号强度。各处理组MSCs悬液MR信号强度除以对照组MSCs悬液MR信号强度,获得标准化信号强度百分率。未进行转染的细胞作为对照组。

2 结果
2.1 凝胶阻滞 pDNA条带的强度随N/P比的增加而逐渐减弱,当N/P比达3.0时,游离的pDNA条带完全消失(图1),裸pDNA为对照组。提示在N/P比达3.0时,载体PAI/SPION可以完全负载pDNA。
2.2 电位和粒径 PAI/SPION的电位与粒径分别为(+31.3±2.3)mV、(61.2±6.5)nm。随着N/P比增加,复合物PAI/SPION/pDNA的电位逐渐上升,粒径逐渐下降,在N/P=12时,复合物电位达(12.2±1.5)mV;粒径趋于稳定,为(74.8±8.1)nm,见图2。
2.3MSCS复合物吸收分析结果 激光共聚焦显微镜下见MSCs形态大而扁平,与PAI/SPION/pDNA(N/P=12)孵育的MSCs中呈现出高强度的pDNA红色荧光和PAI/SPION绿色荧光(图3),表明PAI/SPION/pDNA可被MSCs大量吸收。

图3 与N/P=12的复合物PAI/SPION/pDNA共同孵育MSCs的激光共聚焦图像 A.MSCs细胞核呈蓝色荧光; B.pDNA呈红色荧光;C.PAI/SPION呈绿色荧光; D.复合图像呈黄色荧光 (×630;比例尺:50 μm)
2.4MSCs基因转染评估 N/P比不同,其相应的MSCs基因转染效率也不同。在N/P=12时,与PAI/SPION/pDNA共同孵育的MSCs基因转染效率最高,为(71.2±2.3)%。N/P=8、10、14、16时,其转染效率与N/P=12时比较差异均有统计学意义(P均<0.05),见图4。
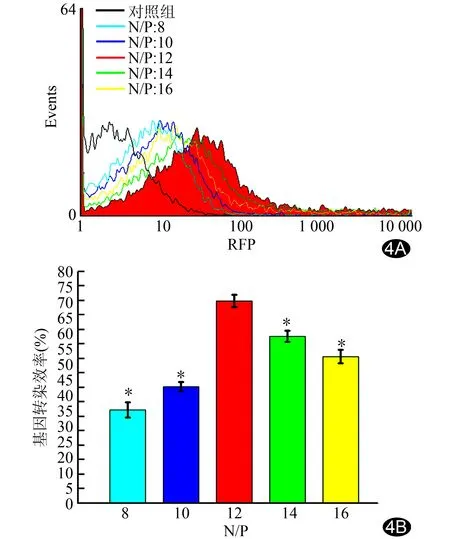
图4 不同N/P比复合物PAI/SPION/pDNA对MSCs的流式分析图(A)及基因转染效率(B) N/P=12时,MSCs基因转染效率最高,为(71.2±2.3)%(n=3;*:与N/P=12时复合物PAI/SPION/pDNA共同孵育MSCs基因转染效率比较,P<0.05)
2.5 MSCs的BLI 在与不同N/P比复合物共同孵育后,与N/P=12的PAI/SPION/pDNA共同孵育的MSCs生物发光强度值最高,与其他N/P比组间比较差异均有统计学意义(P均<0.05),见图5,即当N/P=12时,PAI/SPION能高效的传输pDNA至MSCs内,并且在MSCs内生成丰富的荧光素酶。
2.6 MSCs的MRI 在N/P=12时,MSCs于T2*WI呈现出显著的阴性成像效果(即变暗征象,图6A),标准化MR信号强度值最低,为(37.2±4.1)%,与其他N/P比组间比较差异有统计学意义(P<0.05,图6B)。即N/P=12时,MSCs吸收复合物PAI/SPION/pDNA的效率最高。

图5 MSCs的BLI A.与不同N/P比复合物共同孵育后MSCs的生物发光图像; B.与不同N/P比复合物共同孵育后MSCs生物发光强度值的定量分析(n=3;*:与N/P=12时复合物PAI/SPION/pDNA共同孵育MSCs的生物发光强度比较,P<0.05)

图6 MSCs的MRI成像 A.与不同N/P比复合物共同孵育后MSCs的T2*WI图像; B.与不同N/P比复合物共同孵育后MSCs的标准化T2*WI信号强度(n=5;*:与N/P=12的复合物PAI/SPION/pDNA比较P<0.05;未经复合物转染的MSCs为对照组)
3 讨论
研发高效、非侵袭性的活体成像技术示踪MSCs对细胞移植医学的发展非常重要。本研究合成了新型的MRI可视化非病毒基因传输载体PAI/SPION,将兼有红色荧光蛋白和荧光素酶蛋白报告基因的质粒传输至MSCs内,MSCs被荧光素酶和SPION标记,为联合生物发光成像和MRI对MSCs的双模态示踪提供了可能。
本研究采用琼脂糖凝胶电泳实验评估载体PAI/SPION负载pDNA的能力。裸pDNA具有负电荷,可在电场中移动。而带正电荷的载体利用正、负电荷间的相互作用吸引pDNA,从而限制其在电场中的位移。实验结果显示N/P=3.0时,具有正电荷的载体PAI/SPION可完全中和质粒所具有的负电荷,为PAI/SPION传输质粒进入细胞提供了基础。研究[8-9]表明小的粒径和适当的弱阳性电位有利于细胞对纳米颗粒复合物的吸收。小粒径有利于加强细胞对复合物纳米颗粒的内吞作用,而过高的阳性电位会导致较高的细胞毒性[10]。本研究中,当N/P=12时,复合物PAI/SPION/pDNA的粒径趋向稳定,约(74.8±8.1)nm,电位约(12.2±1.5)mV。为选择复合物最佳粒径值和电位值用于细胞基因转染,本研究进一步评估不同N/P比时形成的复合物PAI/SPION/pDNA对MSCs的基因传输能力。笔者从大鼠股骨骨髓内成功分离、培养MSCs,在激光共聚焦显微镜下,与PAI/SPION/pDNA(N/P=12时)共同孵育的MSCs胞浆内呈现出较强的表征PAI/SPION的绿色荧光和表征pDNA的红色荧光,流式细胞仪定量分析进一步确认N/P=12时,PAI/SPION传输pDNA至MSCs的效率最高,以上均表明当N/P=12时,PAI/SPION/pDNA具备合适的粒径和电位,可传输更多的质粒至MSCs。
当兼有红色荧光蛋白和荧光素酶蛋白报告基因的质粒被载体PAI/SPION传输至MSCs后,荧光素酶蛋白在细胞内大量表达。荧光素酶可催化荧光素酶底物产生光子,所产生的光子可被活体成像系统俘获并进行定量分析[11]。生物发光成像时,当N/P=12,与PAI/SPION/pDNA共同孵育的MSCs中生物发光强度值最高,为活体监控移植入体内的MSCs的生存、迁移、分布提供了基础[12]。研究[13]证实MRI可有效的探测标记磁性可视对比剂的细胞,作为最敏感的超顺磁性MRI对比剂,SPION被广泛用于标记MSCs的相关研究。本研究显示N/P=12时,与复合物PAI/SPION/pDNA共同孵育的MSCs T2*WI信号强度最低,当SPION从移植的MSCs内排出后,SPION会被体内网状内皮系统选择性吸收并参与体内血红蛋白的代谢过程[14]。
BLI和MRI均具备无创、可重复追踪体内移植干细胞的功能。BLI具有无辐射、高敏感度、可进行定量/定性分析并判断移植细胞生存状态的优点,但BLI空间分辨率差,且因光子穿透性差而只适用于小动物实验研究;MRI具备良好的空间分辨率,且成像不受组织深度影响,但其判断移植细胞生存状态的能力相对较低。
总之,本研究合成的新型载体可将荧光素酶报告基因和SPION高效转入MSCs,荧光素酶在MSCs内大量表达,可利用BLI和MRI双模态示踪MSCs,联合两种成像模式优点,并且载体PAI/SPION对MSCs有良好的基因转染效率,在以MSCs为基础的再生医学和基因治疗方面有广阔应用前景。
[1] Jang YO, Kim YJ, Baik SK, et al. Histological improvement following administration of autologous bone marrow-derived mesenchymal stem cells for alcoholic cirrhosis: A pilot study. Liver Int, 2014,34(1):33-41.
[2] 赖丽莎,陈俊伟,朱康顺,等.联合运用骨髓间充质干细胞与促肝细胞生长素治疗大鼠急性肝衰竭.中国医学影像技术,2012,28(12):2127-2131.
[3] Li DL, He XH, Zhang SA, et al. Bone marrow-derived mesenchymal stem cells promote hepatic regeneration after partial hepatectomy in rats. Pathobiology, 2013,80(5):228-234.
[4] Seki T, Yokoyama Y, Nagasaki H, et al. Adipose tissue-derived mesenchymal stem cell transplantation promotes hepatic regeneration after hepatic ischemia-reperfusion and subsequent hepatectomy in rats. J Surg Res, 2012,178(1):63-70.
[5] Zhang Y, Cai W, Huang Q, et al. Mesenchymal stem cells alleviate bacteria-induced liver injury in mice by inducing regulatory dendritic cells. Hepatology, 2014,59(2):671-682.
[6] Pang P, Wu C, Gong F, et al. Nanovector for gene transfection and MR imaging of mesenchymal stem cells. J Biomed Nanotechnol, 2015,11(4):644-656.
[7] Chen G, Chen W, Wu Z, et al. MRI-visible polymeric vector bearing CD3 single chain antibody for gene delivery to T cells for immunosuppression. Biomaterials, 2009,30(10):1962-1970.
[8] Green JJ, Chiu E, Leshchiner ES, et al. Electrostatic ligand coatings of nanoparticles enable ligand-specific gene delivery to human primary cells. Nano Lett, 2007,7(4):874-879.
[9] Dai J, Zou S, Pei Y, et al. Polyethylenimine-grafted copolymer of poly (l-lysine) and poly (ethylene glycol) for gene delivery. Biomaterials, 2011,32(6):1694-1705.
[10] Carrabino S, Di Gioia S, Copreni E, et al. Serum albumin enhances polyethylenimine-mediated gene delivery to human respiratory epithelial cells. J Gene Med, 2005,7(12):1555-1564.
[11] 刘静静,胡晓俊,李征然,等.Luciferase2/mKate2双报告基因对小鼠骨髓间充质干细胞的标记及活体光学成像研究.中山大学学报(医学科学版),2014,35(3):334-339.
[12] 李征然,唐文杰,李丹,等.人永生化骨髓间充质干细胞移植后在肝损伤裸鼠体内的活体光学示踪.实用医学杂志,2014,30(10):1552-1555.
[13] Naseroleslami M, Parivar K, Khoei S, et al. Magnetic resonance imaging of human-derived amniotic membrane stem cells using PEGylated superparamagnetic iron oxide nanoparticles. Cell J, 2016,18(3):332-339.
[14] Wang YX, Hussain SM, Krestin GP. Superparamagnetic iron oxide contrast agents: Physicochemical characteristics and applications in MR imaging. Eur Radiol, 2001,11(11):2319-2331.
Application in multimodality tracking of mesenchymal stem cells
WUChun,JIANGZaibo,ZHUKangshun,HUANGMingsheng,GUANShouhai,LIZhengran,QIANJiesheng,LIMing'an,SHANHong*
(DepartmentofRadiology,theThirdAffiliatedHospital,InsituteofInterventionalRadiology,SunYat-senUniversity,Guangzhou510630,China)
Objective To synthesize MRI-visible gene transfer nanocarrier and to assess the gene delivery ability of nanocarrier to mesenchymal stem cells (MSCs) and monitored the MSCs using bioluminescence imaging (BLI) and MRI. Methods The terpolymer nanocarrier poly (ethylene glycol)-block-poly (L-aspartic acid)-grafted polyethylenimine functionalized with superparamagnetic iron oxide nanoparticles (PAI/SPION) was synthesized. The degree of binding between PAI/SPION and pDNA was determined with agarose gel electrophoresis. The Zeta potential and particle size of polymer vectors were measured with a Zeta-Plus instrument. MSCs were isolated and cultured from the femurs of the rats. The gene transfection efficiency of PAI/SPION/pDNA to MSCs was evaluated by flow cytometry and laser confocal microcopy. And the BLI and MRI were combined to monitor MSCs. Results PAI/SPION vectors were synthesized successfully. PAI/SPION could condense pDNA entirely at a nitrogen of non-viral vector/phosphorus of plasmid (N/P) ratio of 3.0. The particle size of PAI/SPION/pDNA attained a constant size of (74.8±8.1)nm at a N/P ratio of 12, and the Zeta potential reached (12.2±1.5)mV, the transfection efficiency of PAI/SPION/pDNA to MSCs was (71.2±2.3)%. The MSCs showed significantly stronger PAI/SPION (green) and pDNA (red) fluorescence under the laser confocal microcopy, the bioluminescence light intensity of the MSCs attained the highest values and the normalized MR T2*WI signal intensity attained the lowest values. Conclusion The study successfully synthesizes an MRI-visible non-viral gene vector PAI/SPION, which possesses a higher transfection efficiency in transferring pDNA into MSCs and can dually monitor the MSCs using BLI and MRI.
Mesenchymal stromal cells; Genes; Bioluminescence; Magnetic resonance imaging
广东省自然科学基金博士启动项目(2015A030310171)。
吴春(1975—),男,河南郑州人,博士,主治医师。研究方向:分子影像学。E-mail: chunwu@aliyun.com
单鸿,中山大学附属第三医院放射科 介入放射学研究所,510630。E-mail: shanhong@mail.sysu.edu.cn
2016-07-14
2016-10-12
实验研究
10.13929/j.1003-3289.201607066
R329.2; R445.2
A
1003-3289(2017)02-0171-06

