缺血性脑血管病患者血清RBP水平与颈动脉粥样硬化斑块的相关性研究
徐东升, 王引明, 殷晓菁, 胡玲玲, 孔 亮
缺血性脑血管病患者血清RBP水平与颈动脉粥样硬化斑块的相关性研究
徐东升, 王引明, 殷晓菁, 胡玲玲, 孔 亮
目的 探讨缺血性脑血管病(ICD)患者颈动脉粥样硬化性斑块与视黄醇结合蛋白(RBP)含量的关系。方法 选取121例ICD患者和95例正常对照者,检测血清RBP水平;同时检测ICD组、对照组患者血清UA和血浆DD、FIB水平。对于ICD患者结合其颈动脉超声检查结果,又分为无斑块组(57例)、颈动脉稳定斑块组(32例)、颈动脉不稳定斑块组(32例);测定并比较各组血清RBP水平。结果 ICD组血清RBP水平显著高于正常对照组(P<0.05);在ICD患者中,颈动脉稳定斑块组、不稳定斑块组血清RBP水平较无斑块组有明显升高(均P<0.05);另外颈动脉不稳定斑块组血清RBP水平显著要高于稳定斑块组(P<0.05)。线性相关分析表明RBP水平与UA、DD、FIB水平无相关性(r=0.149、0.056、0.065,均P>0.05);Logistic回归分析结果显示:RBP是发生颈动脉粥样斑块的一个危险因素(OR=2.318,95%CI0.007~0.721)。结论 血清RBP可能与动脉粥样硬化发生、发展密切相关,并且可能与ICD患者动脉粥样硬化斑块的稳定性密切相关。
缺血性脑血管病; 颈动脉斑块; 视黄醇结合蛋白
缺血性脑血管病(ischemic cerebrovascular disease,ICD)指供应脑的颈动脉和(或)椎基底动脉等血管发生狭窄或者闭塞,使脑暂时或持续供血不足,导致的颅内脑实质发生缺血性损伤或坏死的总称[1],包括短暂性脑缺血(transcient ischemic attacks,TIA)、急性脑梗死(acute cerebral infarction,ACI)等疾病。ICD是我国中老年人群的最为常见脑血管疾病之一,它有起病较急、死亡率与致残率较高、易再发以及发病年轻化等特点[2]。而动脉粥样硬化(atherosclerosis,AS)是ICD的十分重要的病理基础之一[3,4]。视黄醇结合蛋白(retinolbinding protein,RBP)是肝脏细胞产生并分泌的一种起转运作用的生物活性的蛋白,具有结合、转运体内视黄醇及其衍生物等功能。有学者研究发现,RBP具有参与胰岛素抵抗、导致脂质与尿酸代谢紊乱、促进炎症反应等作用[5]。它参与了AS的发生、发展,可能导致动脉内粥样斑块发生破裂[6],导致最终发生ICD。
本研究对ICD患者行颈动脉彩色超声学检查,同时检测其血浆RBP的水平,并以此探讨血浆RBP水平是否能成为预测ICD患者颈动脉内不稳定性斑块的可靠血液标志物,为今后ICD的防治工作提供有价值的参考依据。
1 材料与方法
1.1 一般资料 选取2015年4月-2016年7月在本院住院治疗的ICD患者121例,包括ACI96例,TIA25例,共含男性65例,女性56例;年龄为36~92岁,平均为(66.47±11.87)岁;所有ICD病例都符合全国第四届脑血管病学术会议上制定的脑梗死或TIA的诊断标准[7],即予头部MRI或者CT检查后确诊。脑梗死病例纳入标准:发病3 d内入院;有详细的病史资料。排除标准:脑出血、颅内肿瘤、脑栓塞、血管炎等自身免疫性疾病所致脑梗死、多发性硬化等。TIA病例纳入标准:有详细的病史资料。排除标准:排除脑梗死、脑出血、癫痫、颅内肿瘤、脑脓肿等。对照组95例,为本院同期体检的患者,含男性48例,女性47例;年龄为40~90岁,平均为(67.72±11.67)岁。所有标本的采集均经过患者或其家属知情并同意。
1.2 研究方法
1.2.1 颈动脉彩色超声学检测 入选患者都接受颈动脉彩色超声学检查,使用荷兰飞利浦公司产的HD11型彩色超声显像仪,探头频率7.5 Hz。测定双侧颈动脉内-中膜的厚度(IMT),IMT的定义:管腔内膜交界面至管腔中膜、外膜交界面间的垂直距离,如果IMT<1.0 mm时为正常;若1.0 mm≤IMT<1.5 mm 时,定义是内膜增厚;而局部隆起、增厚并向动脉管腔内形成突起,且IMT≥1.5 mm称之为内膜斑块形成[8]。依据斑块的大小、所在的位置、斑块形态与回声特点等[9],将动脉斑块分为:均质、强回声或伴有声影、钙化型的硬斑块;均质、等回声、纤维型的斑块;均质、低回声、脂质型的软斑块;不均质回声、溃疡型的斑块,称为混合斑块。如果斑块回声不均,则说明内部含有两种以上并且回声强度不同之斑块,则称混合斑块。钙化型硬斑块、纤维型斑块等都属于稳定斑块;混合斑块、软斑块等属于不稳定斑块[10]。
1.2.2 实验室检查 所有入组患者在入院次日晨起禁食,空腹状态抽取肘静脉血6 ml,使用日本产的日立7600牌全自动生化分析仪,予免疫透射比浊法,检测受试患者的血清RBP含量;予酶比色法测定血清UA。另外,使用日本产的sysmexCA8000牌血凝仪,予CLAUSS凝固法检测患者血浆FIB及DD含量。试剂购自上海的北加生化试剂有限公司,操作流程严格按照试剂盒说明书进行。

2 结 果
2.1 一般资料比较 两组在年龄、性别、高血压、糖尿病、吸烟、饮酒等方面比较,均无显著性差异(均P>0.05),两组样本具有可比性。对照组相比较,ICD组的血清UA以及血浆DD、FIB有明显增高,具有显著性差异(均P<0.05) (见表1)。
2.2 ICD组与对照组血清RBP水平比较 ICD组的血清RBP水平(56.11±14.01)mg/L,要显著高于对照组血清RBP水平(30.91±3.86)mg/L,差异具有显著统计学意义(t=73.455,P<0.05)。
2.3 ICD各组之间血清RBP水平比较 不稳定斑块组(32例)血清RBP水平要高于无斑块组(57例)血清RBP水平、稳定斑块组(32例)血清RBP水平,而稳定斑块组血清RBP水平则要高于无斑块组的血清RBP水平,差异均具有显著统计学意义(F=48.759,均P<0.05)。无斑块组、稳定斑块组、不稳定斑块组等血清RBP水平分别为(48.50±10.46)mg/L、(54.60±5.53)mg/L和(71.19±13.69)mg/L。
2.4 ICD组患者RBP与UA、DD、FIB之间的直线相关性分析 应用直线相关分析方法,显示出ICD组患者的RBP水平与UA、DD、FIB等之间并无明显的相关性(r=0.149、0.056、0.065,均P>0.05)。
2.5 血清RBP水平和发生颈动脉粥样斑块的关系 以是否存在ICD与颈动脉粥样斑块为因变量,血清RBP水平、年龄等作为自变量,采用Logistic回归分析,显示血清RBP与发生颈动脉粥样斑块关系密切,它是发生颈动脉粥样斑块的危险因素之一(OR=2.318,95%CI0.007~0.721)。
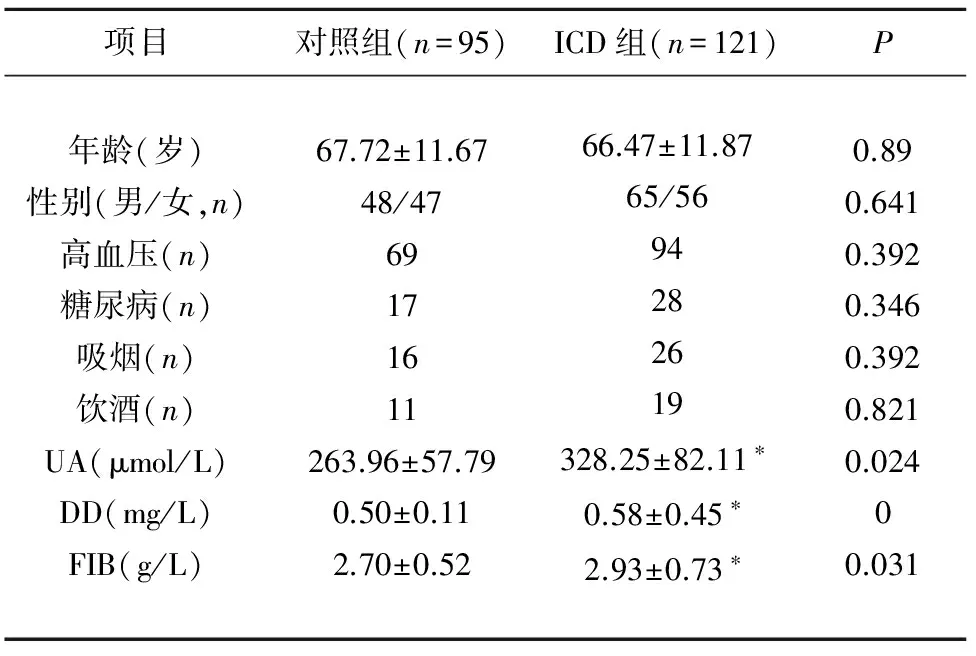
表1 ICD组与对照组一般临床资料比较
与对照组比较*P<0.05
3 讨 论
ICD是在多因素共同作用下的一种常见的脑血管疾病。AS又是ICD最重要的病因之一,也是ICD发生、发展的极其重要的发病机制之一[11,12]。众所周知,AS是一个非常复杂、漫长的病理过程,是动脉内皮细胞受到各种有害物质损害后,诱导机体产生多种血管活性物质,导致受损动脉发生慢性血管炎症反应[13]。AS最早期改变标志是血管内皮细胞受损,随后释放出大量的炎症介质,致使血管发生明显、持久的炎症反应,最终形成粥样斑块[14]。而双侧颈动脉是AS最易发生部位之一,颈动脉粥样硬化实际上为AS的局部表现之一,它与ICD发生关系密切[15]。若上述有害因素持续存在,可使动脉IMT厚度发生持续增加,使内膜不断发生损伤,导致动脉斑块形成,并突入到动脉管腔。当动脉斑块将逐渐增大,如发生在颈动脉时,颈动脉可出现狭窄,其动脉远端供血区域呈现低灌注状态,导致分水岭梗死形成[16]。若动脉病变持续进展,较易发生管腔阻塞;或出现斑块破裂,若斑块发生脱落,可栓塞于远端动脉;斑块表面发生破裂,可形成血栓,若发生一过性的阻塞,可发生TIA;严重时发生动脉急性、持续性阻塞,导致ACI。此外,高血压、糖尿病、高脂血症等均是发生ICD重要的危险因素[17],它们也是颈动脉粥样硬化发生的重要因素[18]。
与传统检查相比,颈动脉彩色超声检查具有无创、简便等优点,还有很强的直观性,能很好地显示颈部血管走行、血流的充盈、血管狭窄部位以及狭窄程度,能够及时发现颈部血管稳定及不稳定性斑块,对ICD的辅助诊断具有重要的临床意义[19]。
经研究发现,RBP水平升高可能与动脉粥样硬化的发生、发展密切相关。Mohapatra等学者认为,RBP是动脉粥样斑块发生的一个独立危险因素。RBP可通过以下机制来诱导动脉粥样硬化发生、发展:(1)促进胰岛素抵抗。有研究发现,胰岛素抵抗者的RBP水平明显升高,而检测葡萄糖转运子4(Glut4)水平的却有不同程度的降低,推测RBP可诱导Glut4水平发生下降,致使葡萄糖转运发生障碍,或激活MAPK信号通路,导致胰岛素发生抵抗,导致动脉平滑肌出现增殖[20]。(2)加重脂质代谢紊乱。有研究表明RBP参与甘油三酯、极低密度脂蛋白(VLDL)等代谢紊乱,间接促进胰岛素抵抗。(3)参与炎症反应。有研究发现,如果体内RBP发生升高,可使机体发生氧化应激反应,生成大量炎性因子,加速动脉硬化的发生、发展[5]。(4)加重尿酸代谢障碍。如果血清RBP水平不断升高,使血尿酸生成显著增加,导致血管内皮细胞功能发生紊乱,促进动脉发生硬化,当累及颈动脉时,可使其发生IMT增厚,不断促进病变动脉硬化发生、发展。因此,血清RBP和颈动脉硬化有紧密联系,可作为颈动脉患者发生ICD等并发症的预测指标之一。
仔细观察本实验结果,可以发现,与对照组相比,ICD患者组血清的RBP水平有明显升高,并且差异有显著的统计学意义(P<0.05),推测血清RBP水平可能是预测ICD的一个有价值的生化指标。此外,相比于颈动脉无斑块组,颈动脉稳定斑块组、颈动脉不稳定斑块组的血清RBP水平均有明显升高,尤以颈动脉不稳定斑块组升高最为明显,差异也具有显著的统计学意义(P<0.05),可以推测血液循环中RBP含量水平与双侧颈动脉、颅内动脉粥样硬化的发生、发展以及动脉斑块形成、破裂有关,而且能在一定程度上反映动脉局部发生病变的严重程度。还发现RBP水平和UA、DD、FIB等无相关性,并观察Logistic回归分析的结果,推测RBP有可能是ICD发生颈动脉粥样斑块的一个独立危险因素。故根据本文的研究结果分析,血浆RBP水平极有可能是一个预测颈动脉不稳定斑块的有用生物学指标。
本研究也存在一些不足之处:首先,动脉内膜增厚组样本量太小;其次,本实验是采用颈动脉彩色超声检查对所有病例组进行了分型,而由于操作者的主观性强,可能导致测量误差。这样就给我们对所有病例组的分型带来了一定的干扰。因此血浆RBP和脑梗死以及颈动脉斑块的稳定性之间的关系,还需要进一步深入研究,从而为脑梗死的预防和治疗工作提供更全面、准确的实验理论依据。
总之,RBP很有可能参与了ICD和颈动脉硬化的发生和发展,而且在一定程度上能反映ICD患者的颈动脉发生粥样硬化的程度。结合本研究结果来分析,血清RBP很可能是一个预测颈动脉不稳定斑块的有意义的生物学指标,可以用来协助判断颈动脉斑块的稳定性,便于早期能发现颈动脉内不稳定且易破裂的斑块,同时采取强有力、有效的临床干预措施,进而能明显降低ICD的发生率,为ICD的防治工作带来新的希望。
[1]Vinod KV,Verma SP,Karthikeyan B,et al.Cerebralinfarction leading to hemiplegia:A rare complication of acute pancreatitis[J].Indian J Crit Care Med,2013,17(5):308-310.
[2] Spalletta G,Cravello L,Imperiale F,et al.Neuropsychiatric symptoms and interleukin-6 serum levels in acute stroke[J].J Neuropsychiatry Clin Neurosci,2013,25(4):255-263.
[3]Kim G,Youn HJ,Choi YS,et al.Is carotid artery evaluation necessary for primary prevention in asymptomatic high-risk patients without atherosclerotic cardiovascular disease[J].Clin Interv Aging,2015,10:1111-1119.
[4]Liu X,Zhao S,Liu F,et al.Remote ischemic postconditioning alleviates cerebral ischemic injury by attenuating endoplasmic reticulum stress-mediated apoptosis[J].Transl Stroke Res,2014,5(6):692-700.
[5]Anthony D,George P,Eaton CB.Cardiac risk factors:environmental,sociodemographic,and behavioval cardiovascular risk factors[J].FP Essent,2014,421:16-20.
[6]董 皓,汤 涌,郭忠玉,等.RBP水平对颈动脉粥样硬化斑块形成及冠心病发病的影响[J].重庆医学杂志,2016,45(6):821-823.
[7]中华神经科学会,中华神经外科学会.各类脑血管疾病诊断要点[J].中华神经科杂志,1996,29(6):379-380.
[8]Polak JF,Szklo M,O’Leary DH,et al.Associations of coronary heart disease with common carotid artery near and far wall intima-media thickness:The multi-ethnic study of atherosclerosis[J].J Am Soc Echocardiogr,2015,28(9):1114-1121.
[9]Howard DP,Van Lammeren GW,Rothwell PM,et al.Symptomatic carotid atherosclerotic disease:correlations between plaque composition and ipsilateral stroke risk[J].Stroke,2015,46(1):182-189.
[10]Chistiakov DA,Sobenin IA,Orekhov AN.Vascular extracellular matrix in atherosclerosis[J].Cardiol Rev,2013,21(6):270-288.
[11]Yamada K,Kawasaki M,Yoshimura S,et al.High-intensity signal incarotid plaque on routine 3D-TOF-MRA is a risk factor of ischemic stroke[J].Cerebrovasc Dis,2015,41(1-2):13-18.
[12]Liem MI,Schreuder FH,van Dijk AC,et al.Use of a ntiplatelet A gents is associated with Intraplaque hemorrhage on carotid magnetic resonance imaging:the plaque at risk study[J].Stroke,2015,46(12):3411-3415.
[13]Shi D,Xia T,Feng H,et al.Evaluating the diagnostic value of vWF:Ag,D-D and FDP in patients with acutecerebral infarction using ROC curves[J].Exp Ther Med,2014,7(6):1573-1577.
[14] Yapei Y,Xiaoyan R,Sha Z,et al.Clinical significance of arterial stiffness and thickness biomarkers in type 2 diabetes mellitus: An up-to-date Meta-analysis[J].Med Sci Monit,2015,21(21):2467-2475.
[15]Hanssen NM,Wouters K,Huijberts MS,et al.Higher levels of advanced glycation endproducts in human carotid atherosclerotic plaques are associated with a rupture-prone phenotype[J].Eur Heart J,2014,35(17):1137-1146.
[16]Saam T,Hetterich H,Hoffmann V,et al.Meta-analysis and systematic review of the predictive value of carotid plaque hemorrhage on cerebrovascular events by magnetic resonance imaing[J].J Am Coll Cardiol,2013,62(12):1081-1091.
[17]Khoury JC,Kleindorfer D,Alwell K,et al.Diabetes mellitus:a risk factor for ischemic stroke in a large biracial population[J].Stroke,2013,44(6):1500-1504.
[18]Catapano AL,Chapman MJ,Debacker G,et al.Comment to the position paper on global recommendations for the management of dyslipidemia developed by the International Atherosclerosis Society (IAS)[J].Atherosclerosis,2014,233(2):508-509.
[19]Janda K,Krzanowshi M,Gajda M,et al.Cardiovascular risk in chronic kidney disease patients:intima-media thickness predicts the incidence and severity of histologically assessed medial calcification in radial arteries[J].BMC Nephrol,2015,3(16):78.
[20]Li F,Xia K,Sheikh SA,et al.Involvement of RBP4 in hyperinsulinism-induced vascular smooth muscle cell proliferation[J].Endocrine,2015,48(2):472-482.
Relationship of serum levels of RBP with carotid atherosclerotic plaque in ischemic cerebrovascular disease
XUDongsheng,WANGYinming,YINXiaojing,etal.
(DepartmentofNeurology,theThirdAffiliatedHospitalofNantongUniversity,theThirdPeople’sHospitalofWuxiCity,Wuxi214041,China)
Objective To discuss the relationship of serum levels of retinol-binding protein (RBP) with carotid atherosclerotic plaque in ischemic cerebrovascular disease (ICD).Methods The levels of the serum RBP,acid (UA)and the levels of plasma D-dimer(D-D),fibrinogen (FIB) were detected in 121 patients with ischemic cerebrovascular disease and 95 normal controls at the some time.Patients with ICD were divided into no plaque group (57 cases),stable plaque group (32 cases),unstable plaque group (32 cases) according to their carotid artery sonography.The serum levels of RBP were determined and compared among different groups.Results Serum levels of RBP in patients with ICD were significantly increased than those of normal control subjects (P<0.05).Among patients with ICD,the serum levels of RBP in stable plaque group and unstable plaque group were significantly increased compared with no plaque group (allP<0.05),and Among patients with ICD,the serum levels of RBP in unstable plaque group were significantly increased compared with in stable plaque group (P<0.05).Linear correlation analysis showed that serum levels of RBP was not correlated with those of UA,D-D and FIB (r= 0.149,0.056,0.065,allP>0.05).Logistic regression shows that RBP are the risk factors of recurrence of carotid atherosclerotic plaque (OR=2.318,95%CI 0.007-0.721).Conclusions Serum RBP may be closely related to the occurrence and development of atherosclerosis.It could be associated with stability of atherosclerotic Plaques in patients with ICD.
Ischemic cerebrovascular disease; Carotid artery plaque; Retinol-binding protein
2016-10-13;
2016-11-29
(南通大学附属第三医院,无锡市第三人民医院神经内科,江苏 无锡 214041)
徐东升,E-mail:2115505905@qq.com
1003-2754(2017)02-0115-04
R743.3
A

